物质结构复习[下学期]
图片预览







文档简介
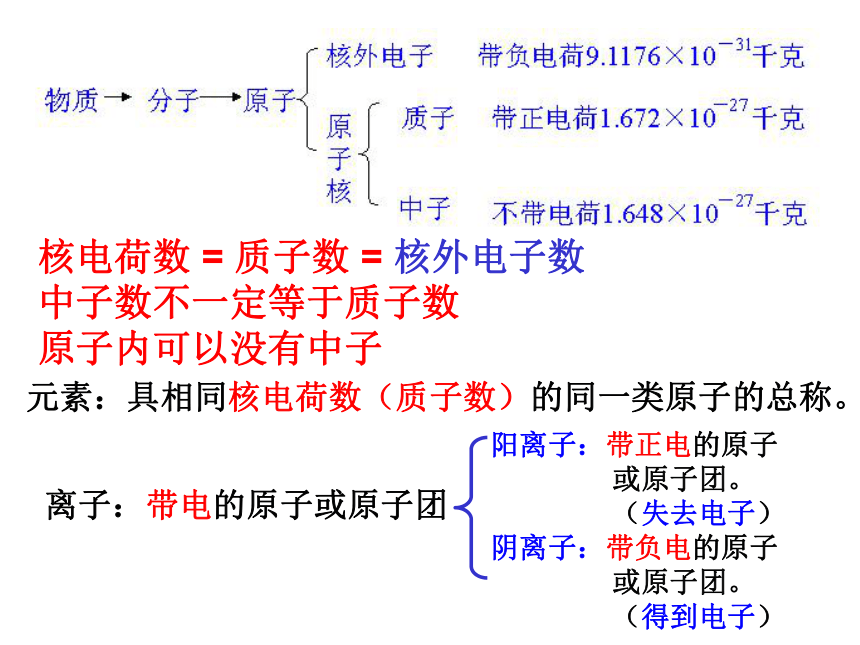
课件33张PPT。物质的组成和分类复习准备好迎接新的学习核电荷数 = 质子数 = 核外电子数
中子数不一定等于质子数
原子内可以没有中子离子:带电的原子或原子团阳离子:带正电的原子
或原子团。
(失去电子)
阴离子:带负电的原子
或原子团。
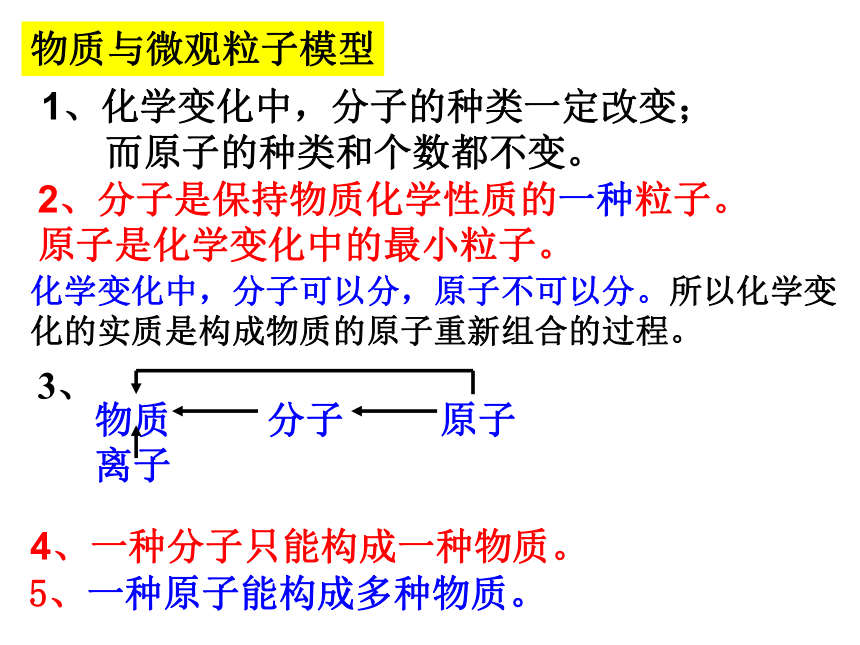
(得到电子)元素:具相同核电荷数(质子数)的同一类原子的总称。物质与微观粒子模型1、化学变化中,分子的种类一定改变;
而原子的种类和个数都不变。2、分子是保持物质化学性质的一种粒子。
原子是化学变化中的最小粒子。4、一种分子只能构成一种物质。5、一种原子能构成多种物质。化学变化中,分子可以分,原子不可以分。所以化学变
化的实质是构成物质的原子重新组合的过程。1、物质的分类单质:由同种元素组成的纯净物。化合物:由不同种元素组成的纯净物。单质
化合物单质 金属:铁、铜、铝、锌非金属:氧气、氮气、氢气、碳、硅、磷、硫(包括稀有气体:氦气、氖气、氩气等)2、元素的种类金属元素
非金属元素(包括稀有元素)组成物质的元素元素的分布:
地壳中的元素:主要由氧、硅、铝、铁等;
人体主要由氧、碳、氢三种元素组成。
海水中的元素分布由氢元素、氧元素、氯元素、
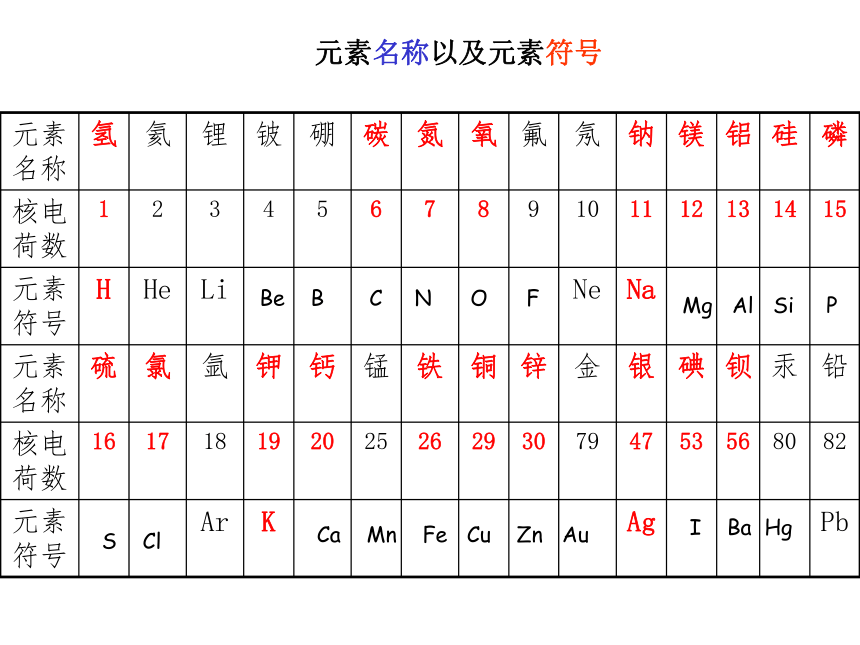
钠元素,还有贵重金属,如金等。表示元素的符号练习:说说下列符号的意义
O 2H Na 2Mg?
元素名称以及元素符号Be B C N O FMg Al Si PS ClCa Mn Fe Cu Zn AuI Ba Hg练习1.下列物质中,含有氧分子的有( ),其分子中含有氧原子的有 ( ),
含有氧元素的有( )。属于单质的是( ),属于化合物的是( ),
属于混合物的是( )。
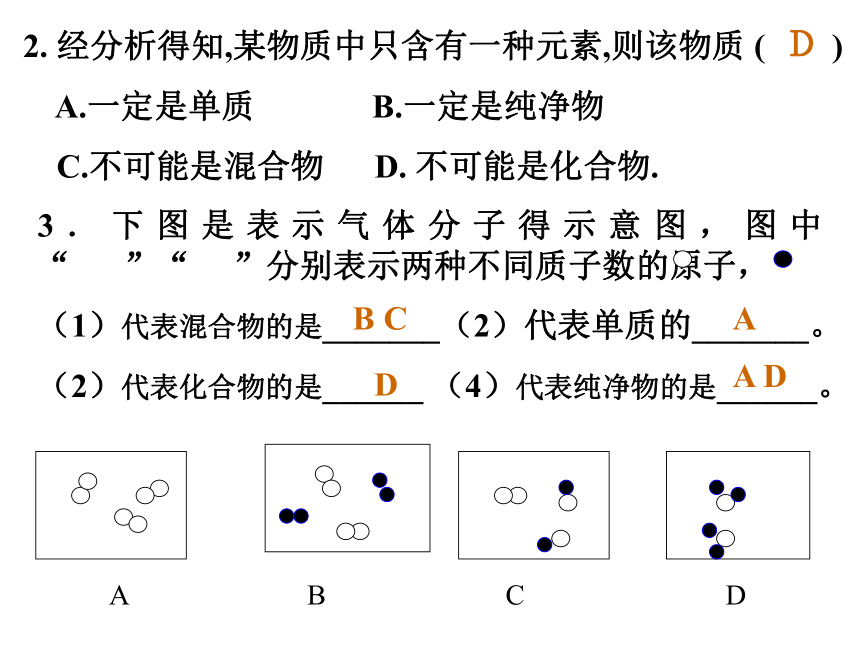
A.水 B.氧气 C.空气 D.二氧化碳 E.氢气 F.氯化钠 (食盐) H.铜B C ABCDBEHABCDADFC2. 经分析得知,某物质中只含有一种元素,则该物质 ( )
A.一定是单质 B.一定是纯净物
C.不可能是混合物 D. 不可能是化合物.D3.下图是表示气体分子得示意图,图中“ ”“ ”分别表示两种不同质子数的原子,
(1)代表混合物的是_______(2)代表单质的_______。
(2)代表化合物的是______ (4)代表纯净物的是______。 A B C DB CA DA D1、离子符号是在形成该离子的原子的元素符号右上角
标出该离子所带的电荷数(左数目右符号)。 Cl- Na+ Ca2+ Mg2+ SO42-2、离子或根所带单位电荷数与元素或原子团的化合价
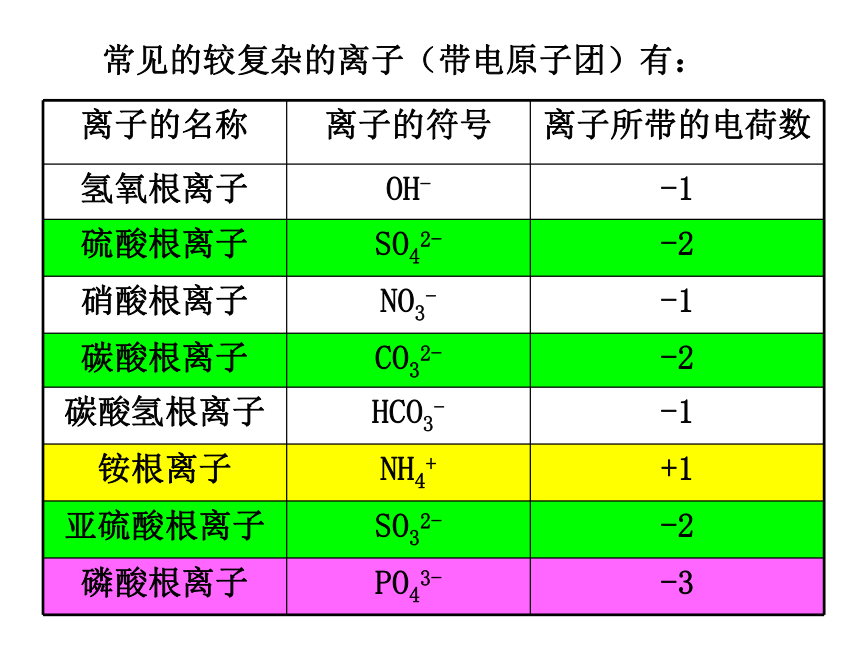
数值相同,所带电荷的电性与化合价的正或负相同。离子:带电的原子或原子团常见的较复杂的离子(带电原子团)有:三、化合价1、含义:各种元素在相互化合时,原子之间都有固定的化合数目,用化合价表示这种性质。2、化合价的种类:有正价和负价之分。3、化合价的表示方法:在元素符号正上方用带“+”“-”的小数字表示。思考:化合价在数值上与什么有关呢?4、在化合物中所有元素化合价的代数和为零。-1+4-2+6-2+2+15、常见元素的化合价 6、化合价的一般规律(1)在化合物里氢元素通常显+1价、氧元素-2价。(2)金属元素在化合物中通常显正价。(3)非金属元素与氧元素结合时显正价,与氢元素和 金属结合形成化合物时显负价。(4)单质里元素的化合价为零。(5)在化合物里,元素正负化合价的代数和为零。7、原子团的化合价:-1
-1
+1
-2
-2
-2
-3与原子团所带电荷相同原子团中各元素化合价的代数和就是该原子团的化合价。标在元素符号的正上方 左符号右数目标在元素符号的右上角 左数目右符号Al3+、O2-、Mg2+同种元素的化合价与离子的电荷,通常数值相等,正负相同,位置不同,写法相反化合价与离子的区别:+3-2+ 2在氧化镁中镁元素的化合价为+2价一个镁离子带2个单位正电荷说出下列数字的意义:2、确定依据:由实验确定,一种物质只有一个化学式。3、书写原则:(2)化合物氢金前,非氧后(一般情况下)表示物质的符号 一、化学式1、概念:用元素符号来表示物质组成的式子。①气态非金属单质:双原子分子如:氧O2、氮N2、氯Cl2、氟F2、氢H2 液态非金属单质:溴Br2
固态非金属单质:碘I2三原子分子:臭氧O3②金属单质、固态非金属单质、稀有气体:直接用元素
符号表示(1)单质4.读法:一般从右到左读“某化某”;
或指出一个分子里的原子个数5.意义:
宏观:①表示一种物质
②表示这种物质由什么元素组成
微观:①表示这种物质的一个分子(原子)
②表示这种物质一个分子中各元素的原子个数 6、多个分子个数的表示方法先写化学式,再在化学式前边乘以分子个数。1、H2O、2H2O所表示的意义是什么?
2、写出下列符号中“2”所表示的意义:
(1)2H (2)H2 (3)2H2H2O: 1、水 2、一个水分子 3、水由氢、氧元素组成 4、一个水分子由2个氢原子和一个氧原子构成
2H2O: 表示2个水分子
2H:2 个氢原子
H2:一个氢分子由2个氢原子构成
2H2: 2个氢分子;每个氢分子由2个氢原子构成8、根据元素化合价书写化合物的化学式 例:写出氧化铝的化学式。(1)写出组成化合物的元素符号,一般正左负右。(2)在元素符号正上方标出相应的化合价。(3)用交叉法写化学式(交叉法:去正负号,约简,上数交叉下移,1不写)。(4)检查化学式的正误。原理:化合物中正负化合价代数和等于零。
Al O(+3)×2 + (-2)×3 = 6 – 6 = 023课内练习一书写下列物质的化学式:氯化钙_____________
碳酸钾_____________
硝酸钡_____________CaCl2k2CO3Ba (NO3)2练习:
一:写出下列物质的化学式:
(1)氧气 (2)氯化钠 (3)二氧化碳 (4)水
(5)四氧化三铁 (6)五氧化二磷 (7)二氧化硫 (8)二氧化锰 (9)铁 (10)硫
(11)氩气 (12)氯气
(13)氧化铝 (14)氯化锌二、写出下列物质的名称:
(1)CaO (2)H2
(3)Al2O3 (4)MgCl2
(5)Cl2 (6)He
(7)Na2O (8)MgS
四、标出下列元素的化合价:
CO2 H2CO3 NH4NO3
SO2 H2SO4 Na2SO3
NH3 KMnO4 K2MnO4
N2 SiO2 H3PO4
AlCl3 AgBr Fe(OH)3
Cu(OH)2 BaCO3 MnO2 MgO Cu2O FeO CaSO4
一、相对原子质量 以C-12质量的1/12作为标准,其他原子的质量跟它相比所得的值,就是该原子的相对原子质量。
单位为“1”(“1”通常不写)相对原子质量=——————————
112某原子的质量C-12原子的质量×相对原子质量 = 质子数 + 中子数氢 1 0 1 1 8 8 16 钠 11 11 11镁 12 12 24氯 17 17 35铝 13 14 13铁 26 26 56练习:说出下列符号所表达的意义:1、H:2、Fe:氢元素一个氢原子氢的相对原子质量是1铁元素一个铁原子金属铁铁的相对原子质量是56例题一:计算 硫酸的相对分子质量是多少?相对分子质量例二:水的化学式是H2O,求H2O中氢元素和氧元素的质量比。例三、求化肥碳酸氢铵(NH4HCO3)中氮元素的质量分数。CO2二氧化碳这种物质(1个)二氧化碳分子由(2个)氧原子和(1个)碳原子构成二氧化碳由碳元素 和氧元素组成二氧化碳分子二氧化碳的相对分子质量为:12+2×16=44CO2还可以表示什么?⑥在CO2中,碳、氧元素的质量比 =
12: (16×2)=3:8⑦在CO2中,碳元素的质量分数和氧元素的
质量分数⑧在CO2中,碳、氧原子的个数比为1:2三、计算物质的相对分子质量:
1、H2O
2、KClO3
3、Ca(OH)2
4、2CO2
5、H2SO3
6、C6H6O6
7、CuSO4`5H2O
五、计算物质中各元素的质量比:
MgO H3PO4 C6H12O6
六、计算物质中氮元素质量分数:
NH4HCO3 (NH4)2SO4
NH4Cl CO(NH2)2
中子数不一定等于质子数
原子内可以没有中子离子:带电的原子或原子团阳离子:带正电的原子
或原子团。
(失去电子)
阴离子:带负电的原子
或原子团。
(得到电子)元素:具相同核电荷数(质子数)的同一类原子的总称。物质与微观粒子模型1、化学变化中,分子的种类一定改变;
而原子的种类和个数都不变。2、分子是保持物质化学性质的一种粒子。
原子是化学变化中的最小粒子。4、一种分子只能构成一种物质。5、一种原子能构成多种物质。化学变化中,分子可以分,原子不可以分。所以化学变
化的实质是构成物质的原子重新组合的过程。1、物质的分类单质:由同种元素组成的纯净物。化合物:由不同种元素组成的纯净物。单质
化合物单质 金属:铁、铜、铝、锌非金属:氧气、氮气、氢气、碳、硅、磷、硫(包括稀有气体:氦气、氖气、氩气等)2、元素的种类金属元素
非金属元素(包括稀有元素)组成物质的元素元素的分布:
地壳中的元素:主要由氧、硅、铝、铁等;
人体主要由氧、碳、氢三种元素组成。
海水中的元素分布由氢元素、氧元素、氯元素、
钠元素,还有贵重金属,如金等。表示元素的符号练习:说说下列符号的意义
O 2H Na 2Mg?
元素名称以及元素符号Be B C N O FMg Al Si PS ClCa Mn Fe Cu Zn AuI Ba Hg练习1.下列物质中,含有氧分子的有( ),其分子中含有氧原子的有 ( ),
含有氧元素的有( )。属于单质的是( ),属于化合物的是( ),
属于混合物的是( )。
A.水 B.氧气 C.空气 D.二氧化碳 E.氢气 F.氯化钠 (食盐) H.铜B C ABCDBEHABCDADFC2. 经分析得知,某物质中只含有一种元素,则该物质 ( )
A.一定是单质 B.一定是纯净物
C.不可能是混合物 D. 不可能是化合物.D3.下图是表示气体分子得示意图,图中“ ”“ ”分别表示两种不同质子数的原子,
(1)代表混合物的是_______(2)代表单质的_______。
(2)代表化合物的是______ (4)代表纯净物的是______。 A B C DB CA DA D1、离子符号是在形成该离子的原子的元素符号右上角
标出该离子所带的电荷数(左数目右符号)。 Cl- Na+ Ca2+ Mg2+ SO42-2、离子或根所带单位电荷数与元素或原子团的化合价
数值相同,所带电荷的电性与化合价的正或负相同。离子:带电的原子或原子团常见的较复杂的离子(带电原子团)有:三、化合价1、含义:各种元素在相互化合时,原子之间都有固定的化合数目,用化合价表示这种性质。2、化合价的种类:有正价和负价之分。3、化合价的表示方法:在元素符号正上方用带“+”“-”的小数字表示。思考:化合价在数值上与什么有关呢?4、在化合物中所有元素化合价的代数和为零。-1+4-2+6-2+2+15、常见元素的化合价 6、化合价的一般规律(1)在化合物里氢元素通常显+1价、氧元素-2价。(2)金属元素在化合物中通常显正价。(3)非金属元素与氧元素结合时显正价,与氢元素和 金属结合形成化合物时显负价。(4)单质里元素的化合价为零。(5)在化合物里,元素正负化合价的代数和为零。7、原子团的化合价:-1
-1
+1
-2
-2
-2
-3与原子团所带电荷相同原子团中各元素化合价的代数和就是该原子团的化合价。标在元素符号的正上方 左符号右数目标在元素符号的右上角 左数目右符号Al3+、O2-、Mg2+同种元素的化合价与离子的电荷,通常数值相等,正负相同,位置不同,写法相反化合价与离子的区别:+3-2+ 2在氧化镁中镁元素的化合价为+2价一个镁离子带2个单位正电荷说出下列数字的意义:2、确定依据:由实验确定,一种物质只有一个化学式。3、书写原则:(2)化合物氢金前,非氧后(一般情况下)表示物质的符号 一、化学式1、概念:用元素符号来表示物质组成的式子。①气态非金属单质:双原子分子如:氧O2、氮N2、氯Cl2、氟F2、氢H2 液态非金属单质:溴Br2
固态非金属单质:碘I2三原子分子:臭氧O3②金属单质、固态非金属单质、稀有气体:直接用元素
符号表示(1)单质4.读法:一般从右到左读“某化某”;
或指出一个分子里的原子个数5.意义:
宏观:①表示一种物质
②表示这种物质由什么元素组成
微观:①表示这种物质的一个分子(原子)
②表示这种物质一个分子中各元素的原子个数 6、多个分子个数的表示方法先写化学式,再在化学式前边乘以分子个数。1、H2O、2H2O所表示的意义是什么?
2、写出下列符号中“2”所表示的意义:
(1)2H (2)H2 (3)2H2H2O: 1、水 2、一个水分子 3、水由氢、氧元素组成 4、一个水分子由2个氢原子和一个氧原子构成
2H2O: 表示2个水分子
2H:2 个氢原子
H2:一个氢分子由2个氢原子构成
2H2: 2个氢分子;每个氢分子由2个氢原子构成8、根据元素化合价书写化合物的化学式 例:写出氧化铝的化学式。(1)写出组成化合物的元素符号,一般正左负右。(2)在元素符号正上方标出相应的化合价。(3)用交叉法写化学式(交叉法:去正负号,约简,上数交叉下移,1不写)。(4)检查化学式的正误。原理:化合物中正负化合价代数和等于零。
Al O(+3)×2 + (-2)×3 = 6 – 6 = 023课内练习一书写下列物质的化学式:氯化钙_____________
碳酸钾_____________
硝酸钡_____________CaCl2k2CO3Ba (NO3)2练习:
一:写出下列物质的化学式:
(1)氧气 (2)氯化钠 (3)二氧化碳 (4)水
(5)四氧化三铁 (6)五氧化二磷 (7)二氧化硫 (8)二氧化锰 (9)铁 (10)硫
(11)氩气 (12)氯气
(13)氧化铝 (14)氯化锌二、写出下列物质的名称:
(1)CaO (2)H2
(3)Al2O3 (4)MgCl2
(5)Cl2 (6)He
(7)Na2O (8)MgS
四、标出下列元素的化合价:
CO2 H2CO3 NH4NO3
SO2 H2SO4 Na2SO3
NH3 KMnO4 K2MnO4
N2 SiO2 H3PO4
AlCl3 AgBr Fe(OH)3
Cu(OH)2 BaCO3 MnO2 MgO Cu2O FeO CaSO4
一、相对原子质量 以C-12质量的1/12作为标准,其他原子的质量跟它相比所得的值,就是该原子的相对原子质量。
单位为“1”(“1”通常不写)相对原子质量=——————————
112某原子的质量C-12原子的质量×相对原子质量 = 质子数 + 中子数氢 1 0 1 1 8 8 16 钠 11 11 11镁 12 12 24氯 17 17 35铝 13 14 13铁 26 26 56练习:说出下列符号所表达的意义:1、H:2、Fe:氢元素一个氢原子氢的相对原子质量是1铁元素一个铁原子金属铁铁的相对原子质量是56例题一:计算 硫酸的相对分子质量是多少?相对分子质量例二:水的化学式是H2O,求H2O中氢元素和氧元素的质量比。例三、求化肥碳酸氢铵(NH4HCO3)中氮元素的质量分数。CO2二氧化碳这种物质(1个)二氧化碳分子由(2个)氧原子和(1个)碳原子构成二氧化碳由碳元素 和氧元素组成二氧化碳分子二氧化碳的相对分子质量为:12+2×16=44CO2还可以表示什么?⑥在CO2中,碳、氧元素的质量比 =
12: (16×2)=3:8⑦在CO2中,碳元素的质量分数和氧元素的
质量分数⑧在CO2中,碳、氧原子的个数比为1:2三、计算物质的相对分子质量:
1、H2O
2、KClO3
3、Ca(OH)2
4、2CO2
5、H2SO3
6、C6H6O6
7、CuSO4`5H2O
五、计算物质中各元素的质量比:
MgO H3PO4 C6H12O6
六、计算物质中氮元素质量分数:
NH4HCO3 (NH4)2SO4
NH4Cl CO(NH2)2
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
