元素及其化合物[下学期]
图片预览







文档简介
课件29张PPT。元素及其化合物 氧 气氧 气 的 性 质物理性质:通常情况下,无色、无味,密 度比空气大,不易溶于水。化学性质1、与非金属单质反应:C、S、
P、H22、与金属 单质反应:Fe、Mg、Cu3、与化合物反应:CO、CH4、
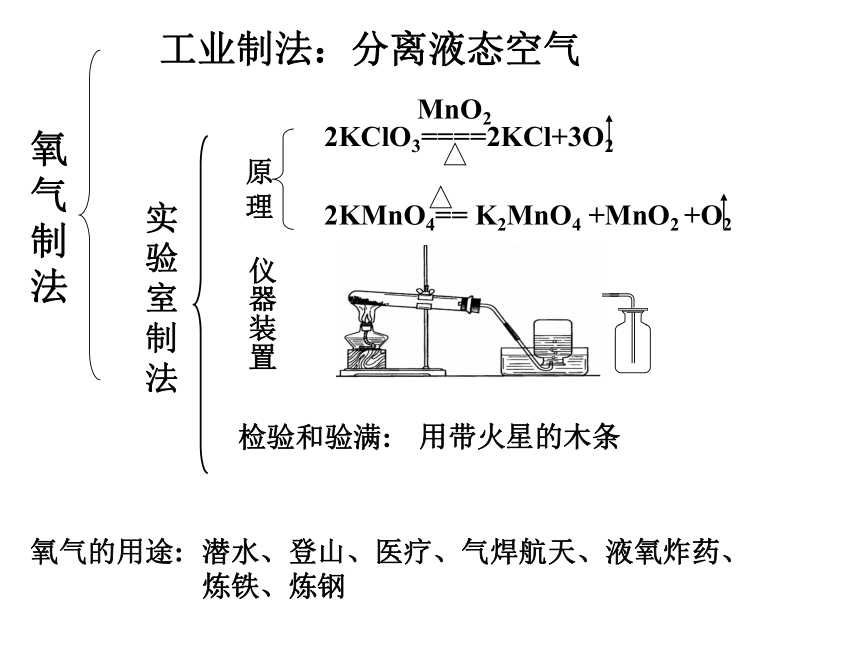
C2H5OH、CH3OH等有机物氧气制法工业制法:分离液态空气实验室制法原理仪器装置检验和验满:用带火星的木条氧气的用途:潜水、登山、医疗、气焊航天、液氧炸药、炼铁、炼钢燃烧和缓慢氧化: 通常所说的燃烧是指可燃物跟空气中的氧气发生的一种发光发热的剧烈的氧化反应
燃烧的条件:与氧气接触和温度达到着火点 灭火的方法:隔绝氧气或降低温度到着火点以下或隔绝可燃物 缓慢氧化:氧化反应不象燃烧哪样剧烈,放出的热量也不容易察觉。例如:金属的锈蚀、食物的腐败、酒的酿造等。水 1、水的物理性质:通常是无色、无味的透明液体。在标准大气压 下,熔点0℃,沸点100℃,4℃时的密度为1g/cm 。冰的密度小于水。32、水的组成的确定:电解水实验2H2O 2H2 + O2通电负极正极气体体积 2 : 1 质 量 比 1 : 8 3、水的化学性质:(1)水的分解 (2)与酸性氧化物
反应生成酸 (3)与碱性氧化物反应生成碱 (4)与很活泼金属反应生成碱和氢气(5)与碳反应生成水煤气 (6) 与硫酸铜等反应4、水的用途: 氢 气物理性质:通常情况下:是无色、无味的 气体,密度比空气小,是最轻的气体,难溶于水。氢 气 的 性 质化 学 性 质可燃性:2H2 +O2 2H2O
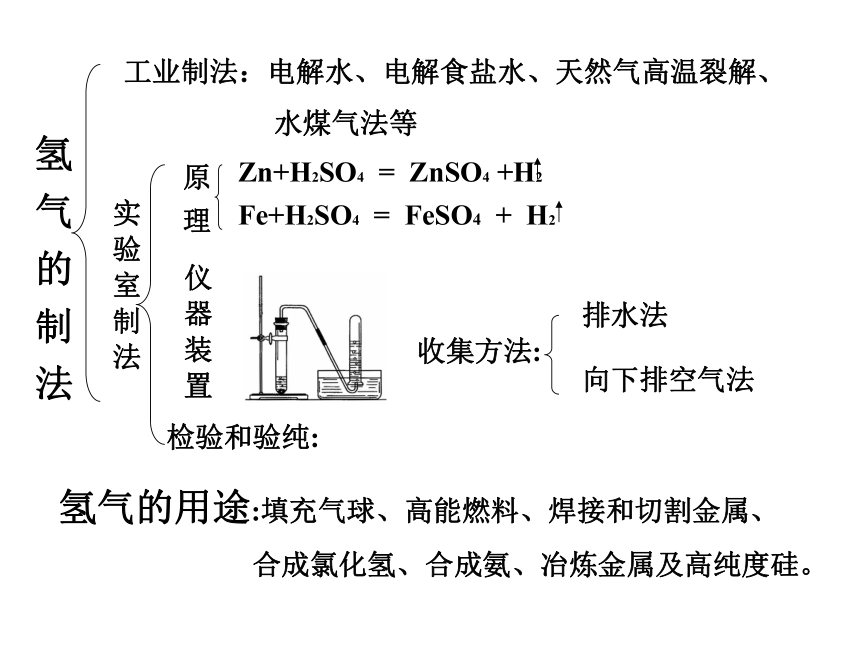
2H2+Cl2 2HCl点燃点燃还原性:H2+CuO Cu+H2O3H2+Fe2O3 2Fe+3H2O氢 气 的 制 法工业制法:电解水、电解食盐水、天然气高温裂解、
水煤气法等实 验 室 制 法原 理Zn+H2SO4 = ZnSO4 +H2Fe+H2SO4 = FeSO4 + H2仪 器 装 置检验和验纯:收集方法:排水法向下排空气法氢气的用途:填充气球、高能燃料、焊接和切割金属、
合成氯化氢、合成氨、冶炼金属及高纯度硅。
碳和碳的化合物一、碳的单质:金刚石、石墨 (无定形碳)
碳原子排列不同造成它们物理性质有很大差异碳单质的化学性质:在常温下很稳定,随温度的升高活动
性增强。1、可燃性:氧气充足 C + O2 CO2
氧气不足 2C + O2 2CO点燃点燃CO2CO3/83/4O2CO2
cOCCO2 CO例题1 将3g碳和5g氧气放入密闭容器中,一定条件下充分反应,最后密闭容器中是什么物质? 例题2 在相同温度和相同体积的条件下,气体压 强(p)与气体分子数目(n)成正比关系(p=Kn)。将ag 碳和bg氧气放入一密闭容器中,测得容器内的气体压强为p,然后,提供一定条件使容器内的物质发生充分反应,待温度复原时,测得容器内的气体压强仍然为p。则a与b的关系可能为
A a= b B a> b C a< b D a> b383838342、碳的还原性:(1)还原金属氧化物:
C + 2CuO Cu + CO2
3C + 2Fe2O3 4Fe +3CO2高温高温(2)还原非金属氧化物:
C + CO2 2CO
C + H2O CO +H2高温高温 化学性质:通常情况下,既不燃烧也不支持燃烧;具有酸性氧化物的共性 CO2 +H2O = H2CO3
CO2 + Ca(OH)2 = CaCO3 +H2O
CO2 + H2O + CaCO3 = Ca(HCO3)2二、碳的化合物:1、二氧化碳
(1)CO2的性质:
物理性质:通常情况是无色气体,能溶于水,密度比空气大,容易液化,固体CO2叫干冰,干冰易升华。 (2) CO2的用途: 是一种工业原料,可制纯碱、尿素、汽水等。干冰可作制冷剂,用来保食品、用于人工降雨。供植物光合作用。作灭火剂。(3)二氧化碳的制法二氧化碳的制法
工业制法:高温煅烧石灰石 CaCO3 CaO + CO2 高温实验室制法原理 CaCO3 + 2HCl = CaCl2 +H2O + CO2药品 大理石或石灰石和稀盐酸发生装置 (与氢气同) 收集方法 向上排空气验满 用带火星的木条,放在集气瓶口检验 用澄清的石灰水 2、一氧化碳(1)一氧化碳的性质
物理性质:通常情况下是无色、无色的气体密度比空气略小,难溶于水。 化学性质:可燃性 2CO + O2 2CO2 点燃还原性 CO +CuO Cu +CO2
yCO + FexOy xFe +yCO2毒 性 CO有剧毒。 (2)一氧化碳对空气的污染
目前全世界人为排放出的CO总量每年约为几亿吨。其中,一半以上来自汽车排放的废气,其余主要来自煤等燃料的燃烧和石油炼制、钢铁冶炼等。森林火灾、生物的腐烂等过程也产生一氧化碳。高温三种还原剂——C、H2、CO比较1、物质类别: C、H2 是非金属单质,CO是化合物。2、物理性质:木炭为黑色固体,不溶于水。H2、CO都是无色、无味的气体,难溶于水,CO的密度比空气略小,H2是最轻的气体。3、化学性质: C、H2、CO都可燃性、还原性。CO有剧毒。4、还原CuO实验的比较:仪器装置:实验现象:操作注意事项:反应速度:碳酸钙的性质、石灰石的用途及碳酸盐的鉴定1、碳酸钙的物理性质: 纯净的碳酸钙是白色粉末,难溶于水。
碳酸钙在自然界中主要以大理石、石灰石和白垩的形式存在。大理石是自然界中比较纯净的碳酸钙;石灰石是自然界中含杂质较多的碳酸钙;白垩产于海洋中,是比较纯净的碳酸钙。2、碳酸钙的化学性质(1)碳酸钙与盐酸反应:(2)碳酸钙在高温下分解:(3)碳酸钙和碳酸氢钙之间可以互相转化:3、石灰石、大理石的用途:它的都是重要的建筑材料。天安门的华表、人民大会堂的不少柱子都是用大理石做的。石灰石也是建筑上常用的石料。工业上用石灰石制生石灰,同时得到副产品二氧化碳。把粉碎的石灰石和粘土按适当比率混合,再加强热,就制得水泥。碳酸盐的鉴定原理:碳酸盐中都含有碳酸根,碳酸根遇到酸中的氢离子, 会生成二氧化碳气体。即: 2H+ + CO32- = CO2 +H2O试剂:稀盐酸和澄清石灰水。方法:取少量待测液于试管中,向其中滴加稀盐酸或稀硝
酸,将生成的气体通入澄清石灰水中。现象:有大量气泡产生,澄清石灰水变浑浊。例如:CaCO3+2HCl = CaCl2+H2O+CO2↑ Na2CO3+2HCl = 2NaCl+H2O+CO2↑ 3、碳的有机物(1)甲烷 CH4 俗称 沼气
甲烷是无色、无味的气体,密度比空气小,极难溶于水,可以燃烧 CH4 + 2O2 CO2 + 2H2O 点燃(2)乙醇 C2H5OH 俗称 酒精乙醇是无色透明、具有特殊气味的液体。易挥发,能与水以任意比互溶,能溶解多种有机化合物。有可燃性
C2H5OH + 3O2 2CO2 + 3H2O 点燃 (3)甲醇 有毒,饮后会使人眼睛失明,饮用大量时会使人死亡。因此,绝对禁止饮用工业酒精,也绝不允许用工业酒精来配酒出售。(4)乙酸 CH3COOH 俗称 醋酸醋酸是无色透明、具有酸味的液体。易挥发,16 ℃时变为冰样固体也称冰醋酸。醋酸具有酸的通性:
碳及碳的化合物的关系CO2CH2CO3CaCO3COCa(HCO3)2CH4C2H5OHCH3OH常 见 的 几 种 金 属铁的物理性质:纯铁具有银白色金属光泽,质软,有良好的延展性。是电和热的导体。 铁的化学性质:( 铁、铝、铜、锌、钛 )1、与非金属单质反应:铁在氧气中燃烧,生成四氧化三铁铁在潮湿空气中生锈,铁锈的主要成分是三氧化二铁铁在氯气中燃烧,生成氯化铁铁粉和硫粉混合加热,生成硫化亚铁2、与酸反应,生成亚铁盐和氢气3、与某些盐溶液反应,生成亚铁盐和另一种金属 铝具有银白色金属光泽,密度小是轻金属。具有良好的延展性、导电、导热性,(导电性能仅次于银和铜)。 在空气中,铝表面能形成一层致密的氧化膜。对浓硝酸有耐腐蚀性能。铝在高温时有很强的还原性。(野外钢轨的焊接)铝能与非氧化性酸反应,生成铝盐和氢气。铝能与某些盐溶液反应,生成铝盐的另一种金属。铜具有紫红色金属光泽,具有良好的延展性、导电和导热性(导电性仅次于银)。铜在潮湿空气中生成碱式碳酸铜(铜绿)。2Cu +O2 +H2O +CO2 = Cu2(OH)2CO3铜在空气中加热 2Cu + O2 = 2CuO铜和某些盐溶液 Cu +Hg(NO3)2 =Hg +Cu (NO3)2 Cu +2AgNO3 = 2Ag + Cu (NO3)2
铜和氧化性酸反应 Cu + H2SO4(浓) CuSO4 + H2O + SO2Cu +HNO3(浓) Cu(NO3)2 + NO2 + H2O Cu +HNO3(稀) Cu(NO3)2 + NO + H2O
锌具有青白色金属光泽。锌在空气中能形成致密的氧化膜。锌能与非氧化性酸反应,生成锌盐和氢气。
锌能与某些盐溶液反应,生成锌盐的另一种金属。
钛具有银白色金属光泽,具有良好的延展性。
钛具有耐腐蚀性,不受大气和海水的影响,与各种浓度的硝酸、稀硫酸、各种弱碱的作用非常缓慢,但可溶于盐酸、浓硫酸和氢氟酸中。锌在空气中能形成致密的氧化膜。酸、碱、盐、氧化物 酸、碱、盐、氧化物分类繁杂、种类多、性质多、化学方程式多,所以初学起来感觉有些困难。同学们首先要掌握各类化合物的组成、定义、分类和命名,结合实验掌握各类化合物的通性。用归纳的方法化繁为简,使知识条理化,便于记忆。记忆后再进行综合,再使其融会贯通,能够灵活运用。氧 化 物定义分 类酸性氧化物碱性氧化物定义定义制法制法通性通性与碱反应生成盐和水与水反应生成相应的酸与碱性氧化物化合生成盐 非金属与氧气化合 部分含氧酸受热分解
部分含氧酸盐受热分解 金属与氧气化合 不溶性碱受热分解
部分含氧酸盐受热分解
与酸反应生成盐和水
与水反应生成相应的碱
与酸性氧化物化合生成盐酸定义分 类按有无氧元素分: 含氧酸 无氧酸按一个分子电离出氢离子个数分:一元酸 二元酸 三元酸按酸性强弱分: 强酸 中强酸 弱酸按沸点高低分:高沸点酸 低沸点酸 通 性与指示剂反应:与活泼金属反应生成盐和氢气与碱性氧化物反应生成盐和水与碱反应生成盐和水与盐反应生成新盐和新酸碱定义分类按氢氧根个数分:一元碱 二元碱 三元碱
碱性强弱分:强碱 中强碱 弱碱通性与指示剂反应与酸性氧化物反应生成盐和水与酸反应生成盐和水与盐反应生成新碱和新盐盐定义分类按组成分正盐酸式盐碱式盐按阴、阳离子种类分:钾盐、硫酸盐等按由什么酸、碱中和生成的盐分:通性与酸反应生成新盐和新酸与碱反应生成新盐和新碱与金属反应生成新盐和新金属与盐反应生成另外两种盐盐盐和水盐和盐碱和盐酸和盐金属和盐盐和氢气单质、氧化物、酸、碱、盐相互转化关系图
P、H22、与金属 单质反应:Fe、Mg、Cu3、与化合物反应:CO、CH4、
C2H5OH、CH3OH等有机物氧气制法工业制法:分离液态空气实验室制法原理仪器装置检验和验满:用带火星的木条氧气的用途:潜水、登山、医疗、气焊航天、液氧炸药、炼铁、炼钢燃烧和缓慢氧化: 通常所说的燃烧是指可燃物跟空气中的氧气发生的一种发光发热的剧烈的氧化反应
燃烧的条件:与氧气接触和温度达到着火点 灭火的方法:隔绝氧气或降低温度到着火点以下或隔绝可燃物 缓慢氧化:氧化反应不象燃烧哪样剧烈,放出的热量也不容易察觉。例如:金属的锈蚀、食物的腐败、酒的酿造等。水 1、水的物理性质:通常是无色、无味的透明液体。在标准大气压 下,熔点0℃,沸点100℃,4℃时的密度为1g/cm 。冰的密度小于水。32、水的组成的确定:电解水实验2H2O 2H2 + O2通电负极正极气体体积 2 : 1 质 量 比 1 : 8 3、水的化学性质:(1)水的分解 (2)与酸性氧化物
反应生成酸 (3)与碱性氧化物反应生成碱 (4)与很活泼金属反应生成碱和氢气(5)与碳反应生成水煤气 (6) 与硫酸铜等反应4、水的用途: 氢 气物理性质:通常情况下:是无色、无味的 气体,密度比空气小,是最轻的气体,难溶于水。氢 气 的 性 质化 学 性 质可燃性:2H2 +O2 2H2O
2H2+Cl2 2HCl点燃点燃还原性:H2+CuO Cu+H2O3H2+Fe2O3 2Fe+3H2O氢 气 的 制 法工业制法:电解水、电解食盐水、天然气高温裂解、
水煤气法等实 验 室 制 法原 理Zn+H2SO4 = ZnSO4 +H2Fe+H2SO4 = FeSO4 + H2仪 器 装 置检验和验纯:收集方法:排水法向下排空气法氢气的用途:填充气球、高能燃料、焊接和切割金属、
合成氯化氢、合成氨、冶炼金属及高纯度硅。
碳和碳的化合物一、碳的单质:金刚石、石墨 (无定形碳)
碳原子排列不同造成它们物理性质有很大差异碳单质的化学性质:在常温下很稳定,随温度的升高活动
性增强。1、可燃性:氧气充足 C + O2 CO2
氧气不足 2C + O2 2CO点燃点燃CO2CO3/83/4O2CO2
cOCCO2 CO例题1 将3g碳和5g氧气放入密闭容器中,一定条件下充分反应,最后密闭容器中是什么物质? 例题2 在相同温度和相同体积的条件下,气体压 强(p)与气体分子数目(n)成正比关系(p=Kn)。将ag 碳和bg氧气放入一密闭容器中,测得容器内的气体压强为p,然后,提供一定条件使容器内的物质发生充分反应,待温度复原时,测得容器内的气体压强仍然为p。则a与b的关系可能为
A a= b B a> b C a< b D a> b383838342、碳的还原性:(1)还原金属氧化物:
C + 2CuO Cu + CO2
3C + 2Fe2O3 4Fe +3CO2高温高温(2)还原非金属氧化物:
C + CO2 2CO
C + H2O CO +H2高温高温 化学性质:通常情况下,既不燃烧也不支持燃烧;具有酸性氧化物的共性 CO2 +H2O = H2CO3
CO2 + Ca(OH)2 = CaCO3 +H2O
CO2 + H2O + CaCO3 = Ca(HCO3)2二、碳的化合物:1、二氧化碳
(1)CO2的性质:
物理性质:通常情况是无色气体,能溶于水,密度比空气大,容易液化,固体CO2叫干冰,干冰易升华。 (2) CO2的用途: 是一种工业原料,可制纯碱、尿素、汽水等。干冰可作制冷剂,用来保食品、用于人工降雨。供植物光合作用。作灭火剂。(3)二氧化碳的制法二氧化碳的制法
工业制法:高温煅烧石灰石 CaCO3 CaO + CO2 高温实验室制法原理 CaCO3 + 2HCl = CaCl2 +H2O + CO2药品 大理石或石灰石和稀盐酸发生装置 (与氢气同) 收集方法 向上排空气验满 用带火星的木条,放在集气瓶口检验 用澄清的石灰水 2、一氧化碳(1)一氧化碳的性质
物理性质:通常情况下是无色、无色的气体密度比空气略小,难溶于水。 化学性质:可燃性 2CO + O2 2CO2 点燃还原性 CO +CuO Cu +CO2
yCO + FexOy xFe +yCO2毒 性 CO有剧毒。 (2)一氧化碳对空气的污染
目前全世界人为排放出的CO总量每年约为几亿吨。其中,一半以上来自汽车排放的废气,其余主要来自煤等燃料的燃烧和石油炼制、钢铁冶炼等。森林火灾、生物的腐烂等过程也产生一氧化碳。高温三种还原剂——C、H2、CO比较1、物质类别: C、H2 是非金属单质,CO是化合物。2、物理性质:木炭为黑色固体,不溶于水。H2、CO都是无色、无味的气体,难溶于水,CO的密度比空气略小,H2是最轻的气体。3、化学性质: C、H2、CO都可燃性、还原性。CO有剧毒。4、还原CuO实验的比较:仪器装置:实验现象:操作注意事项:反应速度:碳酸钙的性质、石灰石的用途及碳酸盐的鉴定1、碳酸钙的物理性质: 纯净的碳酸钙是白色粉末,难溶于水。
碳酸钙在自然界中主要以大理石、石灰石和白垩的形式存在。大理石是自然界中比较纯净的碳酸钙;石灰石是自然界中含杂质较多的碳酸钙;白垩产于海洋中,是比较纯净的碳酸钙。2、碳酸钙的化学性质(1)碳酸钙与盐酸反应:(2)碳酸钙在高温下分解:(3)碳酸钙和碳酸氢钙之间可以互相转化:3、石灰石、大理石的用途:它的都是重要的建筑材料。天安门的华表、人民大会堂的不少柱子都是用大理石做的。石灰石也是建筑上常用的石料。工业上用石灰石制生石灰,同时得到副产品二氧化碳。把粉碎的石灰石和粘土按适当比率混合,再加强热,就制得水泥。碳酸盐的鉴定原理:碳酸盐中都含有碳酸根,碳酸根遇到酸中的氢离子, 会生成二氧化碳气体。即: 2H+ + CO32- = CO2 +H2O试剂:稀盐酸和澄清石灰水。方法:取少量待测液于试管中,向其中滴加稀盐酸或稀硝
酸,将生成的气体通入澄清石灰水中。现象:有大量气泡产生,澄清石灰水变浑浊。例如:CaCO3+2HCl = CaCl2+H2O+CO2↑ Na2CO3+2HCl = 2NaCl+H2O+CO2↑ 3、碳的有机物(1)甲烷 CH4 俗称 沼气
甲烷是无色、无味的气体,密度比空气小,极难溶于水,可以燃烧 CH4 + 2O2 CO2 + 2H2O 点燃(2)乙醇 C2H5OH 俗称 酒精乙醇是无色透明、具有特殊气味的液体。易挥发,能与水以任意比互溶,能溶解多种有机化合物。有可燃性
C2H5OH + 3O2 2CO2 + 3H2O 点燃 (3)甲醇 有毒,饮后会使人眼睛失明,饮用大量时会使人死亡。因此,绝对禁止饮用工业酒精,也绝不允许用工业酒精来配酒出售。(4)乙酸 CH3COOH 俗称 醋酸醋酸是无色透明、具有酸味的液体。易挥发,16 ℃时变为冰样固体也称冰醋酸。醋酸具有酸的通性:
碳及碳的化合物的关系CO2CH2CO3CaCO3COCa(HCO3)2CH4C2H5OHCH3OH常 见 的 几 种 金 属铁的物理性质:纯铁具有银白色金属光泽,质软,有良好的延展性。是电和热的导体。 铁的化学性质:( 铁、铝、铜、锌、钛 )1、与非金属单质反应:铁在氧气中燃烧,生成四氧化三铁铁在潮湿空气中生锈,铁锈的主要成分是三氧化二铁铁在氯气中燃烧,生成氯化铁铁粉和硫粉混合加热,生成硫化亚铁2、与酸反应,生成亚铁盐和氢气3、与某些盐溶液反应,生成亚铁盐和另一种金属 铝具有银白色金属光泽,密度小是轻金属。具有良好的延展性、导电、导热性,(导电性能仅次于银和铜)。 在空气中,铝表面能形成一层致密的氧化膜。对浓硝酸有耐腐蚀性能。铝在高温时有很强的还原性。(野外钢轨的焊接)铝能与非氧化性酸反应,生成铝盐和氢气。铝能与某些盐溶液反应,生成铝盐的另一种金属。铜具有紫红色金属光泽,具有良好的延展性、导电和导热性(导电性仅次于银)。铜在潮湿空气中生成碱式碳酸铜(铜绿)。2Cu +O2 +H2O +CO2 = Cu2(OH)2CO3铜在空气中加热 2Cu + O2 = 2CuO铜和某些盐溶液 Cu +Hg(NO3)2 =Hg +Cu (NO3)2 Cu +2AgNO3 = 2Ag + Cu (NO3)2
铜和氧化性酸反应 Cu + H2SO4(浓) CuSO4 + H2O + SO2Cu +HNO3(浓) Cu(NO3)2 + NO2 + H2O Cu +HNO3(稀) Cu(NO3)2 + NO + H2O
锌具有青白色金属光泽。锌在空气中能形成致密的氧化膜。锌能与非氧化性酸反应,生成锌盐和氢气。
锌能与某些盐溶液反应,生成锌盐的另一种金属。
钛具有银白色金属光泽,具有良好的延展性。
钛具有耐腐蚀性,不受大气和海水的影响,与各种浓度的硝酸、稀硫酸、各种弱碱的作用非常缓慢,但可溶于盐酸、浓硫酸和氢氟酸中。锌在空气中能形成致密的氧化膜。酸、碱、盐、氧化物 酸、碱、盐、氧化物分类繁杂、种类多、性质多、化学方程式多,所以初学起来感觉有些困难。同学们首先要掌握各类化合物的组成、定义、分类和命名,结合实验掌握各类化合物的通性。用归纳的方法化繁为简,使知识条理化,便于记忆。记忆后再进行综合,再使其融会贯通,能够灵活运用。氧 化 物定义分 类酸性氧化物碱性氧化物定义定义制法制法通性通性与碱反应生成盐和水与水反应生成相应的酸与碱性氧化物化合生成盐 非金属与氧气化合 部分含氧酸受热分解
部分含氧酸盐受热分解 金属与氧气化合 不溶性碱受热分解
部分含氧酸盐受热分解
与酸反应生成盐和水
与水反应生成相应的碱
与酸性氧化物化合生成盐酸定义分 类按有无氧元素分: 含氧酸 无氧酸按一个分子电离出氢离子个数分:一元酸 二元酸 三元酸按酸性强弱分: 强酸 中强酸 弱酸按沸点高低分:高沸点酸 低沸点酸 通 性与指示剂反应:与活泼金属反应生成盐和氢气与碱性氧化物反应生成盐和水与碱反应生成盐和水与盐反应生成新盐和新酸碱定义分类按氢氧根个数分:一元碱 二元碱 三元碱
碱性强弱分:强碱 中强碱 弱碱通性与指示剂反应与酸性氧化物反应生成盐和水与酸反应生成盐和水与盐反应生成新碱和新盐盐定义分类按组成分正盐酸式盐碱式盐按阴、阳离子种类分:钾盐、硫酸盐等按由什么酸、碱中和生成的盐分:通性与酸反应生成新盐和新酸与碱反应生成新盐和新碱与金属反应生成新盐和新金属与盐反应生成另外两种盐盐盐和水盐和盐碱和盐酸和盐金属和盐盐和氢气单质、氧化物、酸、碱、盐相互转化关系图
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
