第3章 空气与生命综合测试卷(无答案)
文档属性
| 名称 | 第3章 空气与生命综合测试卷(无答案) |  | |
| 格式 | zip | ||
| 文件大小 | 281.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2018-02-03 18:57:12 | ||
图片预览


文档简介
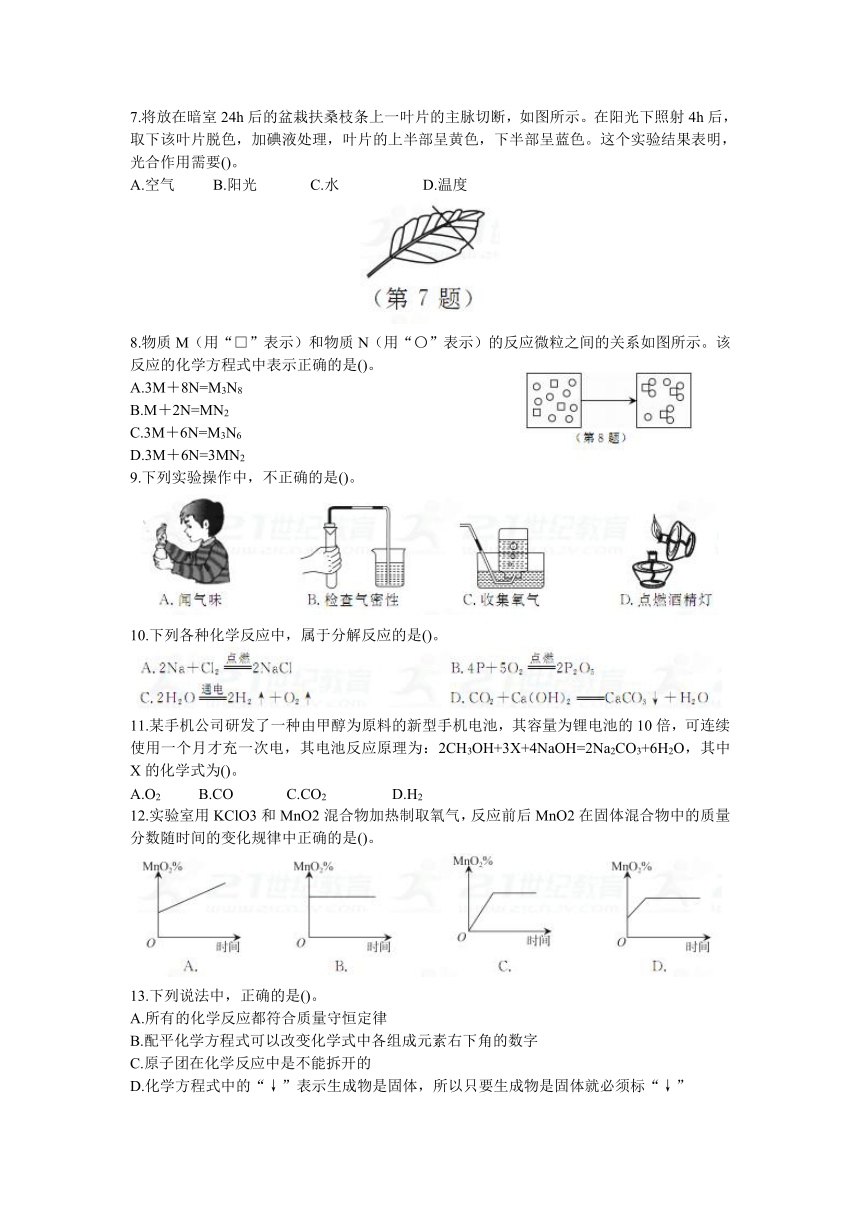
第3章综合测试卷
一、选择题(每题2分,共40分)
1.无色无味的空气是由多种物质混合而成的。下列现象中,能证明空气中有水的是()。
A.打开热水瓶盖,瓶口出现白雾
B.白色硫酸铜粉末敞口放置在空气中变蓝
C.人对着镜子哈气,镜子表面起雾
D.蜡烛火焰上罩一只干冷烧杯,烧杯内壁出现水珠
2.空气是一种重要的天然资源,在人们的生活和生产中有着广泛的用途。关于空气中各成分的用途,下列说法中错误的是()。
A.医疗上常用液氮冷冻麻醉或冷藏人体细胞组织
B.氧气能支持燃烧,所以可做燃料
C.固态二氧化碳是一种制冷剂,可用来保藏食物
D.稀有气体充入灯泡中可使其耐用,还可以用它制成电光源,如航标灯、霓虹灯
3.关于物质在氧气中燃烧的主要现象,下列叙述中正确的是()。
A.硫在氧气中燃烧,生成无色无味的二氧化硫气体
B.木炭在氧气中燃烧生成无色的二氧化碳
C.磷在氧气中燃烧生成的白雾是五氧化二磷
D.铁丝在氧气中燃烧,火星四射,生成黑色固体物质
4.光照条件下,一只大烧杯中装入大半杯清水,在烧杯底部放一些新鲜水草,通入一定量的M气体。静置一段时间后,用漏斗罩住水草将一只盛满水的小试管倒置于漏斗上。过较长时间后,试管里收集到少许N气体。关于此实验,下列判断中正确的是()。
A.M气体O2、N气体是CO2
B.M气体CO2、N气体是O2
C.M气体N2、N气体是O2
D.M气体N2、N气体是CO2
5.能鉴别空气、氧气和二氧化碳三种气体的方法是()。
A.观察颜色 B.分别通入到澄清石灰水中
C.闻气味 D.分别插入燃着的小木条
6.在“验证植物光合作用”的实验中,下列溶解叶片中的叶绿素的方法中正确的是()。
7.将放在暗室24h后的盆栽扶桑枝条上一叶片的主脉切断,如图所示。在阳光下照射4h后,取下该叶片脱色,加碘液处理,叶片的上半部呈黄色,下半部呈蓝色。这个实验结果表明,光合作用需要()。
A.空气 B.阳光 C.水 D.温度
8.物质M(用“□”表示)和物质N(用“〇”表示)的反应微粒之间的关系如图所示。该反应的化学方程式中表示正确的是()。
A.3M+8N=M3N8
B.M+2N=MN2
C.3M+6N=M3N6
D.3M+6N=3MN2
9.下列实验操作中,不正确的是()。
10.下列各种化学反应中,属于分解反应的是()。
11.某手机公司研发了一种由甲醇为原料的新型手机电池,其容量为锂电池的10倍,可连续使用一个月才充一次电,其电池反应原理为:2CH3OH+3X+4NaOH=2Na2CO3+6H2O,其中X的化学式为()。
A.O2 B.CO C.CO2 D.H2
12.实验室用KClO3和MnO2混合物加热制取氧气,反应前后MnO2在固体混合物中的质量分数随时间的变化规律中正确的是()。
13.下列说法中,正确的是()。
A.所有的化学反应都符合质量守恒定律
B.配平化学方程式可以改变化学式中各组成元素右下角的数字
C.原子团在化学反应中是不能拆开的
D.化学方程式中的“↓”表示生成物是固体,所以只要生成物是固体就必须标“↓”
14.3.0g某物质完全燃烧后生成4.4g二氧化碳和1.8g水。下列关于该物质的相关判断中,正确的是()。
A.该物质只含碳、氢元素
B.该物质一定含有碳、氢元素,可能含有氧元素
C.该物质由碳、氢、氧元素组成
D.该物质分子中碳原子和氢原子的个数比为1∶1
15.有下列事实:①动物呼吸;②白磷自燃;③食物腐烂;④火药爆炸,它们的共同点是()。
A.都发光B.都属于缓慢氧化反应
C.都发生爆炸D.都属于氧化反应
16.我国科学家在CO低温氧化的研究上取得了突破性进展,即在四氧化三钴(Co3O4)纳米棒的催化作用下,使汽车尾气中的CO在低温时与O2反应生成CO2。下列关于该反应的说法中,不正确的是()。
A.反应类型为化合反应
B.可降低汽车尾气对大气的污染
C.反应前后Co3O4的质量改变
D.反应前后碳元素的化合价改变
17.如图所示为研究植物某一生命活动过程的装置。下列说法中,错误的是()。
A.该实验可用于检验植物呼吸作用产生CO2
B.装置甲的作用是吸收充入空气中的CO2,避免对实验造成干扰
C.装置丙中的植物换成萌发的种子,装置丁中也会出现浑浊现象
D.若装置丙不遮光,则从装置丁出来的气体能使带火星的木条复燃
18.在化学反应方程式aA+bB=cC+dD中(a、b、c、d为系数,A、B、C、D为分子式),已知21g A和40g B恰好完全反应,生成28g C,且相对分子质量之比为A∶B∶C∶D=7∶40∶14∶11,则a∶b∶c∶d的结果为()。
A.3∶1∶2∶3B.2∶1∶2∶3C.5∶3∶4∶5D.1∶1∶1∶1
19.应用科学知识能有效地预防和控制火灾。下列对图中灭火实例的灭火原理的解释中不正确的是()。
20.科学实验证明:空气中微量的臭氧(O3)可抵抗阳光中紫外线对人体的损害。做空调和冰箱的制冷剂氟利昂是一种氟氯烃(以M代替其化学式),它可破坏臭氧层,其反应过程为:M+O3→MO+O2,MO+O→M+O2。根据所学知识可知,M在化学反应中的作用是()。
A.氧化剂 B.还原剂 C.催化剂 D.稳定剂
二、填空题(除标注分值外,每空2分,共32分)
21.①纯净的氮气是无色、无味的气体;②在放电条件下,N2与O2能直接化合生成无色的NO气体;③NO气体难溶于水,在常温下易与空气中的O2化合,生成红棕色NO2气体;④NO2气体有毒,易溶于水,溶于水后生成HNO3和NO;⑤生成的HNO3随雨水淋洒在大地上,同土壤中的矿物相作用,形成可溶性硝酸盐。试回答下列问题:
(1)氮气的物理性质是 (填序号)。(1分)
(2)实验室制取NO气体宜用 法收集。(1分)
(3)写出NO2与水作用的化学方程式 。
22.用扇子一扇,燃着的蜡烛立即熄灭,其原因是 (填序号,下同);用扇子扇炉火,炉火更旺,其原因是 。
①空气流动使蜡烛接触的氧气减少②空气流动带走燃烧的热量使烛火的温度低于蜡的着火点
③炉中燃烧物量大,放热多,空气流通不会致使炉温降低很多,却使供给的空气增加④使蜡烛的着火点降低
23.在如图所示的装置中,当两种物质发生反应后,天平不再保持平衡,指针向右偏转。
(1)天平不平衡的原因是 ,反应的化学方程式为 。
(2)若反应物不变,要使天平在反应后仍然保持平衡,你认为对装置的改进措施是 。
24.如图所示,将正在萌发的种子,放在内有一杯NaOH溶液而用塞子塞紧的瓶中,此瓶与一个水银流体压力计相连接,由此压力计水银柱升高的高度可以测量出某种气体的消耗量。假设正在萌发的种子用完了瓶中所有的气体,则水银柱会升高到76cm处(等于大气压)。
(1)实验过程中,水银柱升高到15cm处就不再升高,证明瓶中的空气约被利用了 %。
(2)瓶中NaOH溶液的作用是 。
25.小明利用如图所示的装置进行“人体呼出的气体中的CO2是否比吸入的空气中的CO2含量多”的探究实验。实验操作及观察到的现象如图所示:
(1)根据实验现象,小明得出的结论是 。
(2)写出该实验中澄清石灰水变浑浊的化学方程式 。
(3)小明想进一步了解人体呼出和吸入的气体中的CO2含量变化的原因,通过查阅资料得知,人体内的组织细胞不停地进行着 ,消耗O2并产生CO2,为人体生命活动提供了能量。同时人体内的肺泡与血液、血液与组织细胞之间发生了 ,使得呼出的气体中CO2含量更多。
26.自然界中存在着氧循环和碳循环,使得空气中的氧气和二氧化碳含量保持相对稳定。
(1)自然界主要靠 产生氧气,而产生二氧化碳的途径主要有 以及微生物的氧化分解作用。
(2)请写出光合作用的化学方程式 [有机物用葡萄糖分子式(C6H12O6)代替]。
三、实验探究题(每空2分,共16分)
27.如图所示为测定空气中氧气体积分数的实验装置。
(1)盛放在燃烧匙内的物质应选用 (填字母)。
A.木炭 B.铁丝 C.红磷 D.蜡烛
(2)若实验后发现测定结果与实际值相差较大,可能的原因是 (填一种即可)。
28.如图所示为化学实验中常用的几种装置:
(1)写出①仪器的名称 ;若A装置中药品X为双氧水、药品Y为二氧化锰,则A装置可以用于制取并收集氧气,在不改变A装置的仪器及位置的前提下,具体的做法是 。
(2)氨气的密度小于空气,极易溶解于水。实验室利用氯化铵固体和熟石灰混合加热制取氨气:①实验室制取氨气时,应选用的气体发生装置为 ;②若利用F装置收集氨气,则气体应从 (填“a”或“b”)端通入。
29.如图甲所示,先将天竺葵在黑暗的地方放置一昼夜,再在天竺葵的叶上,用两片相同大小的铝箔纸盖住相同位置的上、下叶表皮。实验前先将它放在暗处一昼夜,目的是 。放在阳光下4h后,把处理过的叶片取下,经如图乙所示的酒精褪色处理,取出叶片直接放置在表面皿中滴加碘液(如图丙所示),观察到的现象是 。
四、分析计算题(共12分)
30.(6分)实验室里有一包氯酸钾和二氧化锰的混合物,为了确定里面两种物质的含量,小明进行了这样的实验,他用天平称取15g混合物,充分加热后再测质量,发现剩余固体物质的质量为10.2g。
(1)生成氧气多少克?
(2)剩余固体物质中有什么物质?其质量各是多少克?
31.(6分)氮氧化物(如NO2、NO等)进入大气后,不仅会形成硝酸型酸雨,还可能形成光化学烟雾。因此必须对含氮氧化物的废气进行处理。
(1)用氢氧化钠溶液可吸收废气中的氮氧化物。反应的化学方程式为NO2+NO+2NaOH=2NaNO2+H2O。已知HNO2读作“亚硝酸”,则NaNO2的名称为 。
(2)汽车尾气中含有NO和CO,消除这两种物质对大气污染的方法是安装催化转化器,使它们发生反应,生成N2和CO2,该反应的化学方程式为 。
(3)氨气(NH3)也可用来处理氮氧化物。例如,氨气与二氧化氮反应:8NH3+6NO2=7N2+12H2O。若某工厂排出的废气中NO2的含量为0.5%(体积分数),则处理1.0×103m3这种废气,需要多少千克氨气?(假设此时NO2气体的密度为2.0g/L,计算结果保留两位小数)
一、选择题(每题2分,共40分)
1.无色无味的空气是由多种物质混合而成的。下列现象中,能证明空气中有水的是()。
A.打开热水瓶盖,瓶口出现白雾
B.白色硫酸铜粉末敞口放置在空气中变蓝
C.人对着镜子哈气,镜子表面起雾
D.蜡烛火焰上罩一只干冷烧杯,烧杯内壁出现水珠
2.空气是一种重要的天然资源,在人们的生活和生产中有着广泛的用途。关于空气中各成分的用途,下列说法中错误的是()。
A.医疗上常用液氮冷冻麻醉或冷藏人体细胞组织
B.氧气能支持燃烧,所以可做燃料
C.固态二氧化碳是一种制冷剂,可用来保藏食物
D.稀有气体充入灯泡中可使其耐用,还可以用它制成电光源,如航标灯、霓虹灯
3.关于物质在氧气中燃烧的主要现象,下列叙述中正确的是()。
A.硫在氧气中燃烧,生成无色无味的二氧化硫气体
B.木炭在氧气中燃烧生成无色的二氧化碳
C.磷在氧气中燃烧生成的白雾是五氧化二磷
D.铁丝在氧气中燃烧,火星四射,生成黑色固体物质
4.光照条件下,一只大烧杯中装入大半杯清水,在烧杯底部放一些新鲜水草,通入一定量的M气体。静置一段时间后,用漏斗罩住水草将一只盛满水的小试管倒置于漏斗上。过较长时间后,试管里收集到少许N气体。关于此实验,下列判断中正确的是()。
A.M气体O2、N气体是CO2
B.M气体CO2、N气体是O2
C.M气体N2、N气体是O2
D.M气体N2、N气体是CO2
5.能鉴别空气、氧气和二氧化碳三种气体的方法是()。
A.观察颜色 B.分别通入到澄清石灰水中
C.闻气味 D.分别插入燃着的小木条
6.在“验证植物光合作用”的实验中,下列溶解叶片中的叶绿素的方法中正确的是()。
7.将放在暗室24h后的盆栽扶桑枝条上一叶片的主脉切断,如图所示。在阳光下照射4h后,取下该叶片脱色,加碘液处理,叶片的上半部呈黄色,下半部呈蓝色。这个实验结果表明,光合作用需要()。
A.空气 B.阳光 C.水 D.温度
8.物质M(用“□”表示)和物质N(用“〇”表示)的反应微粒之间的关系如图所示。该反应的化学方程式中表示正确的是()。
A.3M+8N=M3N8
B.M+2N=MN2
C.3M+6N=M3N6
D.3M+6N=3MN2
9.下列实验操作中,不正确的是()。
10.下列各种化学反应中,属于分解反应的是()。
11.某手机公司研发了一种由甲醇为原料的新型手机电池,其容量为锂电池的10倍,可连续使用一个月才充一次电,其电池反应原理为:2CH3OH+3X+4NaOH=2Na2CO3+6H2O,其中X的化学式为()。
A.O2 B.CO C.CO2 D.H2
12.实验室用KClO3和MnO2混合物加热制取氧气,反应前后MnO2在固体混合物中的质量分数随时间的变化规律中正确的是()。
13.下列说法中,正确的是()。
A.所有的化学反应都符合质量守恒定律
B.配平化学方程式可以改变化学式中各组成元素右下角的数字
C.原子团在化学反应中是不能拆开的
D.化学方程式中的“↓”表示生成物是固体,所以只要生成物是固体就必须标“↓”
14.3.0g某物质完全燃烧后生成4.4g二氧化碳和1.8g水。下列关于该物质的相关判断中,正确的是()。
A.该物质只含碳、氢元素
B.该物质一定含有碳、氢元素,可能含有氧元素
C.该物质由碳、氢、氧元素组成
D.该物质分子中碳原子和氢原子的个数比为1∶1
15.有下列事实:①动物呼吸;②白磷自燃;③食物腐烂;④火药爆炸,它们的共同点是()。
A.都发光B.都属于缓慢氧化反应
C.都发生爆炸D.都属于氧化反应
16.我国科学家在CO低温氧化的研究上取得了突破性进展,即在四氧化三钴(Co3O4)纳米棒的催化作用下,使汽车尾气中的CO在低温时与O2反应生成CO2。下列关于该反应的说法中,不正确的是()。
A.反应类型为化合反应
B.可降低汽车尾气对大气的污染
C.反应前后Co3O4的质量改变
D.反应前后碳元素的化合价改变
17.如图所示为研究植物某一生命活动过程的装置。下列说法中,错误的是()。
A.该实验可用于检验植物呼吸作用产生CO2
B.装置甲的作用是吸收充入空气中的CO2,避免对实验造成干扰
C.装置丙中的植物换成萌发的种子,装置丁中也会出现浑浊现象
D.若装置丙不遮光,则从装置丁出来的气体能使带火星的木条复燃
18.在化学反应方程式aA+bB=cC+dD中(a、b、c、d为系数,A、B、C、D为分子式),已知21g A和40g B恰好完全反应,生成28g C,且相对分子质量之比为A∶B∶C∶D=7∶40∶14∶11,则a∶b∶c∶d的结果为()。
A.3∶1∶2∶3B.2∶1∶2∶3C.5∶3∶4∶5D.1∶1∶1∶1
19.应用科学知识能有效地预防和控制火灾。下列对图中灭火实例的灭火原理的解释中不正确的是()。
20.科学实验证明:空气中微量的臭氧(O3)可抵抗阳光中紫外线对人体的损害。做空调和冰箱的制冷剂氟利昂是一种氟氯烃(以M代替其化学式),它可破坏臭氧层,其反应过程为:M+O3→MO+O2,MO+O→M+O2。根据所学知识可知,M在化学反应中的作用是()。
A.氧化剂 B.还原剂 C.催化剂 D.稳定剂
二、填空题(除标注分值外,每空2分,共32分)
21.①纯净的氮气是无色、无味的气体;②在放电条件下,N2与O2能直接化合生成无色的NO气体;③NO气体难溶于水,在常温下易与空气中的O2化合,生成红棕色NO2气体;④NO2气体有毒,易溶于水,溶于水后生成HNO3和NO;⑤生成的HNO3随雨水淋洒在大地上,同土壤中的矿物相作用,形成可溶性硝酸盐。试回答下列问题:
(1)氮气的物理性质是 (填序号)。(1分)
(2)实验室制取NO气体宜用 法收集。(1分)
(3)写出NO2与水作用的化学方程式 。
22.用扇子一扇,燃着的蜡烛立即熄灭,其原因是 (填序号,下同);用扇子扇炉火,炉火更旺,其原因是 。
①空气流动使蜡烛接触的氧气减少②空气流动带走燃烧的热量使烛火的温度低于蜡的着火点
③炉中燃烧物量大,放热多,空气流通不会致使炉温降低很多,却使供给的空气增加④使蜡烛的着火点降低
23.在如图所示的装置中,当两种物质发生反应后,天平不再保持平衡,指针向右偏转。
(1)天平不平衡的原因是 ,反应的化学方程式为 。
(2)若反应物不变,要使天平在反应后仍然保持平衡,你认为对装置的改进措施是 。
24.如图所示,将正在萌发的种子,放在内有一杯NaOH溶液而用塞子塞紧的瓶中,此瓶与一个水银流体压力计相连接,由此压力计水银柱升高的高度可以测量出某种气体的消耗量。假设正在萌发的种子用完了瓶中所有的气体,则水银柱会升高到76cm处(等于大气压)。
(1)实验过程中,水银柱升高到15cm处就不再升高,证明瓶中的空气约被利用了 %。
(2)瓶中NaOH溶液的作用是 。
25.小明利用如图所示的装置进行“人体呼出的气体中的CO2是否比吸入的空气中的CO2含量多”的探究实验。实验操作及观察到的现象如图所示:
(1)根据实验现象,小明得出的结论是 。
(2)写出该实验中澄清石灰水变浑浊的化学方程式 。
(3)小明想进一步了解人体呼出和吸入的气体中的CO2含量变化的原因,通过查阅资料得知,人体内的组织细胞不停地进行着 ,消耗O2并产生CO2,为人体生命活动提供了能量。同时人体内的肺泡与血液、血液与组织细胞之间发生了 ,使得呼出的气体中CO2含量更多。
26.自然界中存在着氧循环和碳循环,使得空气中的氧气和二氧化碳含量保持相对稳定。
(1)自然界主要靠 产生氧气,而产生二氧化碳的途径主要有 以及微生物的氧化分解作用。
(2)请写出光合作用的化学方程式 [有机物用葡萄糖分子式(C6H12O6)代替]。
三、实验探究题(每空2分,共16分)
27.如图所示为测定空气中氧气体积分数的实验装置。
(1)盛放在燃烧匙内的物质应选用 (填字母)。
A.木炭 B.铁丝 C.红磷 D.蜡烛
(2)若实验后发现测定结果与实际值相差较大,可能的原因是 (填一种即可)。
28.如图所示为化学实验中常用的几种装置:
(1)写出①仪器的名称 ;若A装置中药品X为双氧水、药品Y为二氧化锰,则A装置可以用于制取并收集氧气,在不改变A装置的仪器及位置的前提下,具体的做法是 。
(2)氨气的密度小于空气,极易溶解于水。实验室利用氯化铵固体和熟石灰混合加热制取氨气:①实验室制取氨气时,应选用的气体发生装置为 ;②若利用F装置收集氨气,则气体应从 (填“a”或“b”)端通入。
29.如图甲所示,先将天竺葵在黑暗的地方放置一昼夜,再在天竺葵的叶上,用两片相同大小的铝箔纸盖住相同位置的上、下叶表皮。实验前先将它放在暗处一昼夜,目的是 。放在阳光下4h后,把处理过的叶片取下,经如图乙所示的酒精褪色处理,取出叶片直接放置在表面皿中滴加碘液(如图丙所示),观察到的现象是 。
四、分析计算题(共12分)
30.(6分)实验室里有一包氯酸钾和二氧化锰的混合物,为了确定里面两种物质的含量,小明进行了这样的实验,他用天平称取15g混合物,充分加热后再测质量,发现剩余固体物质的质量为10.2g。
(1)生成氧气多少克?
(2)剩余固体物质中有什么物质?其质量各是多少克?
31.(6分)氮氧化物(如NO2、NO等)进入大气后,不仅会形成硝酸型酸雨,还可能形成光化学烟雾。因此必须对含氮氧化物的废气进行处理。
(1)用氢氧化钠溶液可吸收废气中的氮氧化物。反应的化学方程式为NO2+NO+2NaOH=2NaNO2+H2O。已知HNO2读作“亚硝酸”,则NaNO2的名称为 。
(2)汽车尾气中含有NO和CO,消除这两种物质对大气污染的方法是安装催化转化器,使它们发生反应,生成N2和CO2,该反应的化学方程式为 。
(3)氨气(NH3)也可用来处理氮氧化物。例如,氨气与二氧化氮反应:8NH3+6NO2=7N2+12H2O。若某工厂排出的废气中NO2的含量为0.5%(体积分数),则处理1.0×103m3这种废气,需要多少千克氨气?(假设此时NO2气体的密度为2.0g/L,计算结果保留两位小数)
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
