第二章空气与生命复习
图片预览









文档简介
(共74张PPT)
第二章空气与生命复习
第一节 空 气
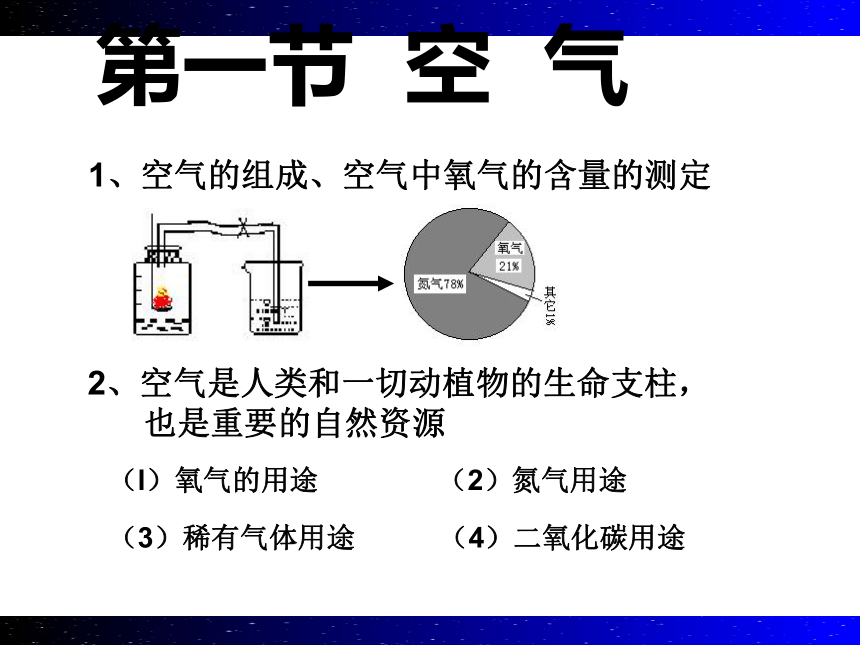
1、空气的组成、空气中氧气的含量的测定
2、空气是人类和一切动植物的生命支柱,
也是重要的自然资源
(l)氧气的用途
(2)氮气用途
(3)稀有气体用途
(4)二氧化碳用途
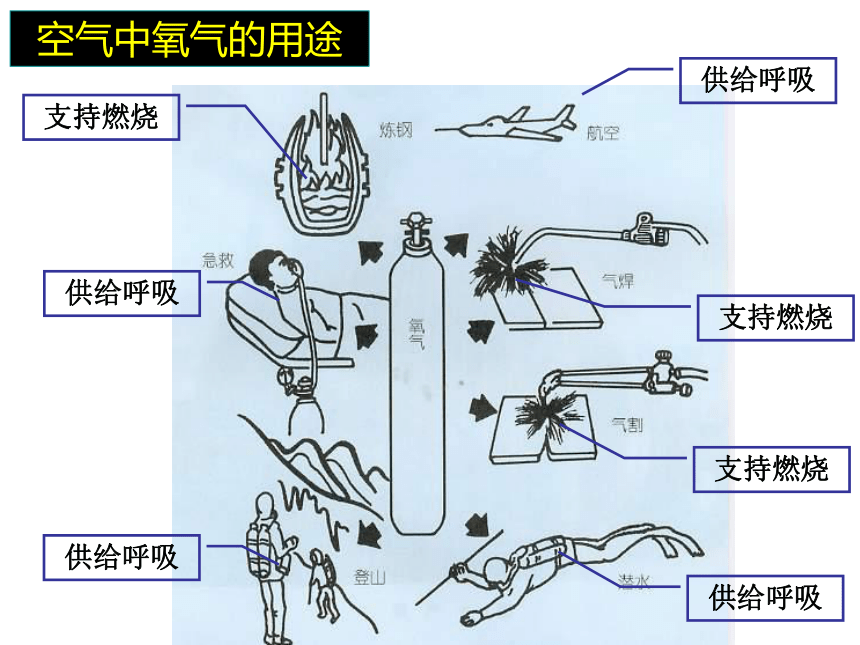
空气中氧气的用途
支持燃烧
支持燃烧
支持燃烧
供给呼吸
供给呼吸
供给呼吸
供给呼吸
第二节 氧气和氧化
1、氧气的性质和制备
2、呼吸作用与氧化、氧化反应(缓慢氧化、燃烧)
3、灭火与火灾自救
一、氧气的物理性质
1、通常情况下:无色、无味的气体,不易溶于水。
-183℃液化后浅蓝色液体 -218℃凝固后雪花状淡蓝色固体 2、O2的密度比空气略大
3、不易溶于水
2、江河中有鱼虾生存能够说明氧气的哪个特点?
思考:1、装O2的集气瓶如何放置?
集气瓶正放
不易溶于水
二、氧气的化学性质
1、木炭在氧气中燃烧:
(1)实验现象:
(2)反应表达式:
剧烈燃烧,发出白光,生成能使澄清石灰水变浑浊的气体
碳+氧气 点 燃 二氧化碳
二、氧气的化学性质
2、硫的燃烧:
(1)实验现象:
(2)反应表达式:
微弱的淡蓝色火焰,生成有刺激性气味的气体
硫+氧气 点 燃 二氧化硫
在空气中:
在氧气中:
明亮的蓝紫色火焰,生成有刺激性气味的气体
二、氧气的化学性质
3、磷在氧气中燃烧:
(1)实验现象:
(2)反应表达式:
发出耀眼的白光,产生大量的白烟
磷+氧气 点 燃 五氧化二磷
二、氧气的化学性质
4、铁在氧气中燃烧:
(1)实验现象:
(2)反应表达式:
剧烈燃烧,火星四射,生成黑色固体
铁+氧气 点 燃 四氧化三铁
思考:在Fe与O2气反应实验中,为什么要预先在集气瓶中装少量水或铺上一薄层细沙?
防止溅落的熔化物炸裂瓶底
二、氧气的化学性质
5、蜡烛(石蜡)在氧气中燃烧:
(1)实验现象:
(2)反应表达式:
火焰明亮,发出白光,瓶壁有水雾,生成使澄清石灰水变浑浊的气体
石蜡+氧气 点 燃 二氧化碳+水
氧气物是指由两种元素组成,其中一种元素
是氧元素的化合物
氧气是一种化学性质比较活泼的气体
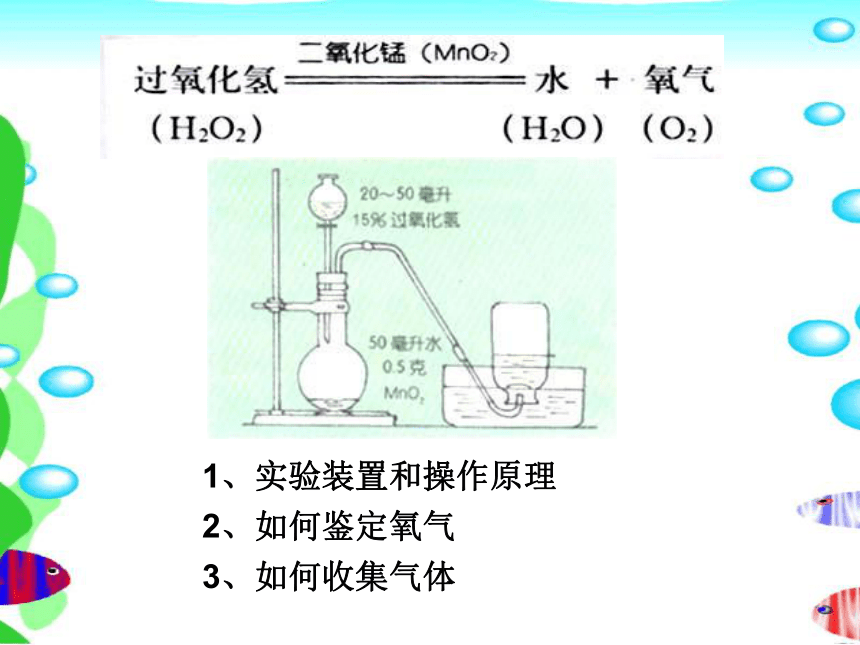
1、实验装置和操作原理
2、如何鉴定氧气
3、如何收集气体
我们把这样一类在化学反应中能改变其他物质的反应速率,而本身的质量和化学性质在反应前后都不改变的物质称之为催化剂。
要点:一变二不变
4、催化剂只影响反应速率,不影响最终产量
5、催化剂必须与某个具体的反应结合起来,否则无意义
6、催化剂不能决定反应的能否进行
7、同一反应可采用多种催化剂
注意:1、催化剂不一定加快反应速率
2、催化剂的物理性质在反应前后可以改变
3、催化剂在反应中可以参与反应而发生变化, 但反应结束时又能转化回原来的物质。
一、催化剂
二、制取原理
1、加热高锰酸钾固体
2、加热氯酸钾和二氧化锰的固体混合物
三、制取装置
发生装置
收集装置
氧气实验室制法(固固加热型)
本实验装置易错处:
1)试管口应略向下
2)导管应稍露出橡皮塞
3)酒精灯应用外焰加热
4)铁夹应夹在离试管口1/3处
5)火焰应加热在试管底部
6)酒精量不少于1/4,不多于2/3
7)排水收集时导管不能太长
①
②
③
④
⑤
⑥
⑦
四、制取操作步骤
1、检查气密性
2、装入药品
3、固定装置
4、加热
5、收集
6、将导管移出水面
7、撤去酒精灯
如果1和2、6和7互相换位,结果会怎样
五、氧气的收集方法
1、排水法
2、向上排空气法
六、氧气的检验
1、验证方法:带火星的木条伸入瓶中,
如果复燃,证明是氧气
2、验满方法:带火星的木条伸到瓶口,
如果复燃,说明已满
物质跟氧发生的化学反应。
氧化反应
提供氧的具有氧化性,称为氧化剂
注意:可以是氧原子、氧气、臭氧等。
定义:可燃物发生的一种发光发热的剧烈氧化反应。
注意:
在一般情况下,燃烧指的是可燃物和氧气发生的反应
一切燃烧都属于化学变化
一、燃烧
1、燃烧条件
①可燃物要与氧气接触
②可燃物温度要达到着火点(燃烧时所需的最低温度)
缺一不可
思考
1、夏天坟墓间的鬼火真的是鬼提着灯笼在走路吗?
2、白磷为什么要贮存在水里?
二、爆炸:
可燃物在有限空间里急速燃烧
如油库、面粉加工厂、纺织厂和煤矿等易发生爆炸
利用爆炸挖洞、采矿、机械加工等。
认识认识
三、缓慢氧化:
进行得很慢甚至不易被觉察的氧化反应
钢铁生锈、动植物的呼吸、食物腐烂、酿酒等。
由缓慢氧化而引起的自发燃烧。
四、自燃:
柴草、煤炭堆放时,注意通风或经常翻动降温。
俗称:鬼火
氧化反应
(放 热)
燃烧
缓慢氧化
有限空间内进行
爆炸
不及时散热
自燃
1、燃烧:可燃物跟空气中氧气发生的一种发光发热的剧烈的氧化反应。
2、爆炸:可燃物在有限空间里急速燃烧
3、缓慢氧化:进行得很慢甚至不易被觉察的氧化反应
4、自燃:由缓慢氧化而引起的自发燃烧
四个概念的区别和联系
①将可燃物的温度降低到着火点以下
灭火的原理
②使可燃物和空气(氧气)隔绝
(降温灭火)
(覆盖灭火)
思考:
2、为什么二氧化碳能灭火?
3、熄灭酒精灯时,为什么一罩上灯帽,火焰就会熄灭?
1、为什么水可以灭火?
汽油
电器
能与水反应的物质
5、炒菜时,油锅起火怎么办?
4、实验桌上起火时,应怎样扑救?
所有的火都能用水灭吗?
火警电话119
火太大,我救不了了,怎么办?
第三节
化学反应与质量守恒
1、化合、分解反应
2、质量守恒定律
3、化学方程式及其计算
碳+氧气 点 燃 二氧化碳
硫+氧气 点 燃 二氧化硫
磷+氧气 点 燃 五氧化二磷
铁+氧气 点 燃 四氧化三铁
由两种或两种以上物质生成另一种物质的反应。
一、化合反应
有什么共同特点
石蜡+氧气 点 燃 二氧化碳+水
食盐溶于水形成盐水。
二、分解反应
由一种物质生成两种或两种以上其它物质的反应叫分解反应
(比较与化合反应的区别)
三、质量守恒定律
=====
演示实验反应式:
氢氧化钠+硫酸铜 氢氧化铜+硫酸钠
NaOH + CuSO4 Cu(OH)2+ Na2SO4
mNaOH+mCuSO4
mCu(OH)2+mNa2SO4
===
磷 + 氧气 五氧化二磷
P + O2 P2O5
点燃
点燃
mP + mo2
mP2O5
==
质量守恒定律
参加化学反应的各物质的质量总和等于反应后
生成的各物质的质量总和。
思考1
有人说:10克冰熔化成10克水,此变化符合质量守恒定律,此说法对吗?为什么?
运用范围是化学变化,不包括物理变化!
思考2
在高于100 oC 的条件下,2体积氢气和1体积氧气反应能生成3体积水蒸汽,此说法对吗?
“质量守恒”不包括诸如体积等方面的守恒。
A + B C
40克 10克 50克
思考3:
参加化学反应的反应物的总质量或所有生成物的总质量
10克
50克
?克
有人说:镁带在空气中燃烧后,生成物的质量比镁带质量增加,而氯酸钾受热分解后,剩余固体的质量比氯酸钾的质量轻,所以这些反应不符合质量守恒定律。此说法对吗?为什么?
思考4
参加化学反应的反应物的总质量或所有生成物的总质量
1、运用范围是化学变化,不包括
物理变化。
2、“质量”指的是参加化学反应的反应物的总质量或所有生成物的总质量。
3、“质量守恒”不包括诸如体积等
方面的守恒。
运用质量守恒定律注意点:
思考:为什么物质在化学反应前后,各物质的
质量总和相等呢?
水通电
H2O H2+O2
通电
H2和O2
原子重新组合成
通电
通电分解成
H2O
H 和O
微观解释:
化学反应前后原子的种类没有改变,原子的 数目没有增减,原子的质量也没有变化。所以,化学反应前后各物质的质量总和必然相等。
宏观表述:
参加化学反应的各物质的质量总和等于反
应后生成的各物质的质量总和。
质量守恒定律
一、化学方程式
1、概念:用化学式来表示化学反应的式子。
氢气在氧气中燃烧生成水
2H2 + O2 === 2H2O
点燃
点燃
氢气 + 氧气 水
氢气和氧气在点燃的条件下生成水
2、读法:
H2 + O2 H2O
点燃
1、微观:表示化学反应中反应物、生成物各物质原子、分子个数比(即系数之比)
每12份质量的碳跟32份质量的氧气完全反应,能生成44份质量的二氧化碳。
2、意义:
C + O2 == CO2
点燃
质:表示反应物、生成物、反应条件
12 : 32 : 44
2、宏观:表示各物质的质量比
量:
点燃
2H2 + O2 === 2H2O
表示每 4份质量的氢气和32份质量
的氧气完全反应能生成36份质量的水。
质:
4 : 32 : 36
量:
氢气和氧气在点燃的条件下生成水。
反应物是氢气和氧气,生成物是水,
反应条件是点燃。
读作:
试一试
判断下列反应的化学反应方程式是否正确:
(1)铁在氧气中燃烧生成黑色固体
P + O2 = P2O5
点燃
Fe + O2 = FeO2
点燃
(2)磷在氧气中燃烧生成五氧化二磷
A、以客观事实为基础;
B、遵守质量守恒定律。
化学方程式书写原则:
A、左边反应物,中间连短线,右边生成物
B、配平(根据反应前后 不变)
C、短线改等号,条件要注明
书写步骤:
P
O2
P2O5
+
点燃
2
5
4
A、左边反应物,中间连短线,右边生成物
B、配平(根据反应前后 不变)
C、短线改等号,条件要注明
D、生成沉淀或气体,箭头来分明
( )
书写步骤
H2O —— H2 + O2
通电
2
2
写出水电解生成氢气和氧气的化学方程式
一、配平方法:
1、观察法
2、奇偶法(变奇为偶法)
MnO2
例:实验室用氯酸钾和二氧化锰的混合物制取氧气
KClO3 KCl + O2
奇数
偶数
2
3
2
练习
1、铝在空气中燃烧生成氧化铝;
2、碳和氧化铁反应生成铁和二氧化碳;
3、氨气和氧气点燃生成一氧化氮和水。
3、归一法
例:苯 (C6H6)与氧气反应生成二氧化碳和水
即让最复杂、元素种类最多的一种物质的系数是1
练习
酒精( C6H6O)在空气中燃烧生成二氧化碳和水
思考:
有机物 CxHyO在空气中燃烧生成二氧化碳和水
每4份质量的氢气跟32份质量的氧气完全反应,能生成36份质量的水。
意义:
宏观:表示各物质的质量比
点燃
2
2
H2 + O2 H2O
4 32 36
二、计算:
1、设:未知量
2、写:方程式
3、找:对应
4、列:比例式
5、解:方程
6、答:
第四节
生物是怎样呼吸的
1、平静希奇和呼吸是依靠膈肌和肋间肌的活动产生的
2、气体交换的原理
3、呼吸、呼吸运动和呼吸作用
4、植物呼吸作用与动物呼吸作用相似
5、植物呼吸作用与农业生产的关系
气体成分 吸入气 呼出气 呼、吸比较
氧气 21% 16%
二氧化碳 0.03 4%
氮气 78 78%
稀有气体 0.94% 1%
水汽 较少 较多
少了
多了
基本不变
基本不变
问题:为什么人呼出的气体中二氧化碳增多而氧气却减少了呢?
气体发生了交换
多了
人体的气体交换是在呼吸系统内进行。
一、人体呼吸系统的结构和功能
鼻腔
喉
右支气管
右肺
咽
气管
左肺
左支气管
呼吸系统 的组成
呼吸道
肺:气体交换的场所
:气体进出肺的通道
鼻孔
鼻
鼻、咽、喉、气管、支气管合称呼吸道。
外界
O2
CO2
O2
O2
O2
O2
O2
CO2
CO2
CO2
CO2
肺泡与外界进行气体交换图解:
外界
肺泡
O2
CO2
一个肺泡
小结:
一、人体呼吸系统的组成和功能
鼻:阻挡和粘住灰尘、细菌,还能
温暖湿润空气,感受外界的刺激
呼吸道 咽: 空气和食物的共同通道
喉、气管:保持气体畅通
支气管:内有纤毛的黏膜能分泌黏液,粘住
灰尘和细菌
肺 基本结构为肺泡 ,它仅有一层上皮细胞组成,
外缠毛细血管和弹性纤维
1、呼吸系统由 和 组成,其中
是呼吸系统的主要器官,食物和空气的
共同通道是 。肺的功能是:进行 的场所。
呼吸道
肺
肺
气体交换
咽
2、外界
肺泡
O2
CO2
3、吸气时,胸廓 ,腔内气压 ,气流______
肺部;呼气时,胸廓 ,腔内气压 ,
气流 肺部。
扩大
缩小
减小
进入
增大
离开
4、呼吸运动是由呼吸肌的 和 而引起的;
呼吸运动的结果,实现了 。
收缩
舒张
外界与肺的气体交换
第五节 光合作用
一、光合作用
二、二氧化碳
性质
制备
叶片见光部分遇到碘液_____________,而遮光部分遇到碘液____________________。
显蓝色
无蓝色(不变色)
实验表明了绿叶在_____下能够制造______。
光
淀粉
说明光合作用的产物之一是淀粉,条件是光。
光合作用的表达式
二氧化碳 + 水 —— 有机物(主要是淀粉)+氧气
光
叶绿体
1)场所:叶绿体(厂房)
2)条件:太阳光(动力)
3)原料:二氧化碳、水
4)产物:有机物(淀粉)、氧气
5)物质转变:无机物转为有机物,并释放氧气
6)能量转变:太阳能转变为化学能
光合作用的意义
1、光合作用是一切生物和人类的物质来源。
2、光合作用是一切生物和人类的能量来源。
3、光合作用是一切生物和人类获得氧气的来源
光合作用的主要器官:叶。 叶片是进行光合作用的主要部分。
注:叶由叶片、叶柄和托叶组成 ` 、叶片由表皮、叶肉和叶脉组成。
进行光合作用的主要场所:叶绿体
叶绿素是参与光合作用的物质。
光合作用和呼吸作用的区别
光合作用 呼吸作用
场所
是否需光
O2和CO2
气体变化
有机物和能量的变化
叶绿体
活细胞
是
否
吸进CO2
呼出O2
吸进O2
呼出CO2
制造有机物
储藏能量
分解有机物
释放能量
场所
条件
化学反应式
物质变化
能量变化
联系
意义
6H2O+6CO2 C6H12O6+6O2
叶绿体
光
C6H12O6+6O2 6H2O+6CO2
酶
叶绿体 活细胞
光照下 有无光照皆能进行
无机物→有机物 有机物→无机物
光能→化学能 化学能→生命活动所需能量、热能(散失)
生物体有机物和能量的最终来源 为生命活动提供能量
光合作用为呼吸作用提供了物质基础
呼吸作用为光合作用提供了能量和原料--C02
光合作用
呼吸作用
植物的光合作用与呼吸作用的比较
二氧化碳
1.二氧化碳的物理性质。(通常情况下)
无色无味的气体
密度比空气大
微溶于水
三态变化,固体称干冰
2.二氧化碳的化学性质:一般情况
不能提供呼吸
一般情况下,不能燃烧也支持燃烧
与水反应:
CO2+H2O H2CO3
与澄清石灰水反应:
CO2+Ca(OH)2 CaCO3 +H2O
(检查二氧化碳的方法)
3.二氧化碳的用途.
灭火
作化工原料,制纯碱,汽水等
植物进行光合作用原料
一、二氧化碳的实验室制法
1、制法原理
CaCO3+2HCl==CaCl2 + H2O + CO2↑
原料选择:
a为什么不用碳酸钠?
速度太快,不易控制
石灰石或大理石、稀盐酸
b为什么不用稀硫酸?
生成硫酸钙是微溶物质,附着在石灰石表面,使之与稀硫酸隔绝,阻碍反应进行。
c、为什么不用浓盐酸
因为浓盐酸有挥发性,生成的二氧化碳中含有大量的氯化氢气体
制氢气适用范围
a、固液反应;
b、不需加热。
2、发生装置选择:
——启普发生器或简易装置
思考:如何检查装置的气密性?
制二氧化碳
装置注意点
液封
要加热吗?
导气管稍露出橡皮塞即可
3、收集装置与收集方法
收集方法:排水集气法 向上排空法
3、二氧化碳的检验
1、验证方法:通入澄清石灰水中,石灰水变混浊。
2、验满方法:燃着的木条伸到瓶口,如果熄灭,说明已满
二、二氧化碳的工业制法
CaCO3==CaO + CO2↑
三、二氧化碳的用途。
结合自己的生活常识,试举例说出二氧化碳有哪些用途。
1、干冰:可做致冷剂,保存食品和人工降雨,可做灭火剂
2、气体肥料:促进光合作用
3、化工原料:制纯碱、汽水
4、灭火
第六节
自然界中氧和碳的循环
产生氧气和消耗二氧化碳的途径主要是:绿色植物的光合作用,而产生二氧化碳和消耗氧气的主要途径是:含碳物质的燃烧、生物体的呼吸、微生物分解有机物等。
自然界中氧和碳的循环
1.自然界中氧的循环.
1)自然界产生氧气:
植物的光合作用
2)自然界消耗氧气的途径:
生物呼吸
物质燃烧
2.自然界中的碳循环
1)自然界中产生二氧化碳的途径
生物的呼吸
物质的燃烧
2)自然界消耗二氧化碳的途径:
植物的光合作用
3、保护臭氧层。
1)臭氧层
的作用:
阻挡和削弱来自太阳光的过强的
紫外线,对生物起保护作用
2)臭氧层的破坏和保护
(1)引起臭氧层破坏的原因:
氯氟烃等物质对臭氧作用
(2)臭氧层的保护措施:
禁止生产和使用含氯氟
烃的制冷剂、发泡剂、
洗洁剂喷雾剂等化学物
质
4、温室效应。
1)温室效应是二氧化碳等温室气体对地球的保温作用
2)温室效应的好处:
适度的温室效应能保证地球上的
气温稳定,有利于生物生存。
3)温室效应的坏处:
过度的温室效应会导致全球性
气候变暖、海平面上升等。
第七节 空气污染与保护
1、空气污染
1)引起空气污染的原因
工业废气和烟尘的排放
土地沙漠化
车辆尾气的排放
部分建筑物材料释放有还气体
2)主要的空气污染物
2、保护空气
1)洁净的空气才能保证地球上的生物健康、
正常的生长
2)保护空气的措施
使用洁净的能源
控制污染源
加强空气质量的检测和预防
植树造林
二氧化硫
氮的氧化物
可吸入颗粒物
一氧化碳
酸雨
四、教案片断
1、教学课题:质量守恒定律
2、课的类型: 新课
3、教学模式:实验探究法
4、教学过程:
空
气
污染产生的现象
保护
首要污染物:
酸雨
控制污染源
温室效应
臭氧层被破坏
植树造林、种草等
加强空气质量监测和预报
使用清洁能源
二氧化硫、一氧化碳、二氧化氮、 可吸入颗粒物、臭氧等
日前计入空气质量指数的项目暂定为:
二氧化硫、一氧化碳、二氧化氮、可吸入颗粒物、臭氧。
怎样减小这些污染物在空气中的含量?
改善能源结构,减小废气的排放量
禁止使用氯氟烃,采用无氟冰箱
植树造林
1:空气的主要污染物:烟尘、二氧化硫、氮氧化物和一氧化碳等
2:空气污染的类型:可吸入颗粒物、酸雨、温室效应和臭氧层的破坏
3:保护空气的措施:使用污染少的能源代替煤和石油、使用脱硫技术改进煤和石油的燃烧、将煤和石油燃烧后的产物进行净化处理后再排放、多植树造林等
第二章空气与生命复习
第一节 空 气
1、空气的组成、空气中氧气的含量的测定
2、空气是人类和一切动植物的生命支柱,
也是重要的自然资源
(l)氧气的用途
(2)氮气用途
(3)稀有气体用途
(4)二氧化碳用途
空气中氧气的用途
支持燃烧
支持燃烧
支持燃烧
供给呼吸
供给呼吸
供给呼吸
供给呼吸
第二节 氧气和氧化
1、氧气的性质和制备
2、呼吸作用与氧化、氧化反应(缓慢氧化、燃烧)
3、灭火与火灾自救
一、氧气的物理性质
1、通常情况下:无色、无味的气体,不易溶于水。
-183℃液化后浅蓝色液体 -218℃凝固后雪花状淡蓝色固体 2、O2的密度比空气略大
3、不易溶于水
2、江河中有鱼虾生存能够说明氧气的哪个特点?
思考:1、装O2的集气瓶如何放置?
集气瓶正放
不易溶于水
二、氧气的化学性质
1、木炭在氧气中燃烧:
(1)实验现象:
(2)反应表达式:
剧烈燃烧,发出白光,生成能使澄清石灰水变浑浊的气体
碳+氧气 点 燃 二氧化碳
二、氧气的化学性质
2、硫的燃烧:
(1)实验现象:
(2)反应表达式:
微弱的淡蓝色火焰,生成有刺激性气味的气体
硫+氧气 点 燃 二氧化硫
在空气中:
在氧气中:
明亮的蓝紫色火焰,生成有刺激性气味的气体
二、氧气的化学性质
3、磷在氧气中燃烧:
(1)实验现象:
(2)反应表达式:
发出耀眼的白光,产生大量的白烟
磷+氧气 点 燃 五氧化二磷
二、氧气的化学性质
4、铁在氧气中燃烧:
(1)实验现象:
(2)反应表达式:
剧烈燃烧,火星四射,生成黑色固体
铁+氧气 点 燃 四氧化三铁
思考:在Fe与O2气反应实验中,为什么要预先在集气瓶中装少量水或铺上一薄层细沙?
防止溅落的熔化物炸裂瓶底
二、氧气的化学性质
5、蜡烛(石蜡)在氧气中燃烧:
(1)实验现象:
(2)反应表达式:
火焰明亮,发出白光,瓶壁有水雾,生成使澄清石灰水变浑浊的气体
石蜡+氧气 点 燃 二氧化碳+水
氧气物是指由两种元素组成,其中一种元素
是氧元素的化合物
氧气是一种化学性质比较活泼的气体
1、实验装置和操作原理
2、如何鉴定氧气
3、如何收集气体
我们把这样一类在化学反应中能改变其他物质的反应速率,而本身的质量和化学性质在反应前后都不改变的物质称之为催化剂。
要点:一变二不变
4、催化剂只影响反应速率,不影响最终产量
5、催化剂必须与某个具体的反应结合起来,否则无意义
6、催化剂不能决定反应的能否进行
7、同一反应可采用多种催化剂
注意:1、催化剂不一定加快反应速率
2、催化剂的物理性质在反应前后可以改变
3、催化剂在反应中可以参与反应而发生变化, 但反应结束时又能转化回原来的物质。
一、催化剂
二、制取原理
1、加热高锰酸钾固体
2、加热氯酸钾和二氧化锰的固体混合物
三、制取装置
发生装置
收集装置
氧气实验室制法(固固加热型)
本实验装置易错处:
1)试管口应略向下
2)导管应稍露出橡皮塞
3)酒精灯应用外焰加热
4)铁夹应夹在离试管口1/3处
5)火焰应加热在试管底部
6)酒精量不少于1/4,不多于2/3
7)排水收集时导管不能太长
①
②
③
④
⑤
⑥
⑦
四、制取操作步骤
1、检查气密性
2、装入药品
3、固定装置
4、加热
5、收集
6、将导管移出水面
7、撤去酒精灯
如果1和2、6和7互相换位,结果会怎样
五、氧气的收集方法
1、排水法
2、向上排空气法
六、氧气的检验
1、验证方法:带火星的木条伸入瓶中,
如果复燃,证明是氧气
2、验满方法:带火星的木条伸到瓶口,
如果复燃,说明已满
物质跟氧发生的化学反应。
氧化反应
提供氧的具有氧化性,称为氧化剂
注意:可以是氧原子、氧气、臭氧等。
定义:可燃物发生的一种发光发热的剧烈氧化反应。
注意:
在一般情况下,燃烧指的是可燃物和氧气发生的反应
一切燃烧都属于化学变化
一、燃烧
1、燃烧条件
①可燃物要与氧气接触
②可燃物温度要达到着火点(燃烧时所需的最低温度)
缺一不可
思考
1、夏天坟墓间的鬼火真的是鬼提着灯笼在走路吗?
2、白磷为什么要贮存在水里?
二、爆炸:
可燃物在有限空间里急速燃烧
如油库、面粉加工厂、纺织厂和煤矿等易发生爆炸
利用爆炸挖洞、采矿、机械加工等。
认识认识
三、缓慢氧化:
进行得很慢甚至不易被觉察的氧化反应
钢铁生锈、动植物的呼吸、食物腐烂、酿酒等。
由缓慢氧化而引起的自发燃烧。
四、自燃:
柴草、煤炭堆放时,注意通风或经常翻动降温。
俗称:鬼火
氧化反应
(放 热)
燃烧
缓慢氧化
有限空间内进行
爆炸
不及时散热
自燃
1、燃烧:可燃物跟空气中氧气发生的一种发光发热的剧烈的氧化反应。
2、爆炸:可燃物在有限空间里急速燃烧
3、缓慢氧化:进行得很慢甚至不易被觉察的氧化反应
4、自燃:由缓慢氧化而引起的自发燃烧
四个概念的区别和联系
①将可燃物的温度降低到着火点以下
灭火的原理
②使可燃物和空气(氧气)隔绝
(降温灭火)
(覆盖灭火)
思考:
2、为什么二氧化碳能灭火?
3、熄灭酒精灯时,为什么一罩上灯帽,火焰就会熄灭?
1、为什么水可以灭火?
汽油
电器
能与水反应的物质
5、炒菜时,油锅起火怎么办?
4、实验桌上起火时,应怎样扑救?
所有的火都能用水灭吗?
火警电话119
火太大,我救不了了,怎么办?
第三节
化学反应与质量守恒
1、化合、分解反应
2、质量守恒定律
3、化学方程式及其计算
碳+氧气 点 燃 二氧化碳
硫+氧气 点 燃 二氧化硫
磷+氧气 点 燃 五氧化二磷
铁+氧气 点 燃 四氧化三铁
由两种或两种以上物质生成另一种物质的反应。
一、化合反应
有什么共同特点
石蜡+氧气 点 燃 二氧化碳+水
食盐溶于水形成盐水。
二、分解反应
由一种物质生成两种或两种以上其它物质的反应叫分解反应
(比较与化合反应的区别)
三、质量守恒定律
=====
演示实验反应式:
氢氧化钠+硫酸铜 氢氧化铜+硫酸钠
NaOH + CuSO4 Cu(OH)2+ Na2SO4
mNaOH+mCuSO4
mCu(OH)2+mNa2SO4
===
磷 + 氧气 五氧化二磷
P + O2 P2O5
点燃
点燃
mP + mo2
mP2O5
==
质量守恒定律
参加化学反应的各物质的质量总和等于反应后
生成的各物质的质量总和。
思考1
有人说:10克冰熔化成10克水,此变化符合质量守恒定律,此说法对吗?为什么?
运用范围是化学变化,不包括物理变化!
思考2
在高于100 oC 的条件下,2体积氢气和1体积氧气反应能生成3体积水蒸汽,此说法对吗?
“质量守恒”不包括诸如体积等方面的守恒。
A + B C
40克 10克 50克
思考3:
参加化学反应的反应物的总质量或所有生成物的总质量
10克
50克
?克
有人说:镁带在空气中燃烧后,生成物的质量比镁带质量增加,而氯酸钾受热分解后,剩余固体的质量比氯酸钾的质量轻,所以这些反应不符合质量守恒定律。此说法对吗?为什么?
思考4
参加化学反应的反应物的总质量或所有生成物的总质量
1、运用范围是化学变化,不包括
物理变化。
2、“质量”指的是参加化学反应的反应物的总质量或所有生成物的总质量。
3、“质量守恒”不包括诸如体积等
方面的守恒。
运用质量守恒定律注意点:
思考:为什么物质在化学反应前后,各物质的
质量总和相等呢?
水通电
H2O H2+O2
通电
H2和O2
原子重新组合成
通电
通电分解成
H2O
H 和O
微观解释:
化学反应前后原子的种类没有改变,原子的 数目没有增减,原子的质量也没有变化。所以,化学反应前后各物质的质量总和必然相等。
宏观表述:
参加化学反应的各物质的质量总和等于反
应后生成的各物质的质量总和。
质量守恒定律
一、化学方程式
1、概念:用化学式来表示化学反应的式子。
氢气在氧气中燃烧生成水
2H2 + O2 === 2H2O
点燃
点燃
氢气 + 氧气 水
氢气和氧气在点燃的条件下生成水
2、读法:
H2 + O2 H2O
点燃
1、微观:表示化学反应中反应物、生成物各物质原子、分子个数比(即系数之比)
每12份质量的碳跟32份质量的氧气完全反应,能生成44份质量的二氧化碳。
2、意义:
C + O2 == CO2
点燃
质:表示反应物、生成物、反应条件
12 : 32 : 44
2、宏观:表示各物质的质量比
量:
点燃
2H2 + O2 === 2H2O
表示每 4份质量的氢气和32份质量
的氧气完全反应能生成36份质量的水。
质:
4 : 32 : 36
量:
氢气和氧气在点燃的条件下生成水。
反应物是氢气和氧气,生成物是水,
反应条件是点燃。
读作:
试一试
判断下列反应的化学反应方程式是否正确:
(1)铁在氧气中燃烧生成黑色固体
P + O2 = P2O5
点燃
Fe + O2 = FeO2
点燃
(2)磷在氧气中燃烧生成五氧化二磷
A、以客观事实为基础;
B、遵守质量守恒定律。
化学方程式书写原则:
A、左边反应物,中间连短线,右边生成物
B、配平(根据反应前后 不变)
C、短线改等号,条件要注明
书写步骤:
P
O2
P2O5
+
点燃
2
5
4
A、左边反应物,中间连短线,右边生成物
B、配平(根据反应前后 不变)
C、短线改等号,条件要注明
D、生成沉淀或气体,箭头来分明
( )
书写步骤
H2O —— H2 + O2
通电
2
2
写出水电解生成氢气和氧气的化学方程式
一、配平方法:
1、观察法
2、奇偶法(变奇为偶法)
MnO2
例:实验室用氯酸钾和二氧化锰的混合物制取氧气
KClO3 KCl + O2
奇数
偶数
2
3
2
练习
1、铝在空气中燃烧生成氧化铝;
2、碳和氧化铁反应生成铁和二氧化碳;
3、氨气和氧气点燃生成一氧化氮和水。
3、归一法
例:苯 (C6H6)与氧气反应生成二氧化碳和水
即让最复杂、元素种类最多的一种物质的系数是1
练习
酒精( C6H6O)在空气中燃烧生成二氧化碳和水
思考:
有机物 CxHyO在空气中燃烧生成二氧化碳和水
每4份质量的氢气跟32份质量的氧气完全反应,能生成36份质量的水。
意义:
宏观:表示各物质的质量比
点燃
2
2
H2 + O2 H2O
4 32 36
二、计算:
1、设:未知量
2、写:方程式
3、找:对应
4、列:比例式
5、解:方程
6、答:
第四节
生物是怎样呼吸的
1、平静希奇和呼吸是依靠膈肌和肋间肌的活动产生的
2、气体交换的原理
3、呼吸、呼吸运动和呼吸作用
4、植物呼吸作用与动物呼吸作用相似
5、植物呼吸作用与农业生产的关系
气体成分 吸入气 呼出气 呼、吸比较
氧气 21% 16%
二氧化碳 0.03 4%
氮气 78 78%
稀有气体 0.94% 1%
水汽 较少 较多
少了
多了
基本不变
基本不变
问题:为什么人呼出的气体中二氧化碳增多而氧气却减少了呢?
气体发生了交换
多了
人体的气体交换是在呼吸系统内进行。
一、人体呼吸系统的结构和功能
鼻腔
喉
右支气管
右肺
咽
气管
左肺
左支气管
呼吸系统 的组成
呼吸道
肺:气体交换的场所
:气体进出肺的通道
鼻孔
鼻
鼻、咽、喉、气管、支气管合称呼吸道。
外界
O2
CO2
O2
O2
O2
O2
O2
CO2
CO2
CO2
CO2
肺泡与外界进行气体交换图解:
外界
肺泡
O2
CO2
一个肺泡
小结:
一、人体呼吸系统的组成和功能
鼻:阻挡和粘住灰尘、细菌,还能
温暖湿润空气,感受外界的刺激
呼吸道 咽: 空气和食物的共同通道
喉、气管:保持气体畅通
支气管:内有纤毛的黏膜能分泌黏液,粘住
灰尘和细菌
肺 基本结构为肺泡 ,它仅有一层上皮细胞组成,
外缠毛细血管和弹性纤维
1、呼吸系统由 和 组成,其中
是呼吸系统的主要器官,食物和空气的
共同通道是 。肺的功能是:进行 的场所。
呼吸道
肺
肺
气体交换
咽
2、外界
肺泡
O2
CO2
3、吸气时,胸廓 ,腔内气压 ,气流______
肺部;呼气时,胸廓 ,腔内气压 ,
气流 肺部。
扩大
缩小
减小
进入
增大
离开
4、呼吸运动是由呼吸肌的 和 而引起的;
呼吸运动的结果,实现了 。
收缩
舒张
外界与肺的气体交换
第五节 光合作用
一、光合作用
二、二氧化碳
性质
制备
叶片见光部分遇到碘液_____________,而遮光部分遇到碘液____________________。
显蓝色
无蓝色(不变色)
实验表明了绿叶在_____下能够制造______。
光
淀粉
说明光合作用的产物之一是淀粉,条件是光。
光合作用的表达式
二氧化碳 + 水 —— 有机物(主要是淀粉)+氧气
光
叶绿体
1)场所:叶绿体(厂房)
2)条件:太阳光(动力)
3)原料:二氧化碳、水
4)产物:有机物(淀粉)、氧气
5)物质转变:无机物转为有机物,并释放氧气
6)能量转变:太阳能转变为化学能
光合作用的意义
1、光合作用是一切生物和人类的物质来源。
2、光合作用是一切生物和人类的能量来源。
3、光合作用是一切生物和人类获得氧气的来源
光合作用的主要器官:叶。 叶片是进行光合作用的主要部分。
注:叶由叶片、叶柄和托叶组成 ` 、叶片由表皮、叶肉和叶脉组成。
进行光合作用的主要场所:叶绿体
叶绿素是参与光合作用的物质。
光合作用和呼吸作用的区别
光合作用 呼吸作用
场所
是否需光
O2和CO2
气体变化
有机物和能量的变化
叶绿体
活细胞
是
否
吸进CO2
呼出O2
吸进O2
呼出CO2
制造有机物
储藏能量
分解有机物
释放能量
场所
条件
化学反应式
物质变化
能量变化
联系
意义
6H2O+6CO2 C6H12O6+6O2
叶绿体
光
C6H12O6+6O2 6H2O+6CO2
酶
叶绿体 活细胞
光照下 有无光照皆能进行
无机物→有机物 有机物→无机物
光能→化学能 化学能→生命活动所需能量、热能(散失)
生物体有机物和能量的最终来源 为生命活动提供能量
光合作用为呼吸作用提供了物质基础
呼吸作用为光合作用提供了能量和原料--C02
光合作用
呼吸作用
植物的光合作用与呼吸作用的比较
二氧化碳
1.二氧化碳的物理性质。(通常情况下)
无色无味的气体
密度比空气大
微溶于水
三态变化,固体称干冰
2.二氧化碳的化学性质:一般情况
不能提供呼吸
一般情况下,不能燃烧也支持燃烧
与水反应:
CO2+H2O H2CO3
与澄清石灰水反应:
CO2+Ca(OH)2 CaCO3 +H2O
(检查二氧化碳的方法)
3.二氧化碳的用途.
灭火
作化工原料,制纯碱,汽水等
植物进行光合作用原料
一、二氧化碳的实验室制法
1、制法原理
CaCO3+2HCl==CaCl2 + H2O + CO2↑
原料选择:
a为什么不用碳酸钠?
速度太快,不易控制
石灰石或大理石、稀盐酸
b为什么不用稀硫酸?
生成硫酸钙是微溶物质,附着在石灰石表面,使之与稀硫酸隔绝,阻碍反应进行。
c、为什么不用浓盐酸
因为浓盐酸有挥发性,生成的二氧化碳中含有大量的氯化氢气体
制氢气适用范围
a、固液反应;
b、不需加热。
2、发生装置选择:
——启普发生器或简易装置
思考:如何检查装置的气密性?
制二氧化碳
装置注意点
液封
要加热吗?
导气管稍露出橡皮塞即可
3、收集装置与收集方法
收集方法:排水集气法 向上排空法
3、二氧化碳的检验
1、验证方法:通入澄清石灰水中,石灰水变混浊。
2、验满方法:燃着的木条伸到瓶口,如果熄灭,说明已满
二、二氧化碳的工业制法
CaCO3==CaO + CO2↑
三、二氧化碳的用途。
结合自己的生活常识,试举例说出二氧化碳有哪些用途。
1、干冰:可做致冷剂,保存食品和人工降雨,可做灭火剂
2、气体肥料:促进光合作用
3、化工原料:制纯碱、汽水
4、灭火
第六节
自然界中氧和碳的循环
产生氧气和消耗二氧化碳的途径主要是:绿色植物的光合作用,而产生二氧化碳和消耗氧气的主要途径是:含碳物质的燃烧、生物体的呼吸、微生物分解有机物等。
自然界中氧和碳的循环
1.自然界中氧的循环.
1)自然界产生氧气:
植物的光合作用
2)自然界消耗氧气的途径:
生物呼吸
物质燃烧
2.自然界中的碳循环
1)自然界中产生二氧化碳的途径
生物的呼吸
物质的燃烧
2)自然界消耗二氧化碳的途径:
植物的光合作用
3、保护臭氧层。
1)臭氧层
的作用:
阻挡和削弱来自太阳光的过强的
紫外线,对生物起保护作用
2)臭氧层的破坏和保护
(1)引起臭氧层破坏的原因:
氯氟烃等物质对臭氧作用
(2)臭氧层的保护措施:
禁止生产和使用含氯氟
烃的制冷剂、发泡剂、
洗洁剂喷雾剂等化学物
质
4、温室效应。
1)温室效应是二氧化碳等温室气体对地球的保温作用
2)温室效应的好处:
适度的温室效应能保证地球上的
气温稳定,有利于生物生存。
3)温室效应的坏处:
过度的温室效应会导致全球性
气候变暖、海平面上升等。
第七节 空气污染与保护
1、空气污染
1)引起空气污染的原因
工业废气和烟尘的排放
土地沙漠化
车辆尾气的排放
部分建筑物材料释放有还气体
2)主要的空气污染物
2、保护空气
1)洁净的空气才能保证地球上的生物健康、
正常的生长
2)保护空气的措施
使用洁净的能源
控制污染源
加强空气质量的检测和预防
植树造林
二氧化硫
氮的氧化物
可吸入颗粒物
一氧化碳
酸雨
四、教案片断
1、教学课题:质量守恒定律
2、课的类型: 新课
3、教学模式:实验探究法
4、教学过程:
空
气
污染产生的现象
保护
首要污染物:
酸雨
控制污染源
温室效应
臭氧层被破坏
植树造林、种草等
加强空气质量监测和预报
使用清洁能源
二氧化硫、一氧化碳、二氧化氮、 可吸入颗粒物、臭氧等
日前计入空气质量指数的项目暂定为:
二氧化硫、一氧化碳、二氧化氮、可吸入颗粒物、臭氧。
怎样减小这些污染物在空气中的含量?
改善能源结构,减小废气的排放量
禁止使用氯氟烃,采用无氟冰箱
植树造林
1:空气的主要污染物:烟尘、二氧化硫、氮氧化物和一氧化碳等
2:空气污染的类型:可吸入颗粒物、酸雨、温室效应和臭氧层的破坏
3:保护空气的措施:使用污染少的能源代替煤和石油、使用脱硫技术改进煤和石油的燃烧、将煤和石油燃烧后的产物进行净化处理后再排放、多植树造林等
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
