原子结构的模型(2)
图片预览



文档简介
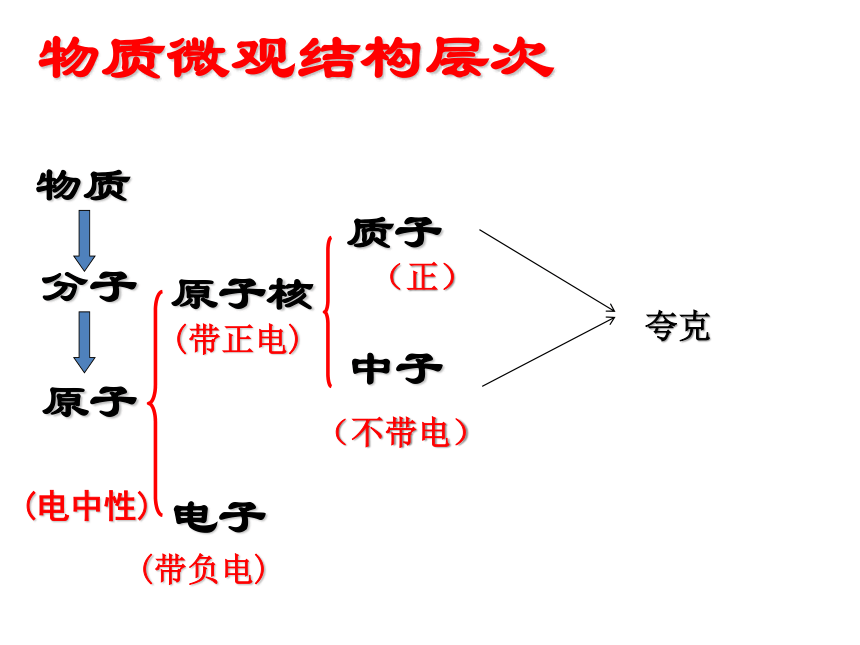
课件27张PPT。物质微观结构层次物质分子原子原子核电子质子中子(带正电)(带负电)(电中性)(不带电)(正)夸克化学变化的实质是 ,
。在变化中分子分裂成原子原子重新组合成新的分子在化学变化中各种原子是如何重新组合成新的分子?带电的原子—离子1、取一瓶氯气,观察它的颜色
。黄绿色2、用镊子在放有煤油的试剂瓶
中夹取一块钠,用刀切割成
一小块,观察颜色、状态。
。质软、银白色光泽金属固体氯 气 氯化钠的生成金属钠比较活泼容易被空气中氧气氧化,也容易与水反应。而水和氧气都不溶于煤油,钠不与煤油反应且密度比煤油大,所以选择存放在煤油中。3、点燃钠,将燃烧匙伸入氯气瓶中,反应
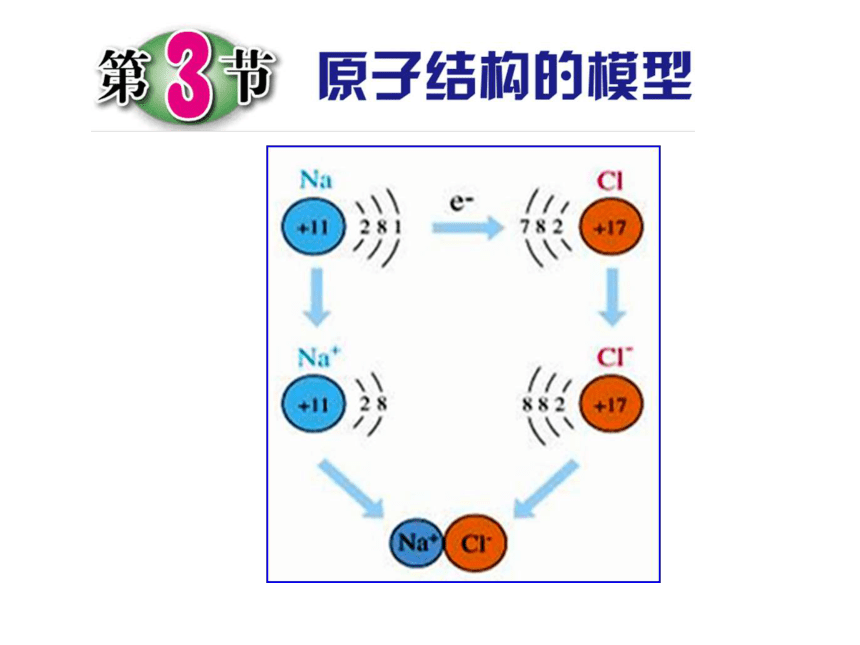
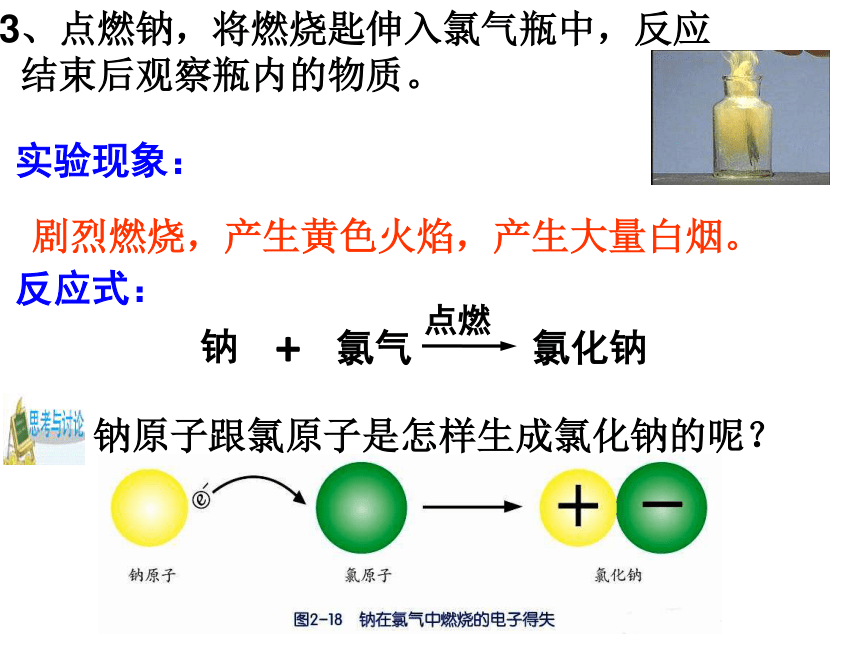
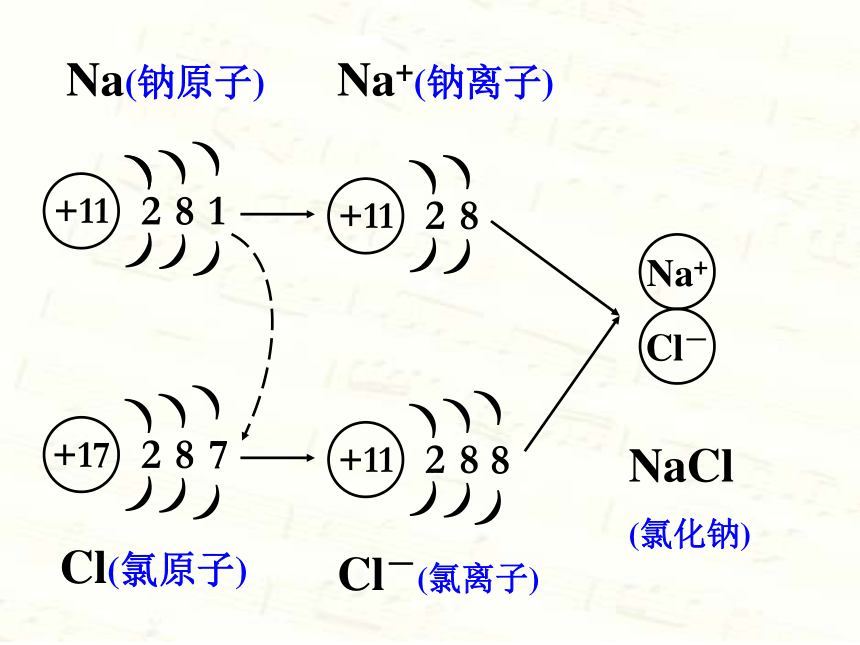
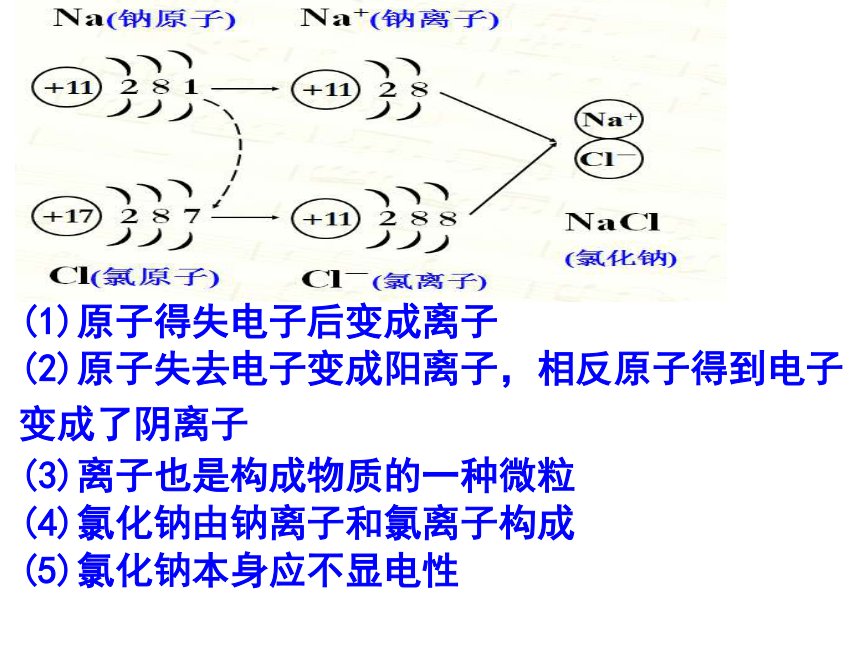
结束后观察瓶内的物质。实验现象: 剧烈燃烧,产生黄色火焰,产生大量白烟。反应式: 钠+氯气氯化钠钠原子跟氯原子是怎样生成氯化钠的呢?点燃+11))8)1)+11))8))+172)))7+11))88)Na+Cl-Na(钠原子)Na+(钠离子)Cl-(氯离子)Cl(氯原子)NaCl
(氯化钠)2)))22)))8)))(1)原子得失电子后变成离子(2)原子失去电子变成阳离子,相反原子得到电子变成了阴离子(3)离子也是构成物质的一种微粒
(4)氯化钠由钠离子和氯离子构成
(5)氯化钠本身应不显电性
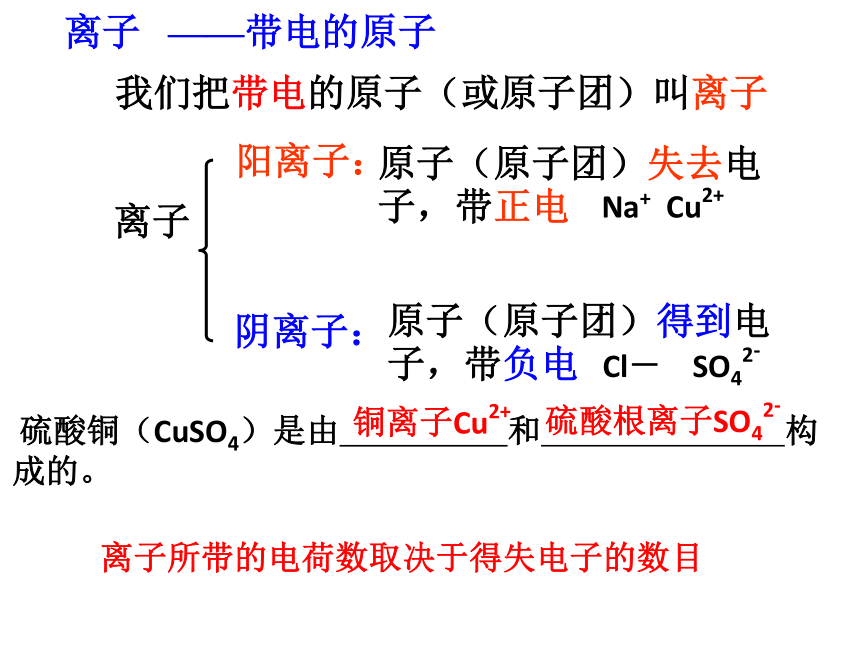
离子——带电的原子 我们把带电的原子(或原子团)叫离子原子(原子团)得到电子,带负电离子阳离子:阴离子:原子(原子团)失去电子,带正电 Na+ Cu2+
Cl- SO42-
硫酸铜(CuSO4)是由 和 构成的。离子所带的电荷数取决于得失电子的数目 铜离子Cu2+硫酸根离子SO42-
金属元素:它们原子的最外层电子数目一般少于___个。在化学反应中易_____电子,形成____离子。Ex:钠、镁、铝、铁非金属元素:它们原子的最外层电子数目一般大于或等于___个电子,它们在化学反应中易______电子,形成_____离子。Ex:氧、氯、硫4失去阳4得到阴同位素——原子的“孪生兄弟”观察下图氧的 3种原子的原子核科学上:把具有相同核电荷数(即质子数)
的一类原子总成为元素。如图,ABC三种原子的质子数都是8,我们称它们为氧元素用符号O来表示。元素是一类原子的总称,所以元素只有种类,没有个数。如只能说氧元素,而不能说一个氧元素(1)水是由大量的水分子构成的。
(2)一个水分子是由两个氢原子和一
个氧原子构成的。
(3)水是由氢元素和氧元素组成的。
描述水的结构和组成下列说法错在哪里?②、水是由两个氢原子和一个氧原子构成的。①、水是由两个氢元素和一个氧元素组成的。③、水是由氢分子和氧原子构成的。我们把原子中核内的质子数相同、中子数不相同的同类原子互为同位素原子。元素是互为同位素的原子的总称。816质子数+中子数质子数817818H11H21H31氕氘氚为了区分元素的同位素原子,有时把质子数和中子数的总数标出以示区别。碳—12碳—13碳—14碳的同位素 同位素原子的应用同位素原子在工业、农业、医疗、国防等方面有着广泛的应用。(1)工业方面利用铀元素的同位素U235的裂变反应释放的能量核电站(2)农业方面同位素质谱分析仪,用稳定同位素原子作为示踪原子。分别标记CO2和H2O,证明光合作用释放的O2全部来自于水。喂食含有同位素的饲料,跟踪牛的消化吸收情况。(3)医疗方面利用放射性同位素射线对一些脏器进行扫描,诊断肿瘤等疾病。疾病的放射性治疗,电离辐射具有杀灭癌细胞的能力。原子弹(4)国防方面核动力潜艇利用同位素的裂变与聚变反应释放的能量利用氢元素的同位素氘和氚的聚变反应
制造核武器——氢弹(5)考古测年代根据放射性同位素的半衰期,进行古董鉴定。同位素测定地质年代 物质、元素、分子、原子、离子的区别与联系原子分子物质元素构成构
成构
成组成具有相同核电荷数一类原子得失电子微观粒子(即讲种类、又讲个数)宏观概念(只讲种类、不讲个数)离子得失电子构
成1、相互关系 分子与原子的比较保持物质化学性质的一种微粒。化学变化中的最小微粒。在化学反应中可分,
重新组成新的分子。在化学反应中不可再分。分子由原子构成。
分子、原子都可以构成物质。分子比构成分子自身的原子大,
但不能说原子一定比分子小。概 念不同点关 系注 意 原子与离子的比较核电荷数=核外电子数,在化学反应中容易失去或得到电子,形成稳定结构阳离子:核外电子数<核电荷数
阴离子:核外电子数>核电荷数 失电子 失电子
阴离子 原子 阳离子
得电子 得电子元素与原子的区别和联系:具有相同核电荷数(即质子数)的同一类原子的总称
化学变化中的最小微粒
1)宏观概念,表示物质的宏观组成
2)只讲种类,不讲个数1)微观概念,表示物质的微观构成
2)即讲种类又种个数元素和原子,是总体和个体的关系,原子是体现元素性质的最小微粒,元素是具有相同核电荷数的同一类原子的总称。练习:1、氕、氘、氚三种原子具有相同的( )
A、原子质量 B、原子核结构
C、核电荷数 D、中子数C2、 我国计划在2007年发射一颗绕月探测卫星,其任务之一是寻找一种新能源——氦3。氦3的原子核是由一个中子和两个质子构成的,其原子核外电子数为( )
A、1 B、2 C、3 D、6B3、有 3种不同的原子,甲原子核内有 6个质子和
6个中子,乙原子核内有 6个质子和 8个中子,
丙原子核内有 7个质子和 7个中子。下列说法
正确的是---------------------------------------( )
A. 甲和乙是同一种元素
B. 甲和乙的核电荷数不同
C. 乙和丙核外电子数相等
D. 乙和丙互为同位素原子A4、 在①分子 ②原子 ③质子 ④电子⑤离子 ⑥原
子核 ⑦中子 ⑧元素中,选择:
(1)构成物质的基本微粒是__________ ,其
中____是化学变化中的最小微粒,它是由
_____和_____构成的。
(2)元素的种类由_____数决定;元素的相对
原子质量由_____数和_____数决定。
(3)Mg和Mg2+因具有相同的______数,故属
于同种_____,又因为它们具有不同的
____数,故属于两种不同的微粒。①②⑤②⑥④③③⑦③⑧④再见
。在变化中分子分裂成原子原子重新组合成新的分子在化学变化中各种原子是如何重新组合成新的分子?带电的原子—离子1、取一瓶氯气,观察它的颜色
。黄绿色2、用镊子在放有煤油的试剂瓶
中夹取一块钠,用刀切割成
一小块,观察颜色、状态。
。质软、银白色光泽金属固体氯 气 氯化钠的生成金属钠比较活泼容易被空气中氧气氧化,也容易与水反应。而水和氧气都不溶于煤油,钠不与煤油反应且密度比煤油大,所以选择存放在煤油中。3、点燃钠,将燃烧匙伸入氯气瓶中,反应
结束后观察瓶内的物质。实验现象: 剧烈燃烧,产生黄色火焰,产生大量白烟。反应式: 钠+氯气氯化钠钠原子跟氯原子是怎样生成氯化钠的呢?点燃+11))8)1)+11))8))+172)))7+11))88)Na+Cl-Na(钠原子)Na+(钠离子)Cl-(氯离子)Cl(氯原子)NaCl
(氯化钠)2)))22)))8)))(1)原子得失电子后变成离子(2)原子失去电子变成阳离子,相反原子得到电子变成了阴离子(3)离子也是构成物质的一种微粒
(4)氯化钠由钠离子和氯离子构成
(5)氯化钠本身应不显电性
离子——带电的原子 我们把带电的原子(或原子团)叫离子原子(原子团)得到电子,带负电离子阳离子:阴离子:原子(原子团)失去电子,带正电 Na+ Cu2+
Cl- SO42-
硫酸铜(CuSO4)是由 和 构成的。离子所带的电荷数取决于得失电子的数目 铜离子Cu2+硫酸根离子SO42-
金属元素:它们原子的最外层电子数目一般少于___个。在化学反应中易_____电子,形成____离子。Ex:钠、镁、铝、铁非金属元素:它们原子的最外层电子数目一般大于或等于___个电子,它们在化学反应中易______电子,形成_____离子。Ex:氧、氯、硫4失去阳4得到阴同位素——原子的“孪生兄弟”观察下图氧的 3种原子的原子核科学上:把具有相同核电荷数(即质子数)
的一类原子总成为元素。如图,ABC三种原子的质子数都是8,我们称它们为氧元素用符号O来表示。元素是一类原子的总称,所以元素只有种类,没有个数。如只能说氧元素,而不能说一个氧元素(1)水是由大量的水分子构成的。
(2)一个水分子是由两个氢原子和一
个氧原子构成的。
(3)水是由氢元素和氧元素组成的。
描述水的结构和组成下列说法错在哪里?②、水是由两个氢原子和一个氧原子构成的。①、水是由两个氢元素和一个氧元素组成的。③、水是由氢分子和氧原子构成的。我们把原子中核内的质子数相同、中子数不相同的同类原子互为同位素原子。元素是互为同位素的原子的总称。816质子数+中子数质子数817818H11H21H31氕氘氚为了区分元素的同位素原子,有时把质子数和中子数的总数标出以示区别。碳—12碳—13碳—14碳的同位素 同位素原子的应用同位素原子在工业、农业、医疗、国防等方面有着广泛的应用。(1)工业方面利用铀元素的同位素U235的裂变反应释放的能量核电站(2)农业方面同位素质谱分析仪,用稳定同位素原子作为示踪原子。分别标记CO2和H2O,证明光合作用释放的O2全部来自于水。喂食含有同位素的饲料,跟踪牛的消化吸收情况。(3)医疗方面利用放射性同位素射线对一些脏器进行扫描,诊断肿瘤等疾病。疾病的放射性治疗,电离辐射具有杀灭癌细胞的能力。原子弹(4)国防方面核动力潜艇利用同位素的裂变与聚变反应释放的能量利用氢元素的同位素氘和氚的聚变反应
制造核武器——氢弹(5)考古测年代根据放射性同位素的半衰期,进行古董鉴定。同位素测定地质年代 物质、元素、分子、原子、离子的区别与联系原子分子物质元素构成构
成构
成组成具有相同核电荷数一类原子得失电子微观粒子(即讲种类、又讲个数)宏观概念(只讲种类、不讲个数)离子得失电子构
成1、相互关系 分子与原子的比较保持物质化学性质的一种微粒。化学变化中的最小微粒。在化学反应中可分,
重新组成新的分子。在化学反应中不可再分。分子由原子构成。
分子、原子都可以构成物质。分子比构成分子自身的原子大,
但不能说原子一定比分子小。概 念不同点关 系注 意 原子与离子的比较核电荷数=核外电子数,在化学反应中容易失去或得到电子,形成稳定结构阳离子:核外电子数<核电荷数
阴离子:核外电子数>核电荷数 失电子 失电子
阴离子 原子 阳离子
得电子 得电子元素与原子的区别和联系:具有相同核电荷数(即质子数)的同一类原子的总称
化学变化中的最小微粒
1)宏观概念,表示物质的宏观组成
2)只讲种类,不讲个数1)微观概念,表示物质的微观构成
2)即讲种类又种个数元素和原子,是总体和个体的关系,原子是体现元素性质的最小微粒,元素是具有相同核电荷数的同一类原子的总称。练习:1、氕、氘、氚三种原子具有相同的( )
A、原子质量 B、原子核结构
C、核电荷数 D、中子数C2、 我国计划在2007年发射一颗绕月探测卫星,其任务之一是寻找一种新能源——氦3。氦3的原子核是由一个中子和两个质子构成的,其原子核外电子数为( )
A、1 B、2 C、3 D、6B3、有 3种不同的原子,甲原子核内有 6个质子和
6个中子,乙原子核内有 6个质子和 8个中子,
丙原子核内有 7个质子和 7个中子。下列说法
正确的是---------------------------------------( )
A. 甲和乙是同一种元素
B. 甲和乙的核电荷数不同
C. 乙和丙核外电子数相等
D. 乙和丙互为同位素原子A4、 在①分子 ②原子 ③质子 ④电子⑤离子 ⑥原
子核 ⑦中子 ⑧元素中,选择:
(1)构成物质的基本微粒是__________ ,其
中____是化学变化中的最小微粒,它是由
_____和_____构成的。
(2)元素的种类由_____数决定;元素的相对
原子质量由_____数和_____数决定。
(3)Mg和Mg2+因具有相同的______数,故属
于同种_____,又因为它们具有不同的
____数,故属于两种不同的微粒。①②⑤②⑥④③③⑦③⑧④再见
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
