第3章 空气与生命单元检测卷(有答案)
图片预览



文档简介
浙教版八下科学第三章单元检测卷
学校____________ 班级________ 姓名__________ 考号____________
题序
一
二
三
四
总分
得分
一、选择题
1. 下列试验现象的描述正确的是( )
A.蜡烛在空气中燃烧生成二氧化碳和水
B.硫在空气中燃烧,发出明亮的蓝紫色火焰
C.红磷在空气中剧烈燃烧,产生大量的白雾
D.铁丝在氧气中燃烧,火星四射,发出大量的热,生成黑色固体
2. “蜂窝煤”比煤球更有利于煤的完全燃烧、提高燃烧效率,这主要是因为
A.降低了煤的着火点 B.升高了煤的着火点
C.提高了氧气的浓度 D.增大了煤与氧气的接触面积
3. 在一定条件下,一密闭容器内发生某反应,测得反应前后各物质的质量如下表所示。下列说法错误的是( )
物质
a
b
c
d
反应前的质量/g
30
5
10
15
反应后的质量/ g
x
y
20
20
A.—定是反应物 B.x+y=20
C.x的取值范围一定是0≤x≤30 D.反应生成c与d的质量比为2:1
4. (10湖州)手机、手提电脑中使用的电池多为锂电池,锂电池具有质量轻、电量大等优点。锂电池内的某个反应可表示为Li+MnO2==LiMnO2。下列关于该反应的说法中,正确的是21世纪教育网版权所有
A.反应中MnO2是催化剂 B反应前后Mn元素的化合价不变
C.该反应为化合反应 D.生成物LiMnO2为氧化物
5. 如图1是某燃煤发电厂处理废气的装置示意图。下列说法正确的是 ( )
图1
A.此过程中没有分解反应
B.此过程中S元素的化合价未发生改变
C.使用此废气处理装置并不能减少酸雨的形成
D.整个过程的反应可表示为:2SO2+2CaCO3+O2===2CaSO4+2CO2
6. 早在1898年,英国科学家凯尔文曾忧虑地球上的氧气将会逐步耗完。后来,瑞士科学家谢尼泊通过实验证明凯尔文的忧虑是多余的。你估计谢尼泊所做的实验是( )21教育网
A.植物光合作用实验 B.植物蒸腾作用实验
C.生物呼吸作用实验 D.KMnO4受热分解实验
7. 下图表示宇宙飞船发动机内氢气和氧气燃烧生成水的微观过程。下列说法错误的是( )。
A.氢气、氧气和水都是由分子构成的
B.氢气和氧气燃烧生成水的过程中,分子种类发生了改变
C.氢气和氧气燃烧生成水的过程中,原子种类没有发生改变
D.氢气、氧气、水都是化合物
8. 如图所示,某同学为验证空气中含有少量二氧化碳,将大针筒内的空气一次性压入新制的澄清石灰水,发现石灰水没有变化.据此,你认为该同学应该( )21cnjy.com
A.得出空气中没有二氧化碳的结论
B.得出空气中含有少量二氧化碳的结论
C.继续用大针筒向澄清石灰水压入空气
D.撤去大针筒,用嘴向澄清石灰水吹气
9. 环境空气质量监测项目有:二氧化硫、二氧化氮、可吸入颗粒物三个指标。下列做法对三个空气质量指标不会产生影响的是( )21·cn·jy·com
A.用氢气作燃料
B.露天焚烧垃圾
C.汽车排放尾气
D.用煤作燃料
10.在化学反应2A+B2―→2AB中,A与B2反应的质量关系如图2-3-24所示,现将6 g A和8 g B2充分反应,则生成AB的质量是 ( )www.21-cn-jy.com
图2-3-24
A.9 g B.11 g
C.12 g D.14 g
11.某实验小组收集到两瓶气体,分别装有空气和人体呼出的气体,把燃烧的线香分别放入两只瓶中,发现在装有空气的瓶内,线香燃烧了一会儿,而在装有人体呼出的气体的瓶内,线香迅速熄灭。这说明( )
A.空气中含有充足的氧气
B.人呼出的气体中氧气减少
C.空气中没有二氧化碳
D.人呼出的气体中含有二氧化碳
12.根据质量守恒定律判断细铁丝在纯氧中完全燃烧后生成物的质量 ( )
A.一定小于参加反应的铁丝的质量
B.一定大于参加反应的铁丝的质量
C.一定等于参加反应的铁丝的质量
D.上述结果都有可能
13.下列关于空气中各组成成分说法正确的是( )
A.空气中的O2只有点燃时才能发生化学反应
B.空气中的CO2是导致酸雨的主要原因
C.空气中的N2可作为生产氮肥的原料
D.空气中的稀有气体没有任何使用价值
14.樱桃种植户为提高大棚樱桃的产量,采取了以下措施,其中不能达到目的的是( )
A.合理密植
B.适当增加光照时间
C.适时松土、施肥
D.保持棚内温度恒定
15.[宿迁中考]煤气中加入有特殊气味的乙硫醇可提示煤气是否泄漏。乙硫醇(用X表示)燃烧时发生的反应为:2X+9O24CO2+2SO2+6H2O,则X是( )
A.C4H12S2 B.C2H6S
C.C2H6O2 D.C2H6
16.人在吸气时,下列哪一项生理活动与空气进入肺内无关?( )
A.膈肌舒张 B.肋间肌收缩 C.肺内压力降低 D.胸廓容积增大
17.以下叙述中,不正确的是( )
A.催化剂在化学反应中能改变化学反应速率
B.水电解的反应是一个分解反应
C.aL水和bL酒精混合后,总体积小于(a+b)L
D.混合物中一定含有两种或两种以上元素
18.当空气受SO2严重污染时,可通过飞机喷洒X粉末,使空气中的SO2含量明显降低,该过程发生的反应是2X +2SO2+O2=2CaSO4 +2CO2. X的化学式是( )
A.CaO B.CaCO3 C.Ca(OH)2 D.Na2CO3
19.下列情况会使大气中的二氧化碳浓度升高的是 ( )
A.利用石灰水吸收空气中的二氧化碳
B.汽车数量增加
C.发展太阳能、水能以代替煤、石油等燃料
D.植树造林
20.自然界中有很多过程会消耗大气中二氧化碳。在下列叙述的过程中,你认为会消耗大气中二氧化碳的是( )
①二氧化碳溶于海水、江河、湖水 ②绿色植物的光合作用
③汽车的大量使用 ④动物的呼吸作用
A.①② B.①④ C.①②③ D.①②③④
二、填空题
21.小晨同学在研究二氧化碳气体的性质时,进行了如图所示的实验:
(1)二氧化碳通常用大理石与稀盐酸反应制取,一般用____________法收集;
(2)向漏斗中倾倒二氧化碳,燃着的蜡烛自下而上熄灭,由此说明二氧化碳具有的物理性质是_____________________________________________________________________。
22.(原创)2010年上海世博会上展示了一款最新概念车——叶子(如图),它出色的能量转换技术和“负排放”理念吸引了许多观众.
(1)车顶的“大叶子”是一部奇妙的能量转化器,它模拟自然界中叶片光合作用的某一阶段,即捕获空气中的_____和水,释放出电子,形成电流,实现了_____能转化为电能.然后将产生的电能传给锂电池充电,由电机驱动汽车.
(2)若该车最高速度可达72千米/小时,则行驶1200米至少需要______分钟.
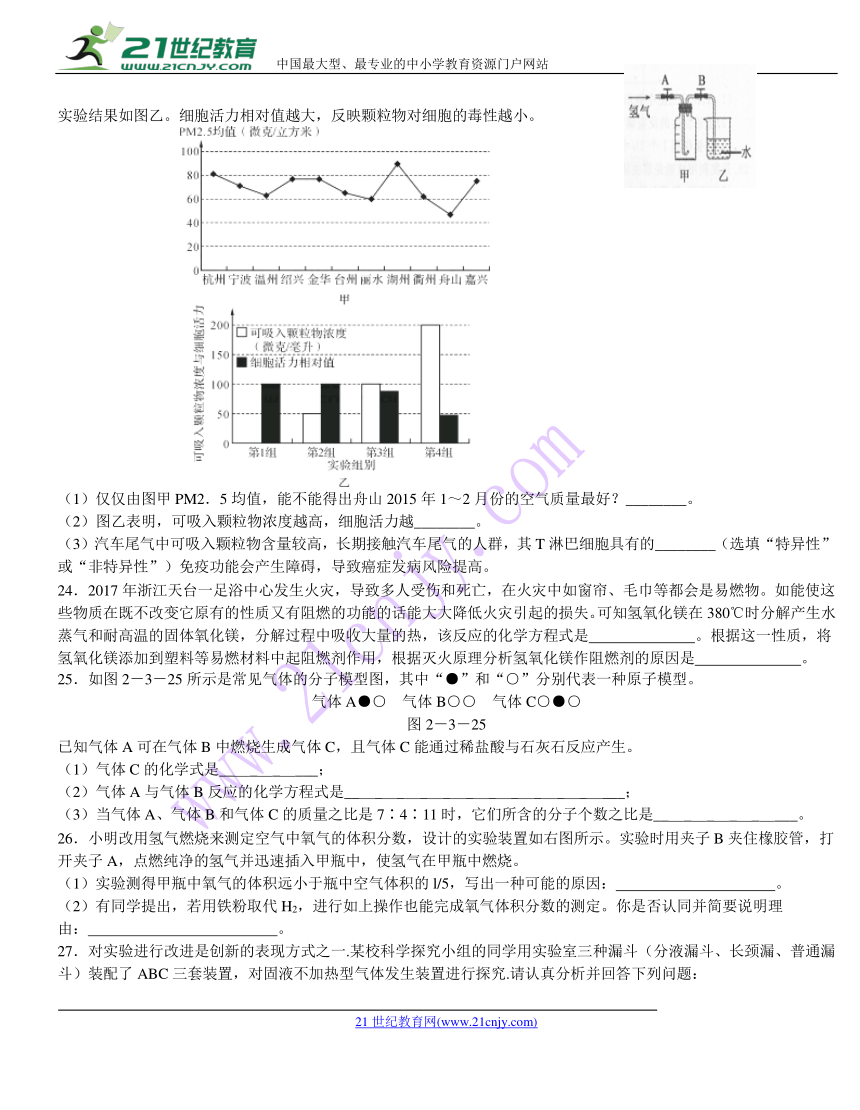
23.可吸入颗粒物中PM2.5能进入血液。如图甲是2015年1~2月份11个地区PM2.5均值。为了研究可吸入颗粒物对人体成熟T淋巴细胞的影响,用含有不同浓度可吸入颗粒物的培养液培养T淋巴细胞,48小时后检测细胞活力,实验结果如图乙。细胞活力相对值越大,反映颗粒物对细胞的毒性越小。
(1)仅仅由图甲PM2.5均值,能不能得出舟山2015年1~2月份的空气质量最好?________。
(2)图乙表明,可吸入颗粒物浓度越高,细胞活力越________。
(3)汽车尾气中可吸入颗粒物含量较高,长期接触汽车尾气的人群,其T淋巴细胞具有的________(选填“特异性”或“非特异性”)免疫功能会产生障碍,导致癌症发病风险提高。
24.2017年浙江天台一足浴中心发生火灾,导致多人受伤和死亡,在火灾中如窗帘、毛巾等都会是易燃物。如能使这些物质在既不改变它原有的性质又有阻燃的功能的话能大大降低火灾引起的损失。可知氢氧化镁在380℃时分解产生水蒸气和耐高温的固体氧化镁,分解过程中吸收大量的热,该反应的化学方程式是 。根据这一性质,将氢氧化镁添加到塑料等易燃材料中起阻燃剂作用,根据灭火原理分析氢氧化镁作阻燃剂的原因是 。
25.如图2-3-25所示是常见气体的分子模型图,其中“●”和“○”分别代表一种原子模型。
气体A●○ 气体B○○ 气体C○●○
图2-3-25
已知气体A可在气体B中燃烧生成气体C,且气体C能通过稀盐酸与石灰石反应产生。
(1)气体C的化学式是__________;
(2)气体A与气体B反应的化学方程式是__________________________;
(3)当气体A、气体B和气体C的质量之比是7∶4∶11时,它们所含的分子个数之比是______________。
26.小明改用氢气燃烧来测定空气中氧气的体积分数,设计的实验装置如右图所示。实验时用夹子B夹住橡胶管,打开夹子A,点燃纯净的氢气并迅速插入甲瓶中,使氢气在甲瓶中燃烧。
(1)实验测得甲瓶中氧气的体积远小于瓶中空气体积的l/5,写出一种可能的原因: 。
(2)有同学提出,若用铁粉取代H2,进行如上操作也能完成氧气体积分数的测定。你是否认同并简要说明理由: 。
27.对实验进行改进是创新的表现方式之一.某校科学探究小组的同学用实验室三种漏斗(分液漏斗、长颈漏、普通漏斗)装配了ABC三套装置,对固液不加热型气体发生装置进行探究.请认真分析并回答下列问题:
(1)A、B装置均可用作实验室制取H2、02, CO2气体的发生装置.请写出实验室用A、B装置制O2的化学方程式 ;
(2)C装置不能用作制取气体的发生装置,可在C装置中加装一个小试管,把C装置改装成D装置就能实现制取气体的目的.则D装置中小试管的作用是 .
三、实验探究题
28.今年初三学生参加了化学实验技能考查,下列是某校为“二氧化碳制法和性质"准备的常用仪器和药品.
仪器:
药品:浓盐酸、稀盐酸、石灰石、碳酸钠、澄清石灰水
【考场片段】
(1)马小哈:第一步选择仪器 (填仪器编号)组装好发生装置;第二步向组装好的装置中加入药品,反应剧烈,迅速停止.
你认为马小哈所取的固体药品是 ,操作中缺少的主要步骤是 .
(2)马小虎:将制得的气体通入足量的澄清石灰水,始终未见浑浊.
你认为马小虎取的酸溶液可能是 .
【归纳总结】
实验室制取CO2可选择上述药品中的 ;收集CO2的常用方法是 .
【拓展延伸】
(3)某小组的同学查阅资料得知:“神七"宇宙飞船中宇航员呼出的CO2和水蒸气均能与氧再生装置中的固体物质超氧化钾(KO2)反应产生O2,其反应原理为:
4KO2+2H20==4KOH+3O2↑; 4KO2+2CO2==2K2CO3+3O2
为了探究KO2能否与CO2反应产生O2,他们进行了如下实验:
说明:B装置可除去CO2中混有的少量HCl气体.
①经检验,E中集气瓶内收集的气体为O2,检验On的方法是
②实验观察到D中变浑浊,可能的原因是(只写一个) .
③某同学认为,在上述实验装置B和C之间增加一个干燥装置才能证明KO2能与CO2反应产生O2,你认为他的观点是 (填“正确’’或“错误’’)的,请说明理由 .
29.某研究小组为了验证二氧化碳的部分性质,进行如下实验.
(1)利用图一实验验证二氧化碳具有密度比空气大、不能燃烧、____________的性质.要让蜡烛自下而上熄灭,选用图一中的_______装置更易成功.
(2)利用图二装置验证二氧化碳能否与氢氧化钠、氢氧化钙反应.他们先关闭K1,打开K2,往导管中缓缓通入600毫升二氧化碳,丙、丁容器中均无明显现象;然后打开K1,关闭K2,继续往导管中通入二氧化碳,观察到丁容器中出现浑浊(通常情况下1体积水大约能吸收1体积二氧化碳).根据以上现象,可以推断本实验中二氧化碳________.
A.一定与氢氧化钙反应 B.可能与氢氧化钙反应
C.一定与氢氧化钠反应 D.可能与氢氧化钠反应
30.如图所示是市场充气包装的食品,它使用的是什么气体呢?某兴趣小组对此进行了研究。
(1)经访问有关人员,了解到这样包装的目的是为了防止食品挤压变形或食品腐败,且从经济性、环保等因素考虑,工厂使用的包装气体是空气或空气的成分之一。请你以此调查结果为依据,对包装气体的成分提出三种猜想,并说明你猜想的依据:
猜想一
猜想二
猜想三
我对气体
的猜想是
空气
二氧化碳
(CO2)
氮气(N2)
我猜想的
依据是
防止挤
压变形
防止挤压变形
或食品腐败
防止挤压变形
或食品腐败
(2)从获得气体的难易和经济性考虑,若只是为了防止食品挤压变形,最好使用的气体是:________。
四、计算题
31.鸡蛋壳的主要成分是碳酸钙,为了测定蛋壳中碳酸钙的质量分数,小王和小明同学进行了如下实验:
它俩将蛋壳洗净、干燥并捣碎放在烧杯里,然后往烧杯中加入足量盐酸。实验过程和测定的相关实验数据如下图所示:
(1)小王根据“蛋壳残渣4.3g”,求得蛋壳中碳酸钙质量分数为____ ____。
小明根据“反应过程中减少的质量”也求得了蛋壳中碳酸钙的质量分数,请你写出小明的计算过程和结果。(H:1 C:12 O:16 Cl:35.5 Ca:40)
(2)小王和小明根据不同的数据求得蛋壳中碳酸钙的质量分数有明显差别,请你分析其中可能的原因。
32.某化学兴趣小组欲测定一瓶过氧化氢溶液中溶质的质量分数,实验操作及相关数据如图所示:
(1)生产氧气的质量_________g;
(2)这瓶过氧化氢溶液中溶质的质量分数是多少?(写出计算过程)
浙教版八下科学第三章单元检测卷(参考答案)
一、选择题
题号
1
2
3
4
5
6
7
8
9
10
答案
D
.D
C
C
D
A
D
C
A
C
题号
11
12
13
14
15
16
17
18
19
20
答案
D
B
C
D
B
A
D
B
B
A
二、填空题
21.(1)向上排空气 (2)密度比空气的大
22.(1) 二氧化碳 , 光 . (2) 1 分钟.
23.(1)不能 (2)小 (3)特异性
24.(1)
(2)氢氧化镁分解生成的氧化镁使可燃物与氧气隔绝,分解过程吸收大量的热,且生成的热被水蒸气带走,使可燃物的温度降到着火点以下,同时水蒸气能稀释可燃物表面的氧气。
(每空2分)
25.CO2 2CO+O22CO2 2∶1∶2
26.还没有冷却至室温就打开了夹子B 铁粉通过缓慢氧化也能耗尽装置瓶中的氧气
27.(1) 2H2O2 MnO2 2H2O+O2 ?
(2)保证装置的气密性(或“防止生成气体从漏斗逸出”)
三、实验探究题
28.(每空l分,共10分)
(1)②③④ 碳酸钠 检验装置的气密性
(2)浓盐酸石灰石、稀盐酸 向上排空气法
(3)①用带火星的木条
@cO2在装置C中没有被完全吸收
③正确 因为H2O和KO2也能反应产生O2
29. (1)不支持燃烧或不助燃 乙
(2)A、C(选对一项得1分,有错选不得分)
30.空气
四、计算题
31.(1) 57%;设碳酸钙的质量为x.
CaCO3 +2HCl═CaCl2 +H 2 O+CO 2 ↑
100?????????????44
x??????????????3.3g???? 100: x = 44 :3.3g ?
解得:x=7.5g 碳酸钙的质量分数为: 7.5g 10g ×100%=75%
(2) 小王计算所用的蛋壳残渣可能未干燥,实际蛋壳残渣质量小于4.3g或小明计算所用的数据“3.3g”中包含了反应过程中盐酸挥发了的氯化氢气体的质量,即实际生成的二氧化碳气体质量小于3.3g.
32. 解:(1)根据质量守恒定律,反应生成氧气的质量=68g+2g-68.4g=1.6g;故填:1.6
(2)设68g过氧化氢溶液中含有过氧化氢的质量为x.
2H2O22H2O + O2↑
68 32
x 1.6g
解得,x=3.4g
过氧化氢溶液的溶质的质量分数为
答:该过氧化氢溶液的溶质的质量分数5%。
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
