九年级化学下册第6章溶解现象第2节溶液组成的表示练习沪教版
文档属性
| 名称 | 九年级化学下册第6章溶解现象第2节溶液组成的表示练习沪教版 |

|
|
| 格式 | zip | ||
| 文件大小 | 348.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-07-16 00:00:00 | ||
图片预览


文档简介
第6章 溶解现象
第2节 溶液组成的表示
一、选择题
13.(2017·沈阳)按下列方法配制的溶液,其溶质质量分数为5%的是
A.称取5.0g氯化钾,溶解在95mL水中,充分搅拌
B.称取5.0g生石灰,放入95mL水中,充分搅拌
C.量取5.OmL浓盐酸,倒入95mL水中,充分搅拌
D.称取5.0g二氧化锰,放入95mL水中,充分搅拌
【答案】A
8.(2017·怀化)下列有关溶液说法正确的是
A.溶液都是均一、稳定的混合物 B.形成溶液的溶质都是固体
C.所有饱和溶液都比不饱和溶液要浓 D.溶液的体积等于溶质的体积与溶剂的体积之和
【答案】A
9.(2017·海南)用硝酸钾固体配制溶质的质量分数为10%的硝酸钾溶液50g。下列做法不正确的是
A.称量:用天平称量硝酸钾5g B.量取:用量筒量取蒸馏水45mL
C.溶解:将硝酸钾倒入量筒中溶解 D.转移:将配好的溶液转移至试剂瓶
【答案】C
(2017·荆州)4.实验室配制100g 10%的NaCl溶液,不需要用到的仪器是
A.酒精灯 B.托盘天平 C.胶头滴管 D.烧杯
【答案】A
(2017·天水)4.实验室配制氯化钠溶液的操作中,正确的是( )
【答案】D
(2017·毕节)7.生活和生产中的一些实际问题可用化学知识分析、解释。下列说法错误的是
A.金属生锈是世界面临的难题,铁生锈是铁与水、氧气共同作用的结果
B.综合运用沉淀、过滤、蒸馏几项操作净水效果更好
C.衣服、餐具上的油污可以用加入洗涤剂的水洗掉,是利用了洗涤剂的乳化原理
D.人体缺少必需微量元素会得病,因此应尽可能多吃含有这些元素的营养补剂
【答案】D
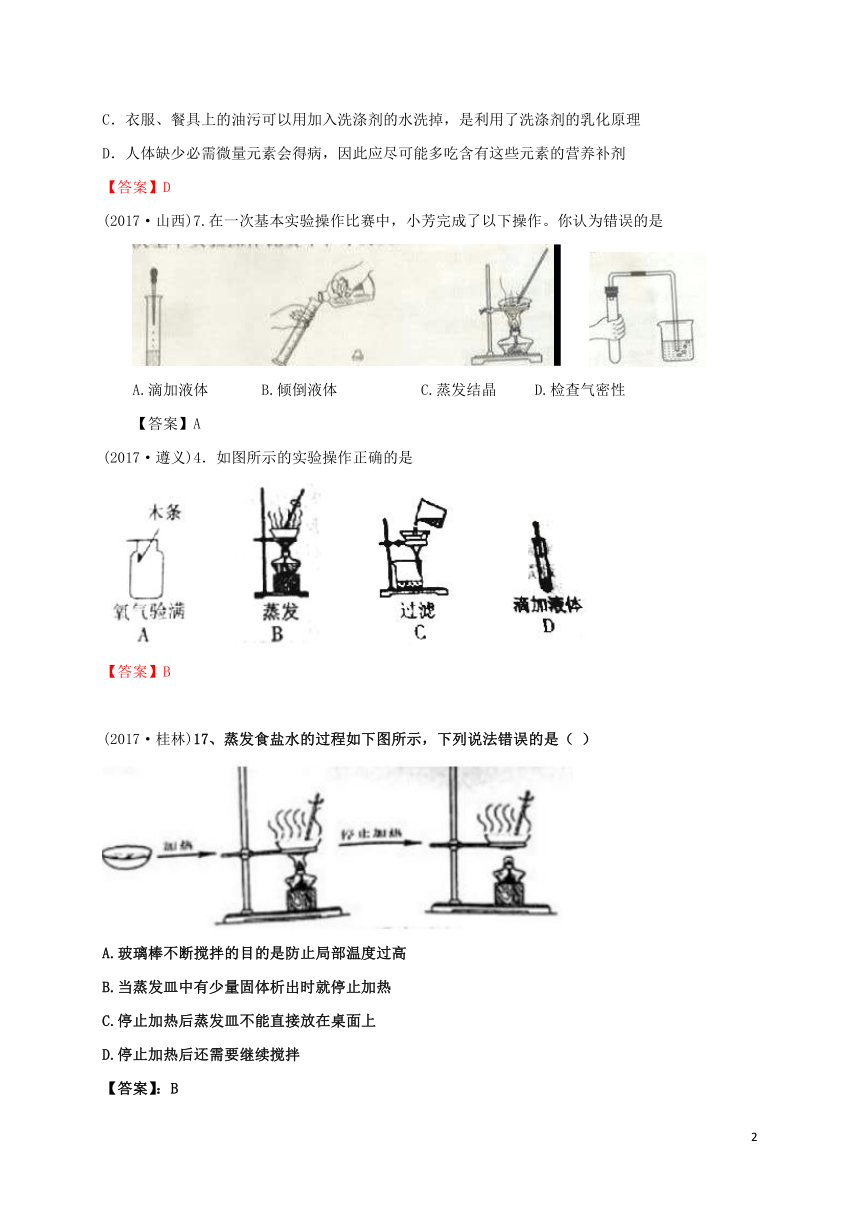
(2017·山西)7.在一次基本实验操作比赛中,小芳完成了以下操作。你认为错误的是
A.滴加液体 B.倾倒液体 C.蒸发结晶 D.检查气密性
【答案】A
(2017·遵义)4.如图所示的实验操作正确的是
【答案】B
(2017·桂林)17、蒸发食盐水的过程如下图所示,下列说法错误的是( )
A.玻璃棒不断搅拌的目的是防止局部温度过高
B.当蒸发皿中有少量固体析出时就停止加热
C.停止加热后蒸发皿不能直接放在桌面上
D.停止加热后还需要继续搅拌
【答案】:B
(2017·来宾)19.在粗盐难溶性杂质去除实验中,操作错误的是( )
A.称量时,在托盘天平左右两盘垫上相同质量的纸片
B.溶解时,用玻璃棒搅拌加快粗盐溶解
C.过滤时,用玻璃棒搅拌漏斗内的液体加快过滤
D.蒸发时,当蒸发皿中出现较多固体时停止加热
故选:C.
(2017·江西)8.进行“一定溶质质量分数的氯化钠溶液的配制” 实验活动常出现以下错误操作,其中不影响所配溶液浓度的是
【答案】D
二、填空题
(2017·齐齐哈尔)18.水和溶液对于人类的生产和生命活动有重大的意义。
(1)生活中可以用________区分硬水和软水,通过_________的方法将硬水软化。
(2)电解水的实验中,正负两极产生气体的体积比为_________,通过实验可以得出水是由___________组成的。
(3)用氯化钠固体和水配制6%的氯化钠溶液。下图正确的操作顺序是____________(填字母序号),若量取水时仰视读数,其它操作均正确,则配制的氯化钠溶液中溶质质量分数____6% (填“>”“<”或“ = ”)。
【答案】(1)肥皂水;煮沸(2)1:2;氢元素和氧元素(或氢氧元素或H和O)(3)BCAED;
三、实验题
33.(2017·邵阳)某同学配制50g 6%氯化钠溶液,整个操作过程如图所示,回答下列问题:
(1)配制溶液的正确操作顺序为 ②①⑤③④ (填序号,下同),其中操作错误的是 ① ;
(2)图②中盛放氯化钠固体的仪器名称是 广口瓶 ,需称取氯化钠 3 g;
(3)量水时选用的量筒的量程最合适的是 C (填序号),读数时视线要与量筒内 凹液面的最低处 保持水平
A.10mL B.25mL C.50mL D.100mL
(4)经检测,该同学配制的溶液溶质质量分数偏小,可能的原因是 AD (填序号)
A.氯化钠固体不纯 B.用生锈砝码称量 C.装瓶时有少量溶液洒出 D.溶解时烧杯内壁有水珠.
6.(2017?福建)欲配制10.0%的NaCl溶液50 g,部分操作如下图所示,正确的是
【答案】D
(2017·广东)17.(4分)“题17图”是实验室配制一定溶质质量分数的NaCl溶液的流程图。
请回答:
(1)应称量____gNaCl,需加水_____mL。
(2)若称量NaCl固体时指针向右偏转,则应_____直到天平平衡。
(3)取上述溶液10g加水稀释到____g,可得到5%的NaCl溶液。
【答案】(1)7.5g, 42.5。(2)向左盘添加氯化钠。(3)30g,。
(2017·齐齐哈尔)25.掌握仪器的使用并严格按照操作要求进行实验,才能保障化学实验的成功和安全。根据所学化学知识,回答下列问题:
(1)量取一定体积的水需要用_____________和________________。(填仪器名称)
(2)过滤后滤液仍然浑浊,原因是_________________________。(答一点即可)
(3)蒸发时要用玻璃棒搅拌,目的是________________________________________。
【答案】(1)量筒;胶头滴管(写滴管也给分)
(2)滤纸破损;仪器不干净(或盛滤液的烧杯不干净);漏斗内液面高于滤纸边缘,
(3)搅拌,防止因局部温度过高,造成液滴飞溅。
四、计算题
(2017·绥化)30.某化学兴趣小组同学在清理实验室时发现一瓶浓盐酸,标签如下。
500ml
品名:盐酸 化学式:HC1
相对分子质量:36.5 密度:1.19g/ml
溶质质量分数:38%
报据标签计算。
(1) HCl中氢元素和氧元素的质量比为 (结国用最简整数比表示)。
(2)这瓶盐酸溶液的质量为 g。
(3)现要配制3800g溶质质量分数为10%的稀盐酸,需要溶质质量分数为38%的浓盐酸的质量为 g,需要这种浓盐酸 瓶。
【答案】(1)2:71 (2)595 (3)1000 2
12.(7分)(2017?福建)农业废弃物是指农业生产过程中废弃的有机物,如秸秆、蔗渣等。
(1)农业废弃物经发酵处理可获得沼气(主要成分为甲烷)。甲烷完全燃烧的化学方程式为_______。
(2)闽籍科学家张俐娜发明了一种快速溶解农业废弃物的“神奇溶剂”。该“神奇溶剂”小氢氧化钠、尿素和水的质量比为7:12:81。
①“神奇溶剂”是一种溶液,其溶质有_______。
②某次生产需用到100 kg“神奇溶剂”。现仪川氢氧化钠溶液和尿素来配制,所用的氢氧化钠溶液的溶质质量分数为_______(列出计算式即可)。
③利用该“神奇溶剂”溶解农业废弃物生产的新型纤维素膜,在土壤中能完全降解。利用此膜替代普通塑料,可缓解的环境问题是_______(写一点)。
【答案】(1)CH4+2O2CO2+2H2O
(2)①氢氧化钠、尿素;②(或其他合理答案);③白色污染(或其他合理答案)
22.(2017·河北)用图1所示装置制取氢气并测定稀硫酸中溶质的质量分数,将稀硫酸全部加入锥形瓶中,天平示数的变化如图2所示,请计算:
(1)共制取氢气 g;
(2)稀硫酸中溶质的质量分数.
【答案】(1)0.2g; (2)9.8%
22.(2017·营口) (4分)某化学小组欲配制49g溶质质量分数为20%的稀硫酸来进行实验,老师为它们提供了溶质质量分数为98%的浓硫酸(密度为1.84g/cm3)。
(1)通过计算,需要用到溶质质量分数为98%的浓硫酸的质量是____g。
(2)量取浓硫酸时仰视读数(其他操作正确),则配制的稀硫酸的溶质质量分数____(填“大于”、“小于”或“等于”) 20%。
(3)A和B是两个同学稀释浓硫酸操作的示意图,正确的是____(填“A”或“B”)。 . }
(4)玻璃棒搅拌的作用是______。
【答案】(1)10;(2)偏大;(3)B;(4)搅拌。
27.(2017·本溪)(6分)将12.5g含碳酸钙80%的石灰石与50g稀盐酸放入同一烧杯中混合,二者恰好完全反应(杂质不溶于水,也不参与反应)。请计算:反应后所得溶液的溶质质量分数(结果保留到1%)
答:反应后所得溶液的溶质质量分数为20%
24.(2017·益阳)如图所示,往水电解器中加入96g蒸馏水和2g Na2SO4(Na2SO4不参与反应,仅起增加水的导电性的作用)组成的混合物,然后进行电解,当负极得到2g气体时,停止实验(所需相对原子质量:H﹣1、O﹣16).计算:
(1)停止实验时,电解消耗水的质量是多少?
(2)停止实验后,剩余溶液中Na2SO4的质量分数是多少?
答:(1)停止实验时,电解消耗水的质量是18g.
(2)停止实验后,剩余溶液中Na2SO4的质量分数是2.5%.
35.(2017·邵阳)某同学在实验室用氯酸钾和二氧化锰的混合物制取氧气,并对反应后固体剩余物进行回收、利用,实验操作流程及数据记录如下
请回答下列问题:
(1)滤液可作化肥使用,你认为它属于 钾 肥;
(2)该同学制得氧气的质量 4.8 g;
(3)计算滤液中溶质质量分数.
第2节 溶液组成的表示
一、选择题
13.(2017·沈阳)按下列方法配制的溶液,其溶质质量分数为5%的是
A.称取5.0g氯化钾,溶解在95mL水中,充分搅拌
B.称取5.0g生石灰,放入95mL水中,充分搅拌
C.量取5.OmL浓盐酸,倒入95mL水中,充分搅拌
D.称取5.0g二氧化锰,放入95mL水中,充分搅拌
【答案】A
8.(2017·怀化)下列有关溶液说法正确的是
A.溶液都是均一、稳定的混合物 B.形成溶液的溶质都是固体
C.所有饱和溶液都比不饱和溶液要浓 D.溶液的体积等于溶质的体积与溶剂的体积之和
【答案】A
9.(2017·海南)用硝酸钾固体配制溶质的质量分数为10%的硝酸钾溶液50g。下列做法不正确的是
A.称量:用天平称量硝酸钾5g B.量取:用量筒量取蒸馏水45mL
C.溶解:将硝酸钾倒入量筒中溶解 D.转移:将配好的溶液转移至试剂瓶
【答案】C
(2017·荆州)4.实验室配制100g 10%的NaCl溶液,不需要用到的仪器是
A.酒精灯 B.托盘天平 C.胶头滴管 D.烧杯
【答案】A
(2017·天水)4.实验室配制氯化钠溶液的操作中,正确的是( )
【答案】D
(2017·毕节)7.生活和生产中的一些实际问题可用化学知识分析、解释。下列说法错误的是
A.金属生锈是世界面临的难题,铁生锈是铁与水、氧气共同作用的结果
B.综合运用沉淀、过滤、蒸馏几项操作净水效果更好
C.衣服、餐具上的油污可以用加入洗涤剂的水洗掉,是利用了洗涤剂的乳化原理
D.人体缺少必需微量元素会得病,因此应尽可能多吃含有这些元素的营养补剂
【答案】D
(2017·山西)7.在一次基本实验操作比赛中,小芳完成了以下操作。你认为错误的是
A.滴加液体 B.倾倒液体 C.蒸发结晶 D.检查气密性
【答案】A
(2017·遵义)4.如图所示的实验操作正确的是
【答案】B
(2017·桂林)17、蒸发食盐水的过程如下图所示,下列说法错误的是( )
A.玻璃棒不断搅拌的目的是防止局部温度过高
B.当蒸发皿中有少量固体析出时就停止加热
C.停止加热后蒸发皿不能直接放在桌面上
D.停止加热后还需要继续搅拌
【答案】:B
(2017·来宾)19.在粗盐难溶性杂质去除实验中,操作错误的是( )
A.称量时,在托盘天平左右两盘垫上相同质量的纸片
B.溶解时,用玻璃棒搅拌加快粗盐溶解
C.过滤时,用玻璃棒搅拌漏斗内的液体加快过滤
D.蒸发时,当蒸发皿中出现较多固体时停止加热
故选:C.
(2017·江西)8.进行“一定溶质质量分数的氯化钠溶液的配制” 实验活动常出现以下错误操作,其中不影响所配溶液浓度的是
【答案】D
二、填空题
(2017·齐齐哈尔)18.水和溶液对于人类的生产和生命活动有重大的意义。
(1)生活中可以用________区分硬水和软水,通过_________的方法将硬水软化。
(2)电解水的实验中,正负两极产生气体的体积比为_________,通过实验可以得出水是由___________组成的。
(3)用氯化钠固体和水配制6%的氯化钠溶液。下图正确的操作顺序是____________(填字母序号),若量取水时仰视读数,其它操作均正确,则配制的氯化钠溶液中溶质质量分数____6% (填“>”“<”或“ = ”)。
【答案】(1)肥皂水;煮沸(2)1:2;氢元素和氧元素(或氢氧元素或H和O)(3)BCAED;
三、实验题
33.(2017·邵阳)某同学配制50g 6%氯化钠溶液,整个操作过程如图所示,回答下列问题:
(1)配制溶液的正确操作顺序为 ②①⑤③④ (填序号,下同),其中操作错误的是 ① ;
(2)图②中盛放氯化钠固体的仪器名称是 广口瓶 ,需称取氯化钠 3 g;
(3)量水时选用的量筒的量程最合适的是 C (填序号),读数时视线要与量筒内 凹液面的最低处 保持水平
A.10mL B.25mL C.50mL D.100mL
(4)经检测,该同学配制的溶液溶质质量分数偏小,可能的原因是 AD (填序号)
A.氯化钠固体不纯 B.用生锈砝码称量 C.装瓶时有少量溶液洒出 D.溶解时烧杯内壁有水珠.
6.(2017?福建)欲配制10.0%的NaCl溶液50 g,部分操作如下图所示,正确的是
【答案】D
(2017·广东)17.(4分)“题17图”是实验室配制一定溶质质量分数的NaCl溶液的流程图。
请回答:
(1)应称量____gNaCl,需加水_____mL。
(2)若称量NaCl固体时指针向右偏转,则应_____直到天平平衡。
(3)取上述溶液10g加水稀释到____g,可得到5%的NaCl溶液。
【答案】(1)7.5g, 42.5。(2)向左盘添加氯化钠。(3)30g,。
(2017·齐齐哈尔)25.掌握仪器的使用并严格按照操作要求进行实验,才能保障化学实验的成功和安全。根据所学化学知识,回答下列问题:
(1)量取一定体积的水需要用_____________和________________。(填仪器名称)
(2)过滤后滤液仍然浑浊,原因是_________________________。(答一点即可)
(3)蒸发时要用玻璃棒搅拌,目的是________________________________________。
【答案】(1)量筒;胶头滴管(写滴管也给分)
(2)滤纸破损;仪器不干净(或盛滤液的烧杯不干净);漏斗内液面高于滤纸边缘,
(3)搅拌,防止因局部温度过高,造成液滴飞溅。
四、计算题
(2017·绥化)30.某化学兴趣小组同学在清理实验室时发现一瓶浓盐酸,标签如下。
500ml
品名:盐酸 化学式:HC1
相对分子质量:36.5 密度:1.19g/ml
溶质质量分数:38%
报据标签计算。
(1) HCl中氢元素和氧元素的质量比为 (结国用最简整数比表示)。
(2)这瓶盐酸溶液的质量为 g。
(3)现要配制3800g溶质质量分数为10%的稀盐酸,需要溶质质量分数为38%的浓盐酸的质量为 g,需要这种浓盐酸 瓶。
【答案】(1)2:71 (2)595 (3)1000 2
12.(7分)(2017?福建)农业废弃物是指农业生产过程中废弃的有机物,如秸秆、蔗渣等。
(1)农业废弃物经发酵处理可获得沼气(主要成分为甲烷)。甲烷完全燃烧的化学方程式为_______。
(2)闽籍科学家张俐娜发明了一种快速溶解农业废弃物的“神奇溶剂”。该“神奇溶剂”小氢氧化钠、尿素和水的质量比为7:12:81。
①“神奇溶剂”是一种溶液,其溶质有_______。
②某次生产需用到100 kg“神奇溶剂”。现仪川氢氧化钠溶液和尿素来配制,所用的氢氧化钠溶液的溶质质量分数为_______(列出计算式即可)。
③利用该“神奇溶剂”溶解农业废弃物生产的新型纤维素膜,在土壤中能完全降解。利用此膜替代普通塑料,可缓解的环境问题是_______(写一点)。
【答案】(1)CH4+2O2CO2+2H2O
(2)①氢氧化钠、尿素;②(或其他合理答案);③白色污染(或其他合理答案)
22.(2017·河北)用图1所示装置制取氢气并测定稀硫酸中溶质的质量分数,将稀硫酸全部加入锥形瓶中,天平示数的变化如图2所示,请计算:
(1)共制取氢气 g;
(2)稀硫酸中溶质的质量分数.
【答案】(1)0.2g; (2)9.8%
22.(2017·营口) (4分)某化学小组欲配制49g溶质质量分数为20%的稀硫酸来进行实验,老师为它们提供了溶质质量分数为98%的浓硫酸(密度为1.84g/cm3)。
(1)通过计算,需要用到溶质质量分数为98%的浓硫酸的质量是____g。
(2)量取浓硫酸时仰视读数(其他操作正确),则配制的稀硫酸的溶质质量分数____(填“大于”、“小于”或“等于”) 20%。
(3)A和B是两个同学稀释浓硫酸操作的示意图,正确的是____(填“A”或“B”)。 . }
(4)玻璃棒搅拌的作用是______。
【答案】(1)10;(2)偏大;(3)B;(4)搅拌。
27.(2017·本溪)(6分)将12.5g含碳酸钙80%的石灰石与50g稀盐酸放入同一烧杯中混合,二者恰好完全反应(杂质不溶于水,也不参与反应)。请计算:反应后所得溶液的溶质质量分数(结果保留到1%)
答:反应后所得溶液的溶质质量分数为20%
24.(2017·益阳)如图所示,往水电解器中加入96g蒸馏水和2g Na2SO4(Na2SO4不参与反应,仅起增加水的导电性的作用)组成的混合物,然后进行电解,当负极得到2g气体时,停止实验(所需相对原子质量:H﹣1、O﹣16).计算:
(1)停止实验时,电解消耗水的质量是多少?
(2)停止实验后,剩余溶液中Na2SO4的质量分数是多少?
答:(1)停止实验时,电解消耗水的质量是18g.
(2)停止实验后,剩余溶液中Na2SO4的质量分数是2.5%.
35.(2017·邵阳)某同学在实验室用氯酸钾和二氧化锰的混合物制取氧气,并对反应后固体剩余物进行回收、利用,实验操作流程及数据记录如下
请回答下列问题:
(1)滤液可作化肥使用,你认为它属于 钾 肥;
(2)该同学制得氧气的质量 4.8 g;
(3)计算滤液中溶质质量分数.
