盐类专题复习——生活中的“碱”(36张PPT)
文档属性
| 名称 | 盐类专题复习——生活中的“碱”(36张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-08-28 17:04:58 | ||
图片预览











文档简介
课件36张PPT。盐类专题复习生活中的“碱”1.复习碳酸钠的相关性质及用途;
2.拓展、延伸与碳酸钠有关的中考题。
学习目标:学习重点:1.碳酸钠的化学性质的运用
2.物质的鉴别与含量的测定自主复习:碳酸钠的主要性质 1、 色粉末状固体,易溶于水,水溶液呈 性,PH 7 ,俗称 ,类别属 (填酸、碱、盐中的一种)。
2、酸碱指示剂遇碳酸钠溶液分别显示的颜色为 、 。
3、与稀盐酸的反应(化学方程式,下同)
;4、与石灰水(或氢氧化钡溶液)的反应
;
5、与氯化钙(或氯化钡)的反应
。
自主复习:碳酸钠的主要性质1、用作食品工业发酵剂(还有哪些发酵剂)
2、造纸、冶金、玻璃、纺织、染料等工业等
3、生活中油污的清洗(油污清洗的其它方法)
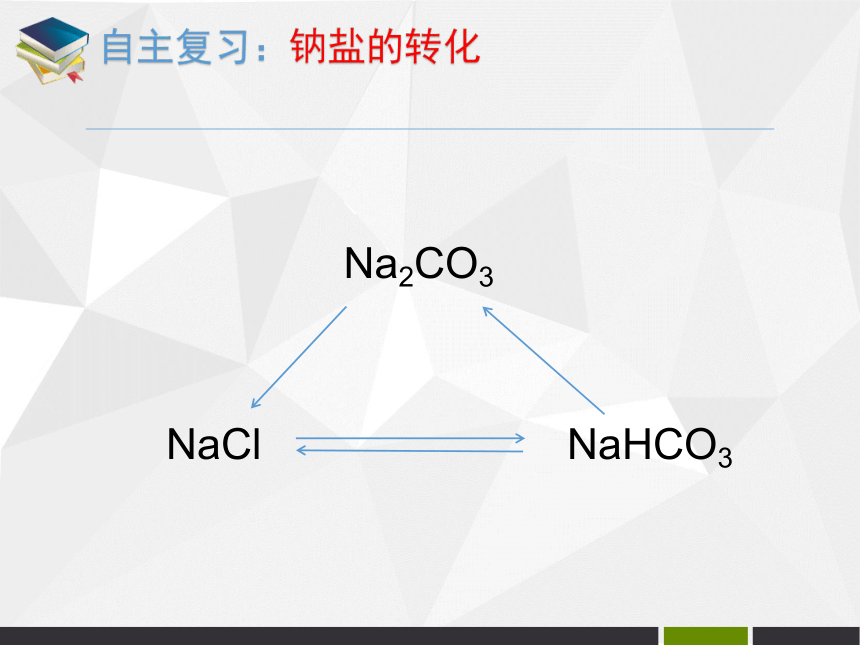
自主复习:碳酸钠的主要用途自主复习:发酵剂自主复习:钠盐的转化NaClNaHCO3Na2CO3请设计4种不同的实验方案,鉴别碳酸钠和氯化钠两种无色溶液。
方案1: 。
方案2: 。
方案3: 。
方案4: 。
方案5:......自主复习:问题与思考探究1:如何区分氯化钠溶液和碳酸钠溶液?15342酚酞试液显红色的为碳酸钠溶液
无色的为氯化钠溶液探究1:如何区分氯化钠溶液和碳酸钠溶液?15342pH试纸pH>7 ,碳酸钠溶液
pH=7,氯化钠溶液探究1:如何区分氯化钠溶液和碳酸钠溶液?15342稀盐酸有大量气泡产生的是碳酸钠溶液
无明显现象的为氯化钠溶液探究1:如何区分氯化钠溶液和碳酸钠溶液?15342氢氧化钙溶液有白色沉淀产生的是碳酸钠溶液
无明显现象的为氯化钠溶液探究1:如何区分氯化钠溶液和碳酸钠溶液?15342氯化钙溶液有白色沉淀产生的是碳酸钠溶液
无明显现象的为氯化钠溶液探究1:如何区分氯化钠溶液和碳酸钠溶液?Na2CO3+2HCl==2NaCl+H2O+CO2↑Na2CO3+Ca(OH)2==CaCO3↓+2NaOHNa2CO3+CaCl2==CaCO3↓+2NaCl酚酞试液显红色的为碳酸钠溶液
无色的为氯化钠溶液pH试纸pH>7 ,碳酸钠溶液
pH=7,氯化钠溶液稀盐酸有大量气泡产生的是碳酸钠溶液
无明显现象的为氯化钠溶液氢氧化钙溶液有白色沉淀产生的是碳酸钠溶液
无明显现象的为氯化钠溶液氯化钙溶液有白色沉淀产生的是碳酸钠溶液
无明显现象的为氯化钠溶液利用以上知识拓展;如何证明一瓶无色溶液是Na2CO3。自主学习:实验探究知识拓展:焰色反应1、如何用实验证明:敞口放置的NaOH是否变质?是否完全变质?
2、能力提升:如何除去NaOH溶液中混有的Na2CO3?(要求简述实验操作方法并写出相关反应的化学方程式)自主学习:中考链接:鉴别与除杂
例、某品牌纯碱中只含有少量氯化钠。某化学探究小组为了测定该纯碱的纯度(即Na2CO3的质量分数),组内一同学设计了如下实验:
自主学习:模拟中考—碳酸钠含量的测定【方案一】测定沉淀质量法—思路将要测定的物质转化为沉淀自主学习:模拟中考—碳酸钠含量的测定(1)溶液A中的溶质是(填写化学式)___________。
(2)操作Ⅰ是___________。如何洗______________,如何证明已洗干净__________________________。
(3)若缺少操作Ⅰ,会导致测定结果____________。(偏大、偏小、无影响)
(4)如何判断CaCl2溶液已经过量______________。
A、将溶液静置向溶液中滴加CaCl2溶液,没有沉淀出现
B、静置向溶液中滴加Na2CO3溶液,有白色沉淀出现
将样品与稀盐酸反应,测定反应后生成CO2的体积,经换算并计算出样品中Na2CO3的质量。【方案二】测定气体体积法 用下图装置测定产生的CO2气体的体积。讨论,残留在装置的气体对结果有无影响。(1)判断图1所示装置气密性良好的方法 _____。
A、关闭分液漏斗活塞,向量管内加水两边能形成稳定的水面差。
B、关闭分液漏斗活塞,向量管内加水两边的液面始终相平。
(2)图1中的收集装置,其中在水面上放一层植物油的目的是__________,植物油上方原有空气对实验结果___________(填“有”或“没有”)影响。老师指出图1测定结果略偏大,其原因是_________。
要准确测出CO2的体积,装置改进如右图3,增加一个橡皮管即可,橡皮管还有一个优点是:______,读数时要进行的一个操作是_______(填操作方法),目的是使油层上方气体压强和外界大气压相同。(3)此方法残留在锥形瓶内的CO2对实验结果_______影响。
(4)也有人用图2装置测定CO2的质量(碱石灰的成分是CaO和NaOH的混合物,可吸收CO2气体)。该装置导致实验结果偏小的可能原因是 .
A、装置内残留的CO2气体不能全部排出。
B、产生的CO2气体中混有氯化氢气体,同时被碱石灰吸收。
C、产生的CO2气体中混有水蒸气,同时被碱石灰吸收。
D、球形干燥管与空气相通,也会吸收空气中的CO2和H2O。【方案三】测定气体质量法 利用上图所示实验装置(铁架台略去)和试剂,通过测定样品20.0g和稀盐酸反应产生的CO2气体的质量,计算Na2CO3的质量分数(装置气密性良好,忽略盐酸的挥发性且每步反应或作用都是完全的).
(1)打开止水夹K,先对装置A和B(已连接)通入已除去CO2的空气一会儿,以排尽装置A和B中含有_______空气,再接上装置C和D.
(2)关闭止水夹K,加入足量的稀盐酸(杂质不与盐酸反应),装置A中样品产生气体的化学方程式为________________________________________.
(3)待装置A中的反应结束后,再一次打开止水夹K,继续往装置通入已除去CO2的空气一会儿。根据_________ 定律,装置______________(填标号)在反应前后的质量差4.4g就是产生CO2的质量,由此计算出该样品中Na2CO3的质量分数__________。装置B的作用是__________________________,若没有装置D,将会使测定结果________(选填“偏大”或“偏小” )。 操作1:称取一定质量的样品放入烧杯中,加水溶解,然后滴加过量_________,以除去_________,然后再滴加过量_________。
操作2:混合物液体过滤,将滤渣____、____、称量。计算出氯化钠质量,再求出纯碱的含量。【方案四】测定氯化钠,后换算出纯碱的含量。欢迎各位专家批评与指正
2.拓展、延伸与碳酸钠有关的中考题。
学习目标:学习重点:1.碳酸钠的化学性质的运用
2.物质的鉴别与含量的测定自主复习:碳酸钠的主要性质 1、 色粉末状固体,易溶于水,水溶液呈 性,PH 7 ,俗称 ,类别属 (填酸、碱、盐中的一种)。
2、酸碱指示剂遇碳酸钠溶液分别显示的颜色为 、 。
3、与稀盐酸的反应(化学方程式,下同)
;4、与石灰水(或氢氧化钡溶液)的反应
;
5、与氯化钙(或氯化钡)的反应
。
自主复习:碳酸钠的主要性质1、用作食品工业发酵剂(还有哪些发酵剂)
2、造纸、冶金、玻璃、纺织、染料等工业等
3、生活中油污的清洗(油污清洗的其它方法)
自主复习:碳酸钠的主要用途自主复习:发酵剂自主复习:钠盐的转化NaClNaHCO3Na2CO3请设计4种不同的实验方案,鉴别碳酸钠和氯化钠两种无色溶液。
方案1: 。
方案2: 。
方案3: 。
方案4: 。
方案5:......自主复习:问题与思考探究1:如何区分氯化钠溶液和碳酸钠溶液?15342酚酞试液显红色的为碳酸钠溶液
无色的为氯化钠溶液探究1:如何区分氯化钠溶液和碳酸钠溶液?15342pH试纸pH>7 ,碳酸钠溶液
pH=7,氯化钠溶液探究1:如何区分氯化钠溶液和碳酸钠溶液?15342稀盐酸有大量气泡产生的是碳酸钠溶液
无明显现象的为氯化钠溶液探究1:如何区分氯化钠溶液和碳酸钠溶液?15342氢氧化钙溶液有白色沉淀产生的是碳酸钠溶液
无明显现象的为氯化钠溶液探究1:如何区分氯化钠溶液和碳酸钠溶液?15342氯化钙溶液有白色沉淀产生的是碳酸钠溶液
无明显现象的为氯化钠溶液探究1:如何区分氯化钠溶液和碳酸钠溶液?Na2CO3+2HCl==2NaCl+H2O+CO2↑Na2CO3+Ca(OH)2==CaCO3↓+2NaOHNa2CO3+CaCl2==CaCO3↓+2NaCl酚酞试液显红色的为碳酸钠溶液
无色的为氯化钠溶液pH试纸pH>7 ,碳酸钠溶液
pH=7,氯化钠溶液稀盐酸有大量气泡产生的是碳酸钠溶液
无明显现象的为氯化钠溶液氢氧化钙溶液有白色沉淀产生的是碳酸钠溶液
无明显现象的为氯化钠溶液氯化钙溶液有白色沉淀产生的是碳酸钠溶液
无明显现象的为氯化钠溶液利用以上知识拓展;如何证明一瓶无色溶液是Na2CO3。自主学习:实验探究知识拓展:焰色反应1、如何用实验证明:敞口放置的NaOH是否变质?是否完全变质?
2、能力提升:如何除去NaOH溶液中混有的Na2CO3?(要求简述实验操作方法并写出相关反应的化学方程式)自主学习:中考链接:鉴别与除杂
例、某品牌纯碱中只含有少量氯化钠。某化学探究小组为了测定该纯碱的纯度(即Na2CO3的质量分数),组内一同学设计了如下实验:
自主学习:模拟中考—碳酸钠含量的测定【方案一】测定沉淀质量法—思路将要测定的物质转化为沉淀自主学习:模拟中考—碳酸钠含量的测定(1)溶液A中的溶质是(填写化学式)___________。
(2)操作Ⅰ是___________。如何洗______________,如何证明已洗干净__________________________。
(3)若缺少操作Ⅰ,会导致测定结果____________。(偏大、偏小、无影响)
(4)如何判断CaCl2溶液已经过量______________。
A、将溶液静置向溶液中滴加CaCl2溶液,没有沉淀出现
B、静置向溶液中滴加Na2CO3溶液,有白色沉淀出现
将样品与稀盐酸反应,测定反应后生成CO2的体积,经换算并计算出样品中Na2CO3的质量。【方案二】测定气体体积法 用下图装置测定产生的CO2气体的体积。讨论,残留在装置的气体对结果有无影响。(1)判断图1所示装置气密性良好的方法 _____。
A、关闭分液漏斗活塞,向量管内加水两边能形成稳定的水面差。
B、关闭分液漏斗活塞,向量管内加水两边的液面始终相平。
(2)图1中的收集装置,其中在水面上放一层植物油的目的是__________,植物油上方原有空气对实验结果___________(填“有”或“没有”)影响。老师指出图1测定结果略偏大,其原因是_________。
要准确测出CO2的体积,装置改进如右图3,增加一个橡皮管即可,橡皮管还有一个优点是:______,读数时要进行的一个操作是_______(填操作方法),目的是使油层上方气体压强和外界大气压相同。(3)此方法残留在锥形瓶内的CO2对实验结果_______影响。
(4)也有人用图2装置测定CO2的质量(碱石灰的成分是CaO和NaOH的混合物,可吸收CO2气体)。该装置导致实验结果偏小的可能原因是 .
A、装置内残留的CO2气体不能全部排出。
B、产生的CO2气体中混有氯化氢气体,同时被碱石灰吸收。
C、产生的CO2气体中混有水蒸气,同时被碱石灰吸收。
D、球形干燥管与空气相通,也会吸收空气中的CO2和H2O。【方案三】测定气体质量法 利用上图所示实验装置(铁架台略去)和试剂,通过测定样品20.0g和稀盐酸反应产生的CO2气体的质量,计算Na2CO3的质量分数(装置气密性良好,忽略盐酸的挥发性且每步反应或作用都是完全的).
(1)打开止水夹K,先对装置A和B(已连接)通入已除去CO2的空气一会儿,以排尽装置A和B中含有_______空气,再接上装置C和D.
(2)关闭止水夹K,加入足量的稀盐酸(杂质不与盐酸反应),装置A中样品产生气体的化学方程式为________________________________________.
(3)待装置A中的反应结束后,再一次打开止水夹K,继续往装置通入已除去CO2的空气一会儿。根据_________ 定律,装置______________(填标号)在反应前后的质量差4.4g就是产生CO2的质量,由此计算出该样品中Na2CO3的质量分数__________。装置B的作用是__________________________,若没有装置D,将会使测定结果________(选填“偏大”或“偏小” )。 操作1:称取一定质量的样品放入烧杯中,加水溶解,然后滴加过量_________,以除去_________,然后再滴加过量_________。
操作2:混合物液体过滤,将滤渣____、____、称量。计算出氯化钠质量,再求出纯碱的含量。【方案四】测定氯化钠,后换算出纯碱的含量。欢迎各位专家批评与指正
