第7章 应用广泛的酸、碱、盐——善变的氢氧化钠(28张PPT)
文档属性
| 名称 | 第7章 应用广泛的酸、碱、盐——善变的氢氧化钠(28张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 34.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-08-28 20:43:41 | ||
图片预览








文档简介
课件28张PPT。
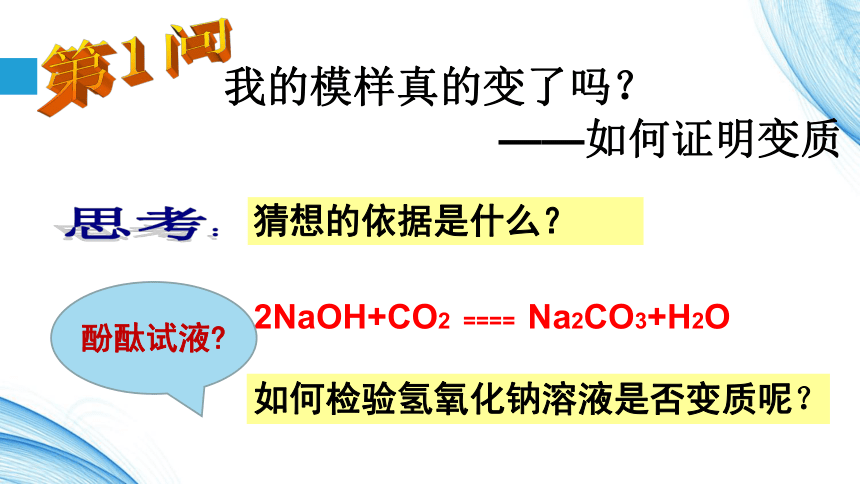
“善变”的氢氧化钠新坝中学 殷金花&&这种白色固体是什么物质?氢氧化钠变质了吗?我的模样真的变了吗?
——如何证明变质2NaOH+CO2 ==== Na2CO3+H2O思考:第1问如何检验氢氧化钠溶液是否变质呢?猜想的依据是什么?酚酞试液?方法一:取少量待测液于试管中,向其中滴加 稀盐酸方法二:取少量待测液于试管中,向其中滴加少量的澄清石灰水方法三:取少量待测液于试管中,向其中滴加少量的CaCl2溶液(或BaCl2溶液)实验的实质:检验氢氧化钠溶液中是否________存在!没有气泡产生有气泡产生没有产生白色沉淀产生白色沉淀实验方案:提供药品:酚酞溶液、稀盐酸、澄清石灰水、氯化钡溶液、氯化钙溶液足量的酸加少了,则可能和
溶液中的氢氧化钠反应完了碳酸根离子氢氧化钠溶液中碳酸根离子的检验Na2CO3+2HCl==2NaCl+H2O+CO2↑Na2CO3+Ca(OH)2==2NaOH+CaCO3↓Na2CO3+CaCl2==2NaCl+CaCO3↓稀盐酸氢氧化钙溶液氯化钙溶液或
氯化钡溶液Na2CO3+BaCl2==2NaCl+BaCO3↓试剂:我的变化究竟有多大?
——变质的程度②NaOH溶液部分变质①NaOH溶液全部变质思考:第2问如果氢氧化钠溶液是部分变质,溶液中的溶质是 ;
如果氢氧化钠溶液是全部变质,溶液中的溶质是 。 Na2CO3 、NaOHNa2CO3检验氢氧化钠溶液是否全部变质实际就是检验溶液中是否还含有 。NaOH氢氧化钠溶液变质的程度思考:第2问如何检验氢氧化钠溶液变质的程度呢?提供药品:酚酞溶液、稀盐酸、澄清石灰水、氯化钡溶液、氯化钙溶液实验方案:1、如果只用酸、碱、盐溶液能不能检验氢氧化钠溶液是否全部变质?思考:2、能不能只用无色酚酞溶液检验氢氧化钠溶液是否全部变质?结论1:现象相同,不能只用酸、碱、盐。结论2:碳酸钠溶液显碱性,也能使酚酞变红色,现象相同,不能单独用酚酞。总结:
第一步必先除尽碳酸根离子。
(注:1、选择的试剂,应选择能除CO32-,而不影响OH-的Ba2+,或Ca2+ 。
2、除CO32- 时所滴加试剂足量或过量。
第二步,证明是否还有OH-存在。1、先检验OH–还是CO32-?选用什么试剂?
2、试剂的用量要注意什么?①取少量待测液于试管中,向其中滴加适量(或足量)的CaCl2溶液②再向其中滴加无色酚酞试液有白色沉淀生成有白色沉淀生成溶液没有明显变化溶液变成红色提供药品:酚酞溶液、稀盐酸、澄清石灰水、氯化钡溶液、氯化钙溶液实验方案:操作②能不能用其他溶液代替酚酞溶液呢?思考:可以用CuSO4溶液或FeCl3溶液或PH试纸探究的实质:检验溶液中是否存在氢氧化钠!实验的实质:检验溶液中是否存在氢氧根离子!指示剂紫色石蕊溶液无色酚酞溶液紫色石蕊溶液变蓝无色酚酞溶液变红氯化铵溶液有刺激性气味的气体放出氯化铜溶液有蓝色沉淀生成氯化铁溶液有红褐色沉淀生成氢氧根离子的检验:讨论交流如果该瓶氢氧化钠溶液已经变质了,那它还有没有使用 价值?并说明理由。2、当氢氧化钠溶液部分变质时:1、当氢氧化钠溶液全部变质时:可以直接当碳酸钠溶液使用!只要想办法除去其中已变质部分的Na2CO3,就能再继续使用!如果能继续使用,应该怎样使用呢?思考: 如何还一个纯净的我
——除去NaOH溶液中的Na2CO3Na2CO3 + CaCl2 = CaCO3↓+2NaClNa2CO3 + BaCl2 = BaCO3↓+2NaCl第3问提供药品:酚酞溶液、稀盐酸、澄清石灰水、
氯化钡溶液、氯化钙溶液实验方案:结论与解释:不能,会引入新的杂质NaCl;学法指导:化学方程式:Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH 不增不减易分离,沾亲带故先考虑,变废为宝最可取关于“除杂”的那点事设计方案:
方案1:取一定质量的样品(样品中只含氢氧化钠和碳酸钠),加入足量稀硫酸,测定产生气体的量,从而计算出样品中碳酸钠的质量
方案2:取一定量样品溶于水,加入足量氯化钡溶液,测定生成沉淀的量,从而计算出样品中碳酸钠的质量我想知道我变了多少?
——如何测Na2CO3 含量?第4问1、测定气体的质量:2、水蒸气随气体逸出造成的误差?问题1:该反应生成CO2气体,可以用什么物质来吸收? 4、空气中的二氧化碳可能会被吸收,导致实验误差。
如何改进?稀盐酸3、用稀盐酸或稀硫酸和样品反应,哪个导致的实验误差较大一些?5、反应前后鼓空气的目的? ‥‥‥2、测定气体的体积:(1)水的上方放一层植物油有什么作用?
(2)植物油上方的空气对测定结果有无影响?
(3)滴下液体的体积造成的误差?
‥‥‥
保证气体体积读数的准确:
①装置不能 ;
②气体不能 ;
③读数前需调节__________
__________________________漏气溶于水水准管的高度使左右液面相平
方案二:测定沉淀的质量
1.原理:__________________________
2.主要操作步骤:
(1)取10克样品加足量水溶解;
(2)加入过量的氯化钡溶液,直到沉淀完全;
(3)过滤,洗涤、干燥
(4)称量所得沉淀质量9.85克
3.计算样品中碳酸钠的质量分数____________。
Na2CO3+BaCl2==2NaCl+BaCO3↓课堂总结 1 氢氧化钠暴露于空气中会变质为 ___________
2 检验氢氧化钠变质选择的试剂类别是
(1)酸:加入稀硫酸或稀盐酸,
(2) 碱:Ca(OH)2或Ba(OH)2溶液,
(3) 盐:BaCl2溶液CaCl2溶液
3 检验氢氧化钠是否完全变质的试剂是__________
4 除去氢氧化钠中的杂质碳酸钠选用的试剂是____________样品CO2H2SO4气体逸出后减少的质量NaOH 、碱石灰、澄清石灰水等吸收称增重的质量气体逸出后测量体积5.测定部分变质的氢氧化钠中碳酸钠质量的方法:Ca2+ Ba2+ 将所得沉淀过滤、洗涤、干燥、称量中考链接 、小明在化学实验室发现,盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末,小明叫来小刚和小军,共同探究这种白色粉末的成分。他们依据所学的化学知识,对这种白色粉末的成分作了如下猜想:
①可能是NaOH;②可能是Na2CO3;③可能是NaOH与Na2CO3的混合物。
为了验证猜想,他们分别做了下面的实验。
(1)小明取少量白色粉末,滴加稀盐酸,有气体生成,由此小明认为白色粉末是Na2CO3。请判断小明所得结论是否正确,并简述理由
。
(2)小刚取少量白色粉末溶于水,向所得溶液中滴加酚酞溶液,溶液变成红色。由此小刚认为白色粉末是NaOH。请判断小刚所得结论是否正确,并简述理由。
。
目的(3)小军取少量白色粉末溶于水,向所得溶液中滴加适量Ca(OH)2溶液,有白色沉淀产生。由此判断白色粉末中含有 。为了验证猜想③,
你认为他接下来应进行的实验操作是: ①可能是NaOH;②可能是Na2CO3;③可能是NaOH与Na2CO3的混合物足量HCl足量HCl足量HCl有气泡产生(1)小明取少量白色粉末,滴加稀盐酸,有气体生成,由此小明
认为白色粉末是Na2CO3。请判断小明所得结论是否正确,
并简述理由 。 不正确,如粉末是③,也有此现象无明显现象有气泡产生①可能是NaOH;②可能是Na2CO3;③可能是NaOH与Na2CO3的混合物酚酞酚酞酚酞 红 色(2)小刚取少量白色粉末溶于水,向所得溶液中滴加酚酞溶液,
溶液变成红色。由此小刚认为白色粉末是NaOH。请判断小刚
所得结论是否正确,并简述理由。不正确,Na2CO3溶液显碱性,也可使无色酚酞变红(3)小军取少量白色粉末溶于水,向所得溶液中滴加适量CaCl2溶液,有白色沉淀产生。由此判断白色粉末中含有 。为了验证猜想③,
你认为他接下来应进行的实验操作是: Na2CO3NaOH部分变质可有是NaOH与Na2CO3的混合物(4)在小军所做的实验中,若把CaCl2溶液换Ca(OH)2溶液是否可行?请简述理由___________________________________.2、例题.为了测定某氢氧化钠样品的变质程度,校化学课外活动小组利用该样品与稀硫酸反应,设计了如右图所示的实验装置进行实验。
①检查装置气密性的方法是:连接好装置,从量气管注水,量气管两边形成高度差,做好标记,一段时间后,高度差 ,说明气密性良好。 ②在图中油层的作用
③装置中反应前后,读取量气管中水面刻度之前,都需进行的操作是 。
④该小组进行了三次实验,所得相关的实验的平均数据结果处理如下:(实验温度下ρCO2=1.977g/L) M(Na2CO3)=106不变防止二氧化碳溶于水。Na2CO3+H2SO4 == Na2SO4+H2O+CO2↑调节量气管的高度使左右液面相平计算(1)产生二氧化碳质量 。
(2)该样品中碳酸钠的质量分数 111ml=0.111L,m=ρv=1.977g/L *0.111L= 0.22g53% 0.22g解:设样品中Na2CO3的质量为X .Na2CO3+H2SO4 == Na2SO4+H2O+CO2↑10644X0.22g106
X=4 4
0.22gX= 0.53g样品中Na2CO3的质量分数=0.53g
10gx100%= 53%答:样品中Na2CO3的质量分数为53% .@谢谢!
“善变”的氢氧化钠新坝中学 殷金花&&这种白色固体是什么物质?氢氧化钠变质了吗?我的模样真的变了吗?
——如何证明变质2NaOH+CO2 ==== Na2CO3+H2O思考:第1问如何检验氢氧化钠溶液是否变质呢?猜想的依据是什么?酚酞试液?方法一:取少量待测液于试管中,向其中滴加 稀盐酸方法二:取少量待测液于试管中,向其中滴加少量的澄清石灰水方法三:取少量待测液于试管中,向其中滴加少量的CaCl2溶液(或BaCl2溶液)实验的实质:检验氢氧化钠溶液中是否________存在!没有气泡产生有气泡产生没有产生白色沉淀产生白色沉淀实验方案:提供药品:酚酞溶液、稀盐酸、澄清石灰水、氯化钡溶液、氯化钙溶液足量的酸加少了,则可能和
溶液中的氢氧化钠反应完了碳酸根离子氢氧化钠溶液中碳酸根离子的检验Na2CO3+2HCl==2NaCl+H2O+CO2↑Na2CO3+Ca(OH)2==2NaOH+CaCO3↓Na2CO3+CaCl2==2NaCl+CaCO3↓稀盐酸氢氧化钙溶液氯化钙溶液或
氯化钡溶液Na2CO3+BaCl2==2NaCl+BaCO3↓试剂:我的变化究竟有多大?
——变质的程度②NaOH溶液部分变质①NaOH溶液全部变质思考:第2问如果氢氧化钠溶液是部分变质,溶液中的溶质是 ;
如果氢氧化钠溶液是全部变质,溶液中的溶质是 。 Na2CO3 、NaOHNa2CO3检验氢氧化钠溶液是否全部变质实际就是检验溶液中是否还含有 。NaOH氢氧化钠溶液变质的程度思考:第2问如何检验氢氧化钠溶液变质的程度呢?提供药品:酚酞溶液、稀盐酸、澄清石灰水、氯化钡溶液、氯化钙溶液实验方案:1、如果只用酸、碱、盐溶液能不能检验氢氧化钠溶液是否全部变质?思考:2、能不能只用无色酚酞溶液检验氢氧化钠溶液是否全部变质?结论1:现象相同,不能只用酸、碱、盐。结论2:碳酸钠溶液显碱性,也能使酚酞变红色,现象相同,不能单独用酚酞。总结:
第一步必先除尽碳酸根离子。
(注:1、选择的试剂,应选择能除CO32-,而不影响OH-的Ba2+,或Ca2+ 。
2、除CO32- 时所滴加试剂足量或过量。
第二步,证明是否还有OH-存在。1、先检验OH–还是CO32-?选用什么试剂?
2、试剂的用量要注意什么?①取少量待测液于试管中,向其中滴加适量(或足量)的CaCl2溶液②再向其中滴加无色酚酞试液有白色沉淀生成有白色沉淀生成溶液没有明显变化溶液变成红色提供药品:酚酞溶液、稀盐酸、澄清石灰水、氯化钡溶液、氯化钙溶液实验方案:操作②能不能用其他溶液代替酚酞溶液呢?思考:可以用CuSO4溶液或FeCl3溶液或PH试纸探究的实质:检验溶液中是否存在氢氧化钠!实验的实质:检验溶液中是否存在氢氧根离子!指示剂紫色石蕊溶液无色酚酞溶液紫色石蕊溶液变蓝无色酚酞溶液变红氯化铵溶液有刺激性气味的气体放出氯化铜溶液有蓝色沉淀生成氯化铁溶液有红褐色沉淀生成氢氧根离子的检验:讨论交流如果该瓶氢氧化钠溶液已经变质了,那它还有没有使用 价值?并说明理由。2、当氢氧化钠溶液部分变质时:1、当氢氧化钠溶液全部变质时:可以直接当碳酸钠溶液使用!只要想办法除去其中已变质部分的Na2CO3,就能再继续使用!如果能继续使用,应该怎样使用呢?思考: 如何还一个纯净的我
——除去NaOH溶液中的Na2CO3Na2CO3 + CaCl2 = CaCO3↓+2NaClNa2CO3 + BaCl2 = BaCO3↓+2NaCl第3问提供药品:酚酞溶液、稀盐酸、澄清石灰水、
氯化钡溶液、氯化钙溶液实验方案:结论与解释:不能,会引入新的杂质NaCl;学法指导:化学方程式:Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH 不增不减易分离,沾亲带故先考虑,变废为宝最可取关于“除杂”的那点事设计方案:
方案1:取一定质量的样品(样品中只含氢氧化钠和碳酸钠),加入足量稀硫酸,测定产生气体的量,从而计算出样品中碳酸钠的质量
方案2:取一定量样品溶于水,加入足量氯化钡溶液,测定生成沉淀的量,从而计算出样品中碳酸钠的质量我想知道我变了多少?
——如何测Na2CO3 含量?第4问1、测定气体的质量:2、水蒸气随气体逸出造成的误差?问题1:该反应生成CO2气体,可以用什么物质来吸收? 4、空气中的二氧化碳可能会被吸收,导致实验误差。
如何改进?稀盐酸3、用稀盐酸或稀硫酸和样品反应,哪个导致的实验误差较大一些?5、反应前后鼓空气的目的? ‥‥‥2、测定气体的体积:(1)水的上方放一层植物油有什么作用?
(2)植物油上方的空气对测定结果有无影响?
(3)滴下液体的体积造成的误差?
‥‥‥
保证气体体积读数的准确:
①装置不能 ;
②气体不能 ;
③读数前需调节__________
__________________________漏气溶于水水准管的高度使左右液面相平
方案二:测定沉淀的质量
1.原理:__________________________
2.主要操作步骤:
(1)取10克样品加足量水溶解;
(2)加入过量的氯化钡溶液,直到沉淀完全;
(3)过滤,洗涤、干燥
(4)称量所得沉淀质量9.85克
3.计算样品中碳酸钠的质量分数____________。
Na2CO3+BaCl2==2NaCl+BaCO3↓课堂总结 1 氢氧化钠暴露于空气中会变质为 ___________
2 检验氢氧化钠变质选择的试剂类别是
(1)酸:加入稀硫酸或稀盐酸,
(2) 碱:Ca(OH)2或Ba(OH)2溶液,
(3) 盐:BaCl2溶液CaCl2溶液
3 检验氢氧化钠是否完全变质的试剂是__________
4 除去氢氧化钠中的杂质碳酸钠选用的试剂是____________样品CO2H2SO4气体逸出后减少的质量NaOH 、碱石灰、澄清石灰水等吸收称增重的质量气体逸出后测量体积5.测定部分变质的氢氧化钠中碳酸钠质量的方法:Ca2+ Ba2+ 将所得沉淀过滤、洗涤、干燥、称量中考链接 、小明在化学实验室发现,盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末,小明叫来小刚和小军,共同探究这种白色粉末的成分。他们依据所学的化学知识,对这种白色粉末的成分作了如下猜想:
①可能是NaOH;②可能是Na2CO3;③可能是NaOH与Na2CO3的混合物。
为了验证猜想,他们分别做了下面的实验。
(1)小明取少量白色粉末,滴加稀盐酸,有气体生成,由此小明认为白色粉末是Na2CO3。请判断小明所得结论是否正确,并简述理由
。
(2)小刚取少量白色粉末溶于水,向所得溶液中滴加酚酞溶液,溶液变成红色。由此小刚认为白色粉末是NaOH。请判断小刚所得结论是否正确,并简述理由。
。
目的(3)小军取少量白色粉末溶于水,向所得溶液中滴加适量Ca(OH)2溶液,有白色沉淀产生。由此判断白色粉末中含有 。为了验证猜想③,
你认为他接下来应进行的实验操作是: ①可能是NaOH;②可能是Na2CO3;③可能是NaOH与Na2CO3的混合物足量HCl足量HCl足量HCl有气泡产生(1)小明取少量白色粉末,滴加稀盐酸,有气体生成,由此小明
认为白色粉末是Na2CO3。请判断小明所得结论是否正确,
并简述理由 。 不正确,如粉末是③,也有此现象无明显现象有气泡产生①可能是NaOH;②可能是Na2CO3;③可能是NaOH与Na2CO3的混合物酚酞酚酞酚酞 红 色(2)小刚取少量白色粉末溶于水,向所得溶液中滴加酚酞溶液,
溶液变成红色。由此小刚认为白色粉末是NaOH。请判断小刚
所得结论是否正确,并简述理由。不正确,Na2CO3溶液显碱性,也可使无色酚酞变红(3)小军取少量白色粉末溶于水,向所得溶液中滴加适量CaCl2溶液,有白色沉淀产生。由此判断白色粉末中含有 。为了验证猜想③,
你认为他接下来应进行的实验操作是: Na2CO3NaOH部分变质可有是NaOH与Na2CO3的混合物(4)在小军所做的实验中,若把CaCl2溶液换Ca(OH)2溶液是否可行?请简述理由___________________________________.2、例题.为了测定某氢氧化钠样品的变质程度,校化学课外活动小组利用该样品与稀硫酸反应,设计了如右图所示的实验装置进行实验。
①检查装置气密性的方法是:连接好装置,从量气管注水,量气管两边形成高度差,做好标记,一段时间后,高度差 ,说明气密性良好。 ②在图中油层的作用
③装置中反应前后,读取量气管中水面刻度之前,都需进行的操作是 。
④该小组进行了三次实验,所得相关的实验的平均数据结果处理如下:(实验温度下ρCO2=1.977g/L) M(Na2CO3)=106不变防止二氧化碳溶于水。Na2CO3+H2SO4 == Na2SO4+H2O+CO2↑调节量气管的高度使左右液面相平计算(1)产生二氧化碳质量 。
(2)该样品中碳酸钠的质量分数 111ml=0.111L,m=ρv=1.977g/L *0.111L= 0.22g53% 0.22g解:设样品中Na2CO3的质量为X .Na2CO3+H2SO4 == Na2SO4+H2O+CO2↑10644X0.22g106
X=4 4
0.22gX= 0.53g样品中Na2CO3的质量分数=0.53g
10gx100%= 53%答:样品中Na2CO3的质量分数为53% .@谢谢!
