基础实验8 酸与碱的化学性质(17张PPT)
文档属性
| 名称 | 基础实验8 酸与碱的化学性质(17张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-08-31 00:00:00 | ||
图片预览




文档简介
课件17张PPT。基础实验8 酸与碱的化学性质实验准备
本实验因涉及酸、碱较多,便于比较、总结,将学生分成甲乙两组。讲台
乙6 甲6 乙1 甲1
乙7 甲7 乙2 甲2
乙8 甲8 乙3 甲3
乙9 甲9 乙4 甲4
乙10 甲10 乙5 甲5基础实验8 酸与碱的化学性质实验1 常见酸的化学性质注意点:
1.组内配合:靠水槽一侧的同学只负责测温度变化和洗涤温度计;另一位同学负责加入药品和记录现象。
2.温度计每使用依次要用水冲洗并用纸擦干,冷却至室温!
3.先加入固体药品,再加入酸液。注意用量要求!固体粉末只需1/4药匙,液体不能超过井穴的1/3。
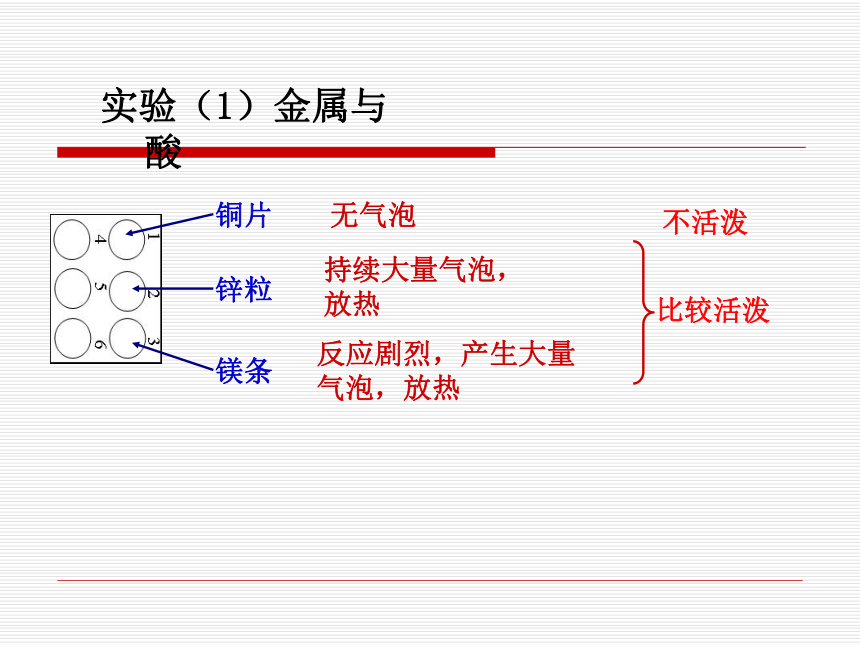
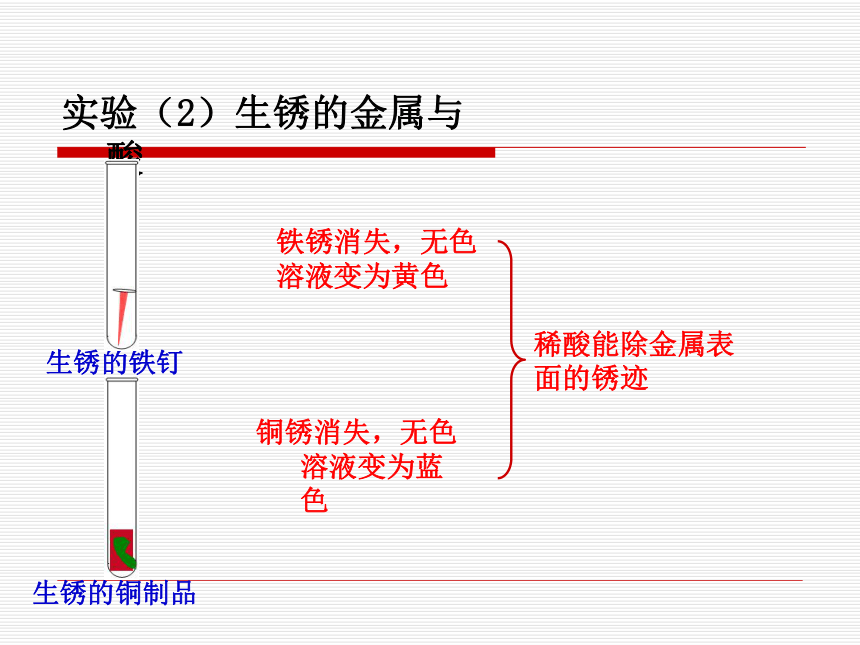
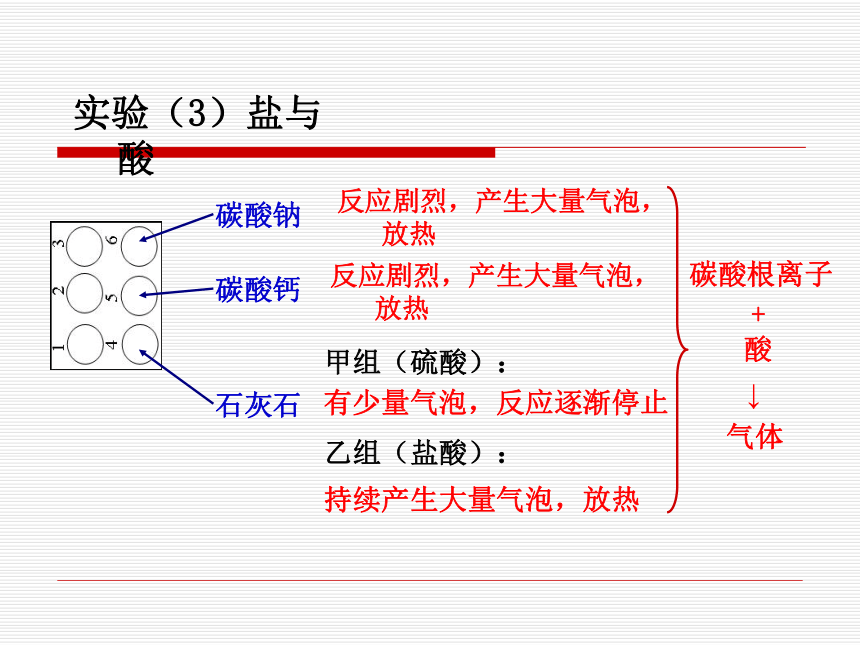
4.每加一次酸液就测一次温度,只要看到有温度变化就做下一个实验,不必等到反应结束。 实验(1)金属与酸不活泼 持续大量气泡,放热反应剧烈,产生大量气泡,放热无气泡 锌粒铜片镁条实验(2)生锈的金属与酸铜锈消失,无色溶液变为蓝色生锈的铁钉生锈的铜制品铁锈消失,无色溶液变为黄色实验(3)盐与酸碳酸钙碳酸钠石灰石反应剧烈,产生大量气泡,放热 反应剧烈,产生大量气泡,放热 甲组(硫酸):有少量气泡,反应逐渐停止乙组(盐酸):持续产生大量气泡,放热 不能长期浸泡,去除铁锈后,如酸有剩余,会和铁反应。
Fe2O3+6HCl == 2FeCl3+3H2O
Fe+2HCl == FeCl2+H2↑
Fe2O3+3H2SO4 (稀) == Fe2(SO4)3+3H2O
Fe+H2SO4(稀) == FeSO4+H2↑[问题1]继续观察装有生锈铁钉的试管,你还能观察什么现象?由此推断,用稀酸除去铁制品表面的铁锈,是否能将铁制品长期浸泡在酸溶液中?为什么?请说出你的理由。铁钉表面有气泡。[问题2]根据实验现象说明,在实验室为什么常用稀盐酸和大理石反应来制取二氧化碳气体?稀盐酸和大理石反应速率适中,能持续产生较多气体,有利于收集。 实验2 常见碱的化学性质2mL硫酸铜溶液甲组:滴加石灰水乙组:滴加稀氢氧
化钠溶液碱溶液
+
铜盐溶液
↓
氢氧化铜沉淀实验3 酸碱中和反应注意点:
同组的同学按以下分工进行实验:
(1)左侧的同学左手拿温度计测定液体的温度变化,右手用玻璃棒搅拌液体。
(2)右侧的同学用滴管逐滴加入稀盐酸,直至液体刚好变为无色。实验3 酸碱中和反应步骤(1)步骤(2)【演示实验】观察实验现象并思考。 [问题3]酸碱中和反应实验中,无色酚酞试液的作用是什么?借助酚酞的颜色变化,来判断盐酸是否与氢氧化钠
发生反应以及是否恰好完全反应。检验稀盐酸是否正好将氢氧化钠完全反应掉,所得溶液为中性。步骤(3)实验3 酸碱中和反应整理仪器1.请同学们将所有废液(包括第一次洗涤后的液体)倒入实
验桌上指定的废液缸中。
2.固体残留物统一放在表面皿上。
3.试管洗净(清洗3次以上)倒插在试管架上,滴管洗净后
放在大烧杯里,小烧杯和井穴板洗净后倒扣在实验桌上,
温度计用水冲洗干净。
4.试剂按酸、碱、盐、指示剂、单质的顺序放好,标签向
外。整理好桌面,抹布洗净拧干,放在水龙头上晾干。 通过今天的实验,希望你能从以下五个方面有所收获:
1.熟练掌握药品的取用、固体与液体反应、液体与
液体反应、搅拌等实验操作;
2.通过比较常见酸的化学性质,认识酸的特征(H+);
3.认识常见碱的一些化学性质(OH-);
4.通过探究,认识酸碱中和反应的判断以及热效应。
5.认识到废液处理的必要性。老师寄语!
本实验因涉及酸、碱较多,便于比较、总结,将学生分成甲乙两组。讲台
乙6 甲6 乙1 甲1
乙7 甲7 乙2 甲2
乙8 甲8 乙3 甲3
乙9 甲9 乙4 甲4
乙10 甲10 乙5 甲5基础实验8 酸与碱的化学性质实验1 常见酸的化学性质注意点:
1.组内配合:靠水槽一侧的同学只负责测温度变化和洗涤温度计;另一位同学负责加入药品和记录现象。
2.温度计每使用依次要用水冲洗并用纸擦干,冷却至室温!
3.先加入固体药品,再加入酸液。注意用量要求!固体粉末只需1/4药匙,液体不能超过井穴的1/3。
4.每加一次酸液就测一次温度,只要看到有温度变化就做下一个实验,不必等到反应结束。 实验(1)金属与酸不活泼 持续大量气泡,放热反应剧烈,产生大量气泡,放热无气泡 锌粒铜片镁条实验(2)生锈的金属与酸铜锈消失,无色溶液变为蓝色生锈的铁钉生锈的铜制品铁锈消失,无色溶液变为黄色实验(3)盐与酸碳酸钙碳酸钠石灰石反应剧烈,产生大量气泡,放热 反应剧烈,产生大量气泡,放热 甲组(硫酸):有少量气泡,反应逐渐停止乙组(盐酸):持续产生大量气泡,放热 不能长期浸泡,去除铁锈后,如酸有剩余,会和铁反应。
Fe2O3+6HCl == 2FeCl3+3H2O
Fe+2HCl == FeCl2+H2↑
Fe2O3+3H2SO4 (稀) == Fe2(SO4)3+3H2O
Fe+H2SO4(稀) == FeSO4+H2↑[问题1]继续观察装有生锈铁钉的试管,你还能观察什么现象?由此推断,用稀酸除去铁制品表面的铁锈,是否能将铁制品长期浸泡在酸溶液中?为什么?请说出你的理由。铁钉表面有气泡。[问题2]根据实验现象说明,在实验室为什么常用稀盐酸和大理石反应来制取二氧化碳气体?稀盐酸和大理石反应速率适中,能持续产生较多气体,有利于收集。 实验2 常见碱的化学性质2mL硫酸铜溶液甲组:滴加石灰水乙组:滴加稀氢氧
化钠溶液碱溶液
+
铜盐溶液
↓
氢氧化铜沉淀实验3 酸碱中和反应注意点:
同组的同学按以下分工进行实验:
(1)左侧的同学左手拿温度计测定液体的温度变化,右手用玻璃棒搅拌液体。
(2)右侧的同学用滴管逐滴加入稀盐酸,直至液体刚好变为无色。实验3 酸碱中和反应步骤(1)步骤(2)【演示实验】观察实验现象并思考。 [问题3]酸碱中和反应实验中,无色酚酞试液的作用是什么?借助酚酞的颜色变化,来判断盐酸是否与氢氧化钠
发生反应以及是否恰好完全反应。检验稀盐酸是否正好将氢氧化钠完全反应掉,所得溶液为中性。步骤(3)实验3 酸碱中和反应整理仪器1.请同学们将所有废液(包括第一次洗涤后的液体)倒入实
验桌上指定的废液缸中。
2.固体残留物统一放在表面皿上。
3.试管洗净(清洗3次以上)倒插在试管架上,滴管洗净后
放在大烧杯里,小烧杯和井穴板洗净后倒扣在实验桌上,
温度计用水冲洗干净。
4.试剂按酸、碱、盐、指示剂、单质的顺序放好,标签向
外。整理好桌面,抹布洗净拧干,放在水龙头上晾干。 通过今天的实验,希望你能从以下五个方面有所收获:
1.熟练掌握药品的取用、固体与液体反应、液体与
液体反应、搅拌等实验操作;
2.通过比较常见酸的化学性质,认识酸的特征(H+);
3.认识常见碱的一些化学性质(OH-);
4.通过探究,认识酸碱中和反应的判断以及热效应。
5.认识到废液处理的必要性。老师寄语!
