第2节 常见的酸和碱--中和反应(21张PPT)
文档属性
| 名称 | 第2节 常见的酸和碱--中和反应(21张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-08-31 15:47:25 | ||
图片预览








文档简介
课件21张PPT。《中和反应》蚁酸实验探究:1、氢氧化钠是否能与盐酸反应提出问题:氢氧化钠能否与盐酸反应 猜想与假设:猜想1、氢氧化钠能与盐酸反应
猜想2、氢氧化钠不能与盐酸反应
设计实验方案:现有NaOH溶液.稀盐酸.酚酞溶液.石蕊溶液.PH试纸,利用这些药品设计实验方案。方案1、取少量氢氧化钠溶液于试管中,滴加1-2滴酚酞溶液,再滴加稀盐酸,观察现象。
方案2、取少量氢氧化钠溶液于试管中,滴加1-2滴石蕊溶液,再滴加稀盐酸,观察现象。
方案3、测定反应前、后溶液的PH,比较PH。
实验验证:问题与思考:1、滴加稀盐酸时,为什么一滴一振荡? 2、为什么滴加稀盐酸至溶液刚刚变色?>减弱中=酸<碱减小NaCl 、NaOHNaClNaCl 、HCl>减弱中=酸<碱减小NaCl 、NaOHNaClNaCl 、HCl生成物反应物是否有剩余 活动与探究:用玻璃棒蘸取上面实验中所得溶液,加热至蒸干,观察到什么现象。
实验现象:有白色固体析出·盐碱酸水练习:写出下列反应的化学方程式.
2、用含氢氧化镁的药物治疗胃酸过多症4、用熟石灰改良酸性(含硫酸)土壤
3、用氢氧化钠溶液中和精炼石油后残余的硫酸
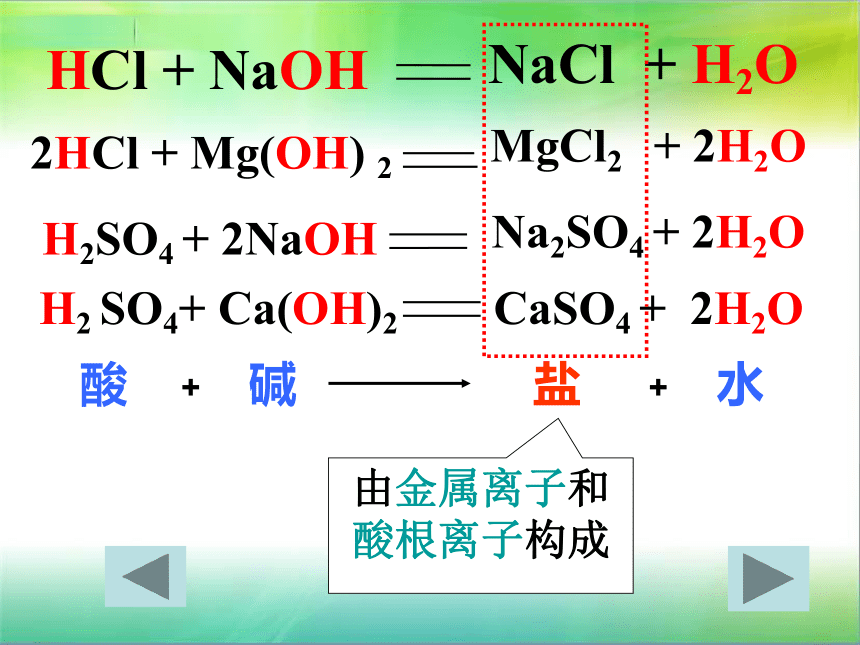
1、氢氧化钠溶液与稀盐酸反应HCl + NaOHNaCl + H2O 2HCl + Mg(OH) 2
H2SO4 + 2NaOHMgCl2 + 2H2O
Na2SO4 + 2H2O 盐酸碱水++由金属离子和
酸根离子构成H2 SO4+ Ca(OH)2 CaSO4 + 2H2O 1、凡是生成盐和水的反应都是中和反应,对吗?为什么?举例说明。
2、你认为判断一个反应是不是中和反应的关键是什么?讨论 不对,2NaOH+CO2=Na2CO3+H2O就生成了盐和水,但不是中和反应。Fe2O3+6HCl =2FeCl3 +3H2O生成了盐和水,也不是中和反应。中和反应在实际中的应用1、改变土壤的酸碱性VS酸性土壤VS碱性土壤2、处理工厂的废水VS3、用于医药4、用于生活腌制过程中产生了碱课堂小结知识点四:
1、借助酸碱指示剂判断氢氧化钠与盐酸反应。
2、氢氧化钠与盐酸反应过程中溶液酸碱性、
PH的变化情况。
3、反应后溶液中溶质的确定方法。1、下列物质中,能跟硫酸发生中和反应的是( )
A、Fe B、Ba(NO3)2 C、Na2CO3 D、NaOH
2、下列做法中,不是利用中和反应的是( )
A、用熟石灰改良酸性土壤
B、用稀盐酸来除铁锈
C、用含氢氧化铝的药物治疗胃酸过多
D、用氢氧化钠溶液洗涤石油产品中的残余硫酸
基础训练基础训练3、向氢氧化钠溶液中滴加酚酞试液,溶液颜色呈 色,PH 7,再向其中滴加稀盐酸,至溶液 时,溶液呈中性,PH 7,再滴加稀盐酸,所得溶液中的溶质有 。 1、下列关于中和反应的说法,不正确的是( )
A、一定有水生成 B、一定有气体生成
C、一定有氧化物生成 D、一定是复分解反应
2、右图是盐酸滴入氢氧化钠溶液中,有关粒子
之间反应的示意图,下列说法错误的是( )
A、盐酸溶液中含有氢离子和氯离子
B、氢氧化钠溶液中含有钠离
子和氢氧根离子
C、两种溶液混合,完全反应
后所得溶液不能导电
D、两种溶液混合时,氢离子
与氢氧根离子结合生成了水分子 能力提高1、下列反应中属于中和反应的是( )
A、Zn + 2HCl = ZnCl2 +H2↑
B、CuO + 2HCl = CuCl2+ H2O
C、Ba(OH)2+ H2SO4 = BaSO4 ↓+ 2H2O
D、AgNO3+HCl = AgCl↓ +HNO3挑战中考2、下列物质中,不宜作为治疗胃酸过多症的药物的是( )。
A.碳酸钙粉末 B.氢氧化铝粉末
C.氢氧化钠粉末 D.碳酸氢钠粉末
1.在用稀盐酸和氢氧化钠溶液进行中和反应实验
时,反应过程中溶液的酸碱度变化如图13所示。
(1)该实验将 滴
加到另一种溶液中。
(2)当加入溶液的质量为bg
时,所得溶液中的溶质为(写化
学式) 。
(3)当加入溶液的质量为ag
时,向所得溶液中滴加酚酞溶液,
溶液呈 色。
挑战中考 谢谢!
猜想2、氢氧化钠不能与盐酸反应
设计实验方案:现有NaOH溶液.稀盐酸.酚酞溶液.石蕊溶液.PH试纸,利用这些药品设计实验方案。方案1、取少量氢氧化钠溶液于试管中,滴加1-2滴酚酞溶液,再滴加稀盐酸,观察现象。
方案2、取少量氢氧化钠溶液于试管中,滴加1-2滴石蕊溶液,再滴加稀盐酸,观察现象。
方案3、测定反应前、后溶液的PH,比较PH。
实验验证:问题与思考:1、滴加稀盐酸时,为什么一滴一振荡? 2、为什么滴加稀盐酸至溶液刚刚变色?>减弱中=酸<碱减小NaCl 、NaOHNaClNaCl 、HCl>减弱中=酸<碱减小NaCl 、NaOHNaClNaCl 、HCl生成物反应物是否有剩余 活动与探究:用玻璃棒蘸取上面实验中所得溶液,加热至蒸干,观察到什么现象。
实验现象:有白色固体析出·盐碱酸水练习:写出下列反应的化学方程式.
2、用含氢氧化镁的药物治疗胃酸过多症4、用熟石灰改良酸性(含硫酸)土壤
3、用氢氧化钠溶液中和精炼石油后残余的硫酸
1、氢氧化钠溶液与稀盐酸反应HCl + NaOHNaCl + H2O 2HCl + Mg(OH) 2
H2SO4 + 2NaOHMgCl2 + 2H2O
Na2SO4 + 2H2O 盐酸碱水++由金属离子和
酸根离子构成H2 SO4+ Ca(OH)2 CaSO4 + 2H2O 1、凡是生成盐和水的反应都是中和反应,对吗?为什么?举例说明。
2、你认为判断一个反应是不是中和反应的关键是什么?讨论 不对,2NaOH+CO2=Na2CO3+H2O就生成了盐和水,但不是中和反应。Fe2O3+6HCl =2FeCl3 +3H2O生成了盐和水,也不是中和反应。中和反应在实际中的应用1、改变土壤的酸碱性VS酸性土壤VS碱性土壤2、处理工厂的废水VS3、用于医药4、用于生活腌制过程中产生了碱课堂小结知识点四:
1、借助酸碱指示剂判断氢氧化钠与盐酸反应。
2、氢氧化钠与盐酸反应过程中溶液酸碱性、
PH的变化情况。
3、反应后溶液中溶质的确定方法。1、下列物质中,能跟硫酸发生中和反应的是( )
A、Fe B、Ba(NO3)2 C、Na2CO3 D、NaOH
2、下列做法中,不是利用中和反应的是( )
A、用熟石灰改良酸性土壤
B、用稀盐酸来除铁锈
C、用含氢氧化铝的药物治疗胃酸过多
D、用氢氧化钠溶液洗涤石油产品中的残余硫酸
基础训练基础训练3、向氢氧化钠溶液中滴加酚酞试液,溶液颜色呈 色,PH 7,再向其中滴加稀盐酸,至溶液 时,溶液呈中性,PH 7,再滴加稀盐酸,所得溶液中的溶质有 。 1、下列关于中和反应的说法,不正确的是( )
A、一定有水生成 B、一定有气体生成
C、一定有氧化物生成 D、一定是复分解反应
2、右图是盐酸滴入氢氧化钠溶液中,有关粒子
之间反应的示意图,下列说法错误的是( )
A、盐酸溶液中含有氢离子和氯离子
B、氢氧化钠溶液中含有钠离
子和氢氧根离子
C、两种溶液混合,完全反应
后所得溶液不能导电
D、两种溶液混合时,氢离子
与氢氧根离子结合生成了水分子 能力提高1、下列反应中属于中和反应的是( )
A、Zn + 2HCl = ZnCl2 +H2↑
B、CuO + 2HCl = CuCl2+ H2O
C、Ba(OH)2+ H2SO4 = BaSO4 ↓+ 2H2O
D、AgNO3+HCl = AgCl↓ +HNO3挑战中考2、下列物质中,不宜作为治疗胃酸过多症的药物的是( )。
A.碳酸钙粉末 B.氢氧化铝粉末
C.氢氧化钠粉末 D.碳酸氢钠粉末
1.在用稀盐酸和氢氧化钠溶液进行中和反应实验
时,反应过程中溶液的酸碱度变化如图13所示。
(1)该实验将 滴
加到另一种溶液中。
(2)当加入溶液的质量为bg
时,所得溶液中的溶质为(写化
学式) 。
(3)当加入溶液的质量为ag
时,向所得溶液中滴加酚酞溶液,
溶液呈 色。
挑战中考 谢谢!
