人教版高中化学选修二第2单元课题2 海水的综合利用 课件35张PPT
文档属性
| 名称 | 人教版高中化学选修二第2单元课题2 海水的综合利用 课件35张PPT |  | |
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-11-17 21:21:25 | ||
图片预览










文档简介
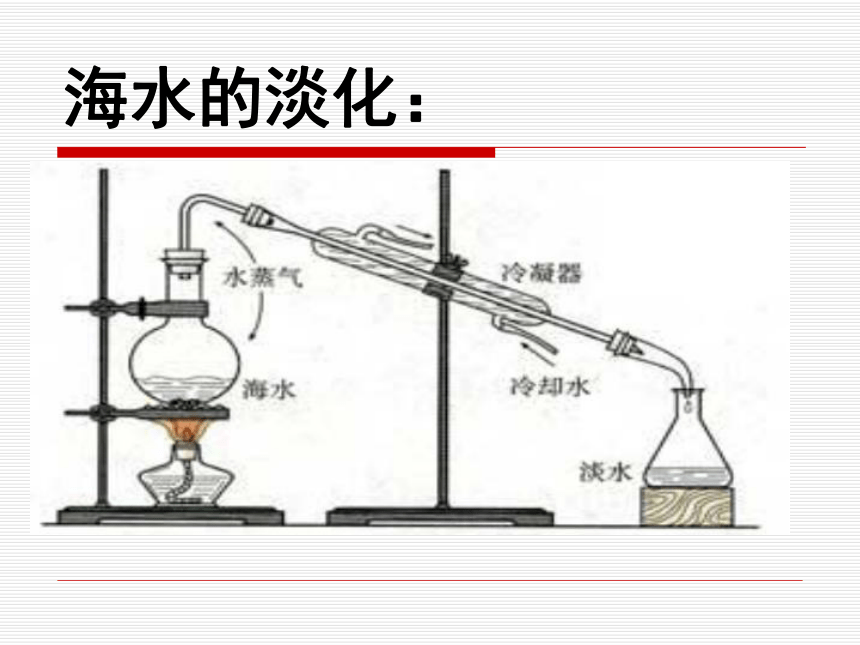
课件35张PPT。海水资源的开发利用海水资源的开发利用海水中资源的分类:海水资源水资源化学资源生物资源能源……….海水资源的分布特点:1、海水资源的广阔性2、海水资源的多样性3、海水资源的分散性 总之,海洋是一个远未完全开发的巨大化学资源宝库!!!海水的淡化:其他淡化技术:电渗析法离子交换法阳离子交换树脂:HR+Na+=NaR+H+
阴离子交换树脂:ROH+Cl-=RCl+OH-
H++OH-=H2O
与化工生产相结合,提高经济效益:8海水的综合利用海水淡化
的方法电解食盐粗盐的精制积极开展海水化学物质的提取利用 海水化学资源综合利用,是形成产业链、实现资源综合利用和社会可持续发展的体现。海水化学资源综合利用技术,是从海水中提取各种化学元素(化学品)及其深加工技术 。主要包括海水制盐、苦卤化工,提取钾、镁、溴、硝、锂、铀及其深加工等,现在已逐步 向海洋精细化工方向发展。
我国的海水化学元素提取主要是:11(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-离子,请从提供的试剂中选出a所代表的试剂,按滴加顺序依次是________________
(提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液)
其中调节pH4-5的目的是______ ↑
步骤Ⅲ除去过量的Na2CO3和NaOHNaOH BaCl2 Na2CO3
BaCl2 NaOH Na2CO3
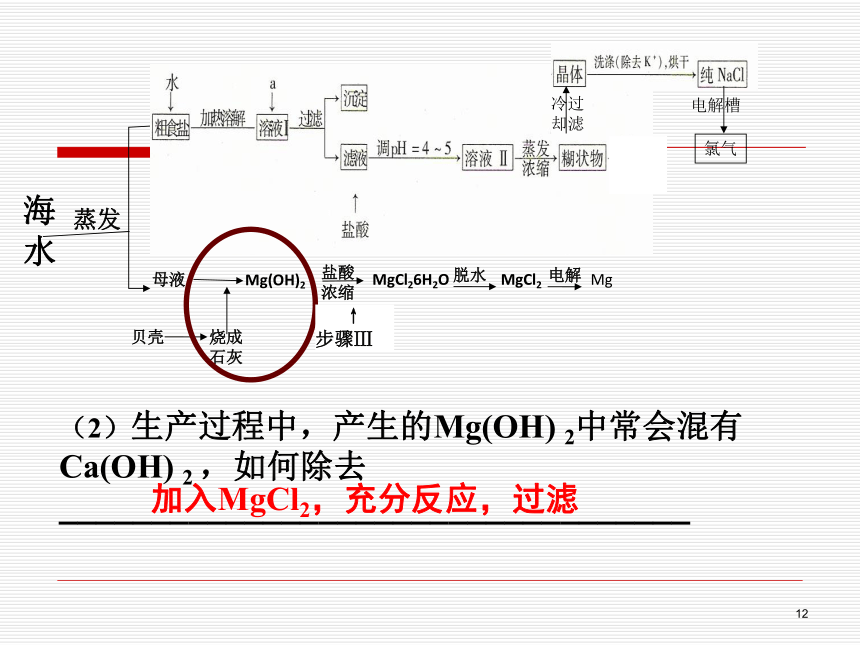
BaCl2 Na2CO3 NaOH 12(2)生产过程中,产生的Mg(OH) 2中常会混有Ca(OH) 2 ,如何除去__________________________________ ↑
步骤Ⅲ加入MgCl2,充分反应,过滤13(3)在步骤Ⅲ中需保持盐酸过量,主要原因是(结合离子方程式简要说明):
__________________________________ ↑
步骤ⅢMg2++2H2O Mg(OH)2+2H+抑制MgCl2水解14(4)实验室用惰性电极电解100mL0.1mol/LNaCl溶液,若阴极得到112 mL气体(标准状况),则所得溶液的pH为__________(忽略溶液的体积变化)。 13提镁 例5:海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下:
(1)请列举海水淡化的两种方法: 、 。蒸馏法、电渗析法、离子交换法及其他合理答案中的任意两种(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、 、 或H2、 。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br—,其目的为 。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 ,
由此反应可知,除环境保护外,在工业生产中应解决的主要问题是 。
Cl2 NaOHNaClO富集溴元素Br2+SO2+2H2O=4H++SO42-+2Br-强酸对设备的严重腐蚀(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料:Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图:请你参与分析讨论:
①图中仪器B的名称: 。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因为 。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件: 。
④C中液体产物颜色为 ,为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是 。冷凝管Br2腐蚀橡皮控制温度计b的温度,并收集59℃时的馏分分液(或蒸馏)深红棕色
我国的海水化学元素提取主要是:干海带中含碘量:0.3%--0.5%,有的高达1%,约比海水中的碘浓度提高了10万倍!海带中碘的存在形式:有机碘化物3.海洋植物,如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。
实验室里从海带中提取碘的流程如下:
(1)灼烧海带的步骤中,除需要三角架外,还需要用到的硅酸盐质的实验仪器是
__________
(在空白处填写标号字母)
A、烧杯 B、瓷坩埚 C、表面皿 D、泥三角 E、酒精灯
(2)指出提取碘的过程中有关的实验操作名称:① ,③ 。
写出过程②中有关反应的离子方程式: 。
(3)提取碘的过程中,可供选择的有机试剂是_________(填字母标号)
A. 酒精 B. CCl4 C. 乙酸 D. 苯 B D E① ,② 。
(4)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏过程。
指出下列蒸馏实验装中的错误(下图)(5)进行蒸馏操作后,最后晶体碘在 (填仪器名称)里聚集。
(6)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法: 。烧瓶实验过程25海洋植物,如海带、海藻中含有丰富的碘元素,实验室里从海带中提取碘的流程如下:请设计一种简单实验方法证明海带中存在碘元素资料:海带的成分
主要成分:蛋白质、糖类、脂肪、纤维素、有机碘化物等
次要成分:氯化钠、碳酸钠、硫酸钠、碘化钠等将海带溶于水,加淀粉变蓝26电解
制备
氧化还原氧化还原盐类水解原电池制备除杂防腐离子反应电解
27反馈练习
海水中蕴藏着丰富的资源。海水综合利用的流程图如下。(1)用NaCl做原料可以得到多种产品。
① 氯碱工业中电解饱和NaCl溶液,阳极反应的电极方程式是_______
② 电解氯化钠稀溶液可制备“84消毒液”,通电时氯气被溶液完全吸收,
若所得消毒液仅含一种溶质,写出相应的化学方程式:______________。2Cl- - 2e- = Cl2↑?28电解
制备
氧化还原原电池制备除杂防腐离子反应电解
29反馈练习
海水中蕴藏着丰富的资源。海水综合利用的流程图如下。(2)分离出粗盐后的卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。
① 粗产品的溶液中含有Na+、Fe2+、Fe3+和Mn2+,需将Fe2+、Fe3+、Mn2+转化为沉淀除去。Fe(OH)2呈絮状,常将其转化为Fe(OH)3而除去(生成氢氧化物沉淀的pH见表)。若只加一种上述(1)中得到的产品,该物质的化学式为_______________,控制溶液的pH为___________NaClO9.830反馈练习
海水中蕴藏着丰富的资源。海水综合利用的流程图如下。② 在家用电热水器不锈钢内胆表面镶嵌镁棒,利用电化学原理来防止内胆腐蚀,写出正极的电极反应式:_____________________________
O2 + 2H2O + 4e- = 4OH -32海水的综合利用海水淡化
的方法电解食盐粗盐的精制
1.用什么试剂除去Ca2+、Mg2+、Fe3+、SO42-?
2.所用试剂只有过量才能除净这些杂质,你
能设计一个合理的顺序逐一除杂吗?
粗盐中含有泥沙、 Ca2+、Mg2+、Fe3+、SO42-杂质,那么,如何净化盐水呢? 粗盐粗盐水(Ca2+、Mg2+、Fe3+、SO42-)Ba2+ + SO42- =BaSO4Ca2+、Mg2+、Fe3+、Ba2+BaSO4Ba2+、Ca2+、OH-Ca2+ + CO32- = CaCO3
Ba2+ + CO32- = BaCO3Fe(OH)3
Mg(OH)2OH-、CO32-
用盐酸调节PH值
至中性Mg2+ + 2OH- = Mg(OH)2
Fe3+ + 3OH- = Fe(OH)3CaCO3
BaCO3
阴离子交换树脂:ROH+Cl-=RCl+OH-
H++OH-=H2O
与化工生产相结合,提高经济效益:8海水的综合利用海水淡化
的方法电解食盐粗盐的精制积极开展海水化学物质的提取利用 海水化学资源综合利用,是形成产业链、实现资源综合利用和社会可持续发展的体现。海水化学资源综合利用技术,是从海水中提取各种化学元素(化学品)及其深加工技术 。主要包括海水制盐、苦卤化工,提取钾、镁、溴、硝、锂、铀及其深加工等,现在已逐步 向海洋精细化工方向发展。
我国的海水化学元素提取主要是:11(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-离子,请从提供的试剂中选出a所代表的试剂,按滴加顺序依次是________________
(提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液)
其中调节pH4-5的目的是______ ↑
步骤Ⅲ除去过量的Na2CO3和NaOHNaOH BaCl2 Na2CO3
BaCl2 NaOH Na2CO3
BaCl2 Na2CO3 NaOH 12(2)生产过程中,产生的Mg(OH) 2中常会混有Ca(OH) 2 ,如何除去__________________________________ ↑
步骤Ⅲ加入MgCl2,充分反应,过滤13(3)在步骤Ⅲ中需保持盐酸过量,主要原因是(结合离子方程式简要说明):
__________________________________ ↑
步骤ⅢMg2++2H2O Mg(OH)2+2H+抑制MgCl2水解14(4)实验室用惰性电极电解100mL0.1mol/LNaCl溶液,若阴极得到112 mL气体(标准状况),则所得溶液的pH为__________(忽略溶液的体积变化)。 13提镁 例5:海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下:
(1)请列举海水淡化的两种方法: 、 。蒸馏法、电渗析法、离子交换法及其他合理答案中的任意两种(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、 、 或H2、 。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br—,其目的为 。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 ,
由此反应可知,除环境保护外,在工业生产中应解决的主要问题是 。
Cl2 NaOHNaClO富集溴元素Br2+SO2+2H2O=4H++SO42-+2Br-强酸对设备的严重腐蚀(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料:Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图:请你参与分析讨论:
①图中仪器B的名称: 。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因为 。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件: 。
④C中液体产物颜色为 ,为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是 。冷凝管Br2腐蚀橡皮控制温度计b的温度,并收集59℃时的馏分分液(或蒸馏)深红棕色
我国的海水化学元素提取主要是:干海带中含碘量:0.3%--0.5%,有的高达1%,约比海水中的碘浓度提高了10万倍!海带中碘的存在形式:有机碘化物3.海洋植物,如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。
实验室里从海带中提取碘的流程如下:
(1)灼烧海带的步骤中,除需要三角架外,还需要用到的硅酸盐质的实验仪器是
__________
(在空白处填写标号字母)
A、烧杯 B、瓷坩埚 C、表面皿 D、泥三角 E、酒精灯
(2)指出提取碘的过程中有关的实验操作名称:① ,③ 。
写出过程②中有关反应的离子方程式: 。
(3)提取碘的过程中,可供选择的有机试剂是_________(填字母标号)
A. 酒精 B. CCl4 C. 乙酸 D. 苯 B D E① ,② 。
(4)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏过程。
指出下列蒸馏实验装中的错误(下图)(5)进行蒸馏操作后,最后晶体碘在 (填仪器名称)里聚集。
(6)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法: 。烧瓶实验过程25海洋植物,如海带、海藻中含有丰富的碘元素,实验室里从海带中提取碘的流程如下:请设计一种简单实验方法证明海带中存在碘元素资料:海带的成分
主要成分:蛋白质、糖类、脂肪、纤维素、有机碘化物等
次要成分:氯化钠、碳酸钠、硫酸钠、碘化钠等将海带溶于水,加淀粉变蓝26电解
制备
氧化还原氧化还原盐类水解原电池制备除杂防腐离子反应电解
27反馈练习
海水中蕴藏着丰富的资源。海水综合利用的流程图如下。(1)用NaCl做原料可以得到多种产品。
① 氯碱工业中电解饱和NaCl溶液,阳极反应的电极方程式是_______
② 电解氯化钠稀溶液可制备“84消毒液”,通电时氯气被溶液完全吸收,
若所得消毒液仅含一种溶质,写出相应的化学方程式:______________。2Cl- - 2e- = Cl2↑?28电解
制备
氧化还原原电池制备除杂防腐离子反应电解
29反馈练习
海水中蕴藏着丰富的资源。海水综合利用的流程图如下。(2)分离出粗盐后的卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。
① 粗产品的溶液中含有Na+、Fe2+、Fe3+和Mn2+,需将Fe2+、Fe3+、Mn2+转化为沉淀除去。Fe(OH)2呈絮状,常将其转化为Fe(OH)3而除去(生成氢氧化物沉淀的pH见表)。若只加一种上述(1)中得到的产品,该物质的化学式为_______________,控制溶液的pH为___________NaClO9.830反馈练习
海水中蕴藏着丰富的资源。海水综合利用的流程图如下。② 在家用电热水器不锈钢内胆表面镶嵌镁棒,利用电化学原理来防止内胆腐蚀,写出正极的电极反应式:_____________________________
O2 + 2H2O + 4e- = 4OH -32海水的综合利用海水淡化
的方法电解食盐粗盐的精制
1.用什么试剂除去Ca2+、Mg2+、Fe3+、SO42-?
2.所用试剂只有过量才能除净这些杂质,你
能设计一个合理的顺序逐一除杂吗?
粗盐中含有泥沙、 Ca2+、Mg2+、Fe3+、SO42-杂质,那么,如何净化盐水呢? 粗盐粗盐水(Ca2+、Mg2+、Fe3+、SO42-)Ba2+ + SO42- =BaSO4Ca2+、Mg2+、Fe3+、Ba2+BaSO4Ba2+、Ca2+、OH-Ca2+ + CO32- = CaCO3
Ba2+ + CO32- = BaCO3Fe(OH)3
Mg(OH)2OH-、CO32-
用盐酸调节PH值
至中性Mg2+ + 2OH- = Mg(OH)2
Fe3+ + 3OH- = Fe(OH)3CaCO3
BaCO3
