合成氨条件的选择[上学期]
文档属性
| 名称 | 合成氨条件的选择[上学期] |
|
|
| 格式 | rar | ||
| 文件大小 | 597.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2005-11-02 00:00:00 | ||
图片预览





文档简介
课件19张PPT。复习
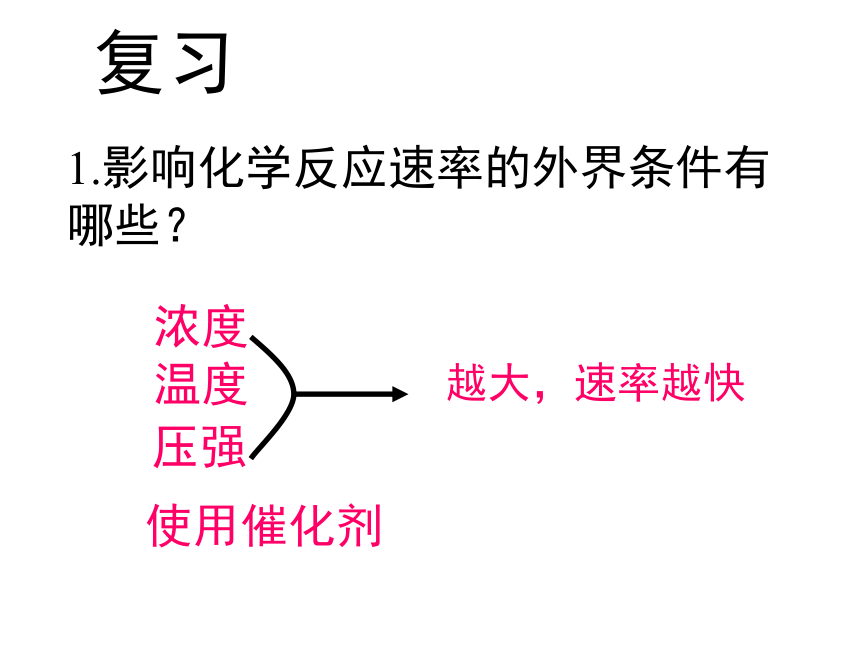
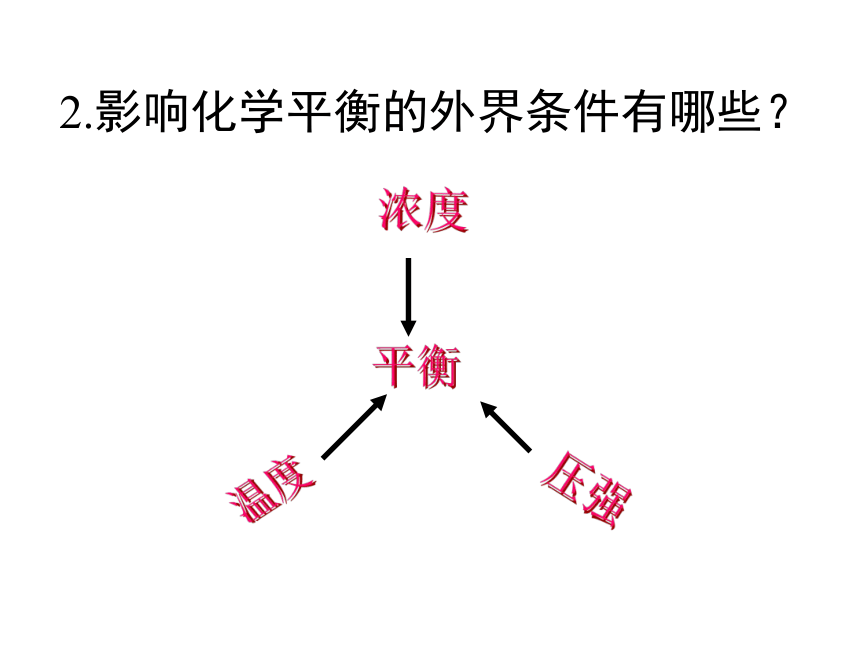
1.影响化学反应速率的外界条件有哪些?使用催化剂温度浓度压强越大,速率越快压强平衡浓度温度2.影响化学平衡的外界条件有哪些?第四节 合成氨条件的选择Ex: 请同学们写出合成氨的化学反应方程式,并说明这个反应有什么特点?N2+3H2 2NH3 ,△H﹤0特点:
a、可逆反应
b、正反应放热
c、正反应是气体体积减小的反应一、合成氨条件的选择1.合成氨的反应思考:请同学们分析工业生产主要要考虑哪些问题?首要:经济效益与社会效益基本要求:
a、反应快
b、原料利用率高
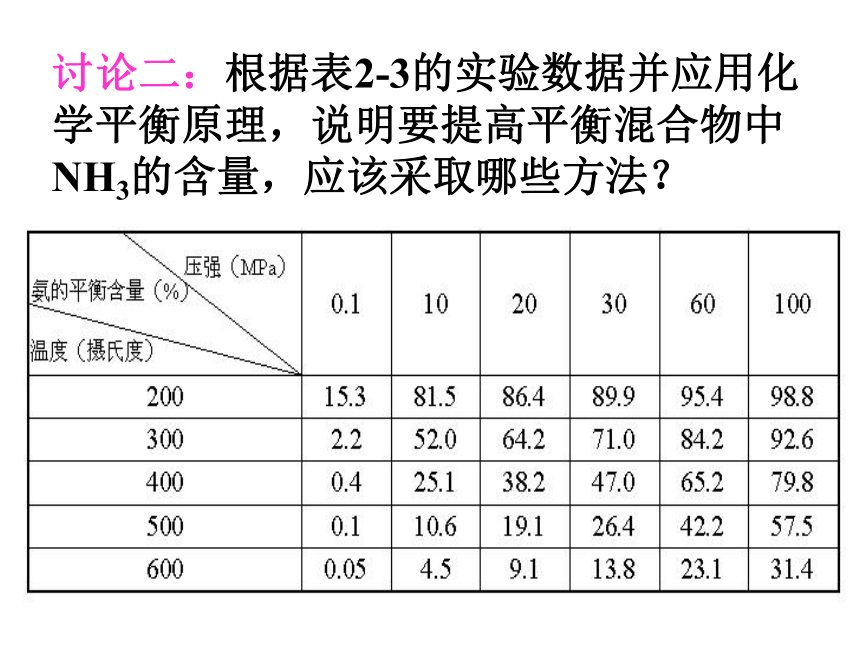
c、单位时间内产量高讨论一:试根据外界条件对化学反应速率的影响,说明要使合成氨的化学反应速率增大,应该采取哪些方法?讨论二:根据表2-3的实验数据并应用化学平衡原理,说明要提高平衡混合物中NH3的含量,应该采取哪些方法? 分析:高 温高 压使 用高 压低 温无 影响结论:
从反应速度的角度看:温度越高、压强越大,反应物浓度越大,化学反应速率越快, 使用催化剂反应加快,单位时间内生成的产品越多。
从化学平衡的角度看:高压低温,减小生成物浓度,平衡时生成物NH3的百分含量越高。增大N2、H2浓度 增大N2、H2浓度 ;减小NH3浓度2.工业合成氨条件的实际选择(1) 压强:20MPa~50MPa(2) 温度:500℃左右(3) 催化剂:铁触媒(以铁为主的多成分催化剂,含少量K、Mg 、Al和Ca思考:1.为什么在实际生产中选择上述条件?3. 在上述条件下合成氨的产率为多少?2. 为了提高原料的利用率,生成物NH3的产率,实际还采用什么方法?4. 合成氨是在什么设备中进行的?工业合成氨 ①制备:
液化,蒸发 N2
N2:空气
O2+C CO2 N2
H2:水,燃料(煤,石油,天数气) C+H2O(g)=CO+H2 ;CO+H2O(g)=CO2+H2
二、合成氨工业1.合成氨工业简述原料气的制备,净化和压缩② 净化:清除杂质,防止催化剂“中毒”③ 压缩氨的合成氨的分离氢氮混和气水冷器循环压缩机合成氨简要流程示意图液氨合成塔氨分离器
研究性学习课题
设想合成氨的发展前景
2.合成氨工业的发展前景参考:
①研制新的能承受高压的材料;②研制合成新的催化剂; ③化学模拟生物固氮等练习:2SO2+O2 催化剂 2SO3(正反应为放热反应)反应温度为4500C,使用V2O5为催化剂,在此条件下,如果压强为0.1MPa,SO2的转化率为97.5%,压强为10MPa时SO2 的转化率为99.3%请回答: 在接触法制H2SO4的工业生产中时,有以下反应:(1) 工业生产中选择4500C 左右温度,为什么?(2)增大压强对合成SO3是否有利?在实际生产中应如何选择?为什么?(3)生产中要用过量的空气,为什么?
1.影响化学反应速率的外界条件有哪些?使用催化剂温度浓度压强越大,速率越快压强平衡浓度温度2.影响化学平衡的外界条件有哪些?第四节 合成氨条件的选择Ex: 请同学们写出合成氨的化学反应方程式,并说明这个反应有什么特点?N2+3H2 2NH3 ,△H﹤0特点:
a、可逆反应
b、正反应放热
c、正反应是气体体积减小的反应一、合成氨条件的选择1.合成氨的反应思考:请同学们分析工业生产主要要考虑哪些问题?首要:经济效益与社会效益基本要求:
a、反应快
b、原料利用率高
c、单位时间内产量高讨论一:试根据外界条件对化学反应速率的影响,说明要使合成氨的化学反应速率增大,应该采取哪些方法?讨论二:根据表2-3的实验数据并应用化学平衡原理,说明要提高平衡混合物中NH3的含量,应该采取哪些方法? 分析:高 温高 压使 用高 压低 温无 影响结论:
从反应速度的角度看:温度越高、压强越大,反应物浓度越大,化学反应速率越快, 使用催化剂反应加快,单位时间内生成的产品越多。
从化学平衡的角度看:高压低温,减小生成物浓度,平衡时生成物NH3的百分含量越高。增大N2、H2浓度 增大N2、H2浓度 ;减小NH3浓度2.工业合成氨条件的实际选择(1) 压强:20MPa~50MPa(2) 温度:500℃左右(3) 催化剂:铁触媒(以铁为主的多成分催化剂,含少量K、Mg 、Al和Ca思考:1.为什么在实际生产中选择上述条件?3. 在上述条件下合成氨的产率为多少?2. 为了提高原料的利用率,生成物NH3的产率,实际还采用什么方法?4. 合成氨是在什么设备中进行的?工业合成氨 ①制备:
液化,蒸发 N2
N2:空气
O2+C CO2 N2
H2:水,燃料(煤,石油,天数气) C+H2O(g)=CO+H2 ;CO+H2O(g)=CO2+H2
二、合成氨工业1.合成氨工业简述原料气的制备,净化和压缩② 净化:清除杂质,防止催化剂“中毒”③ 压缩氨的合成氨的分离氢氮混和气水冷器循环压缩机合成氨简要流程示意图液氨合成塔氨分离器
研究性学习课题
设想合成氨的发展前景
2.合成氨工业的发展前景参考:
①研制新的能承受高压的材料;②研制合成新的催化剂; ③化学模拟生物固氮等练习:2SO2+O2 催化剂 2SO3(正反应为放热反应)反应温度为4500C,使用V2O5为催化剂,在此条件下,如果压强为0.1MPa,SO2的转化率为97.5%,压强为10MPa时SO2 的转化率为99.3%请回答: 在接触法制H2SO4的工业生产中时,有以下反应:(1) 工业生产中选择4500C 左右温度,为什么?(2)增大压强对合成SO3是否有利?在实际生产中应如何选择?为什么?(3)生产中要用过量的空气,为什么?
