第七章第三节第一教时中和反应[下学期]
图片预览









文档简介
课件31张PPT。§7-3 酸和碱的反应一、中和反应常熟市
实验中学制作:朱丙龙下表为家庭中一些常见物质的pH:1、提出问题:酸和碱之间会发生
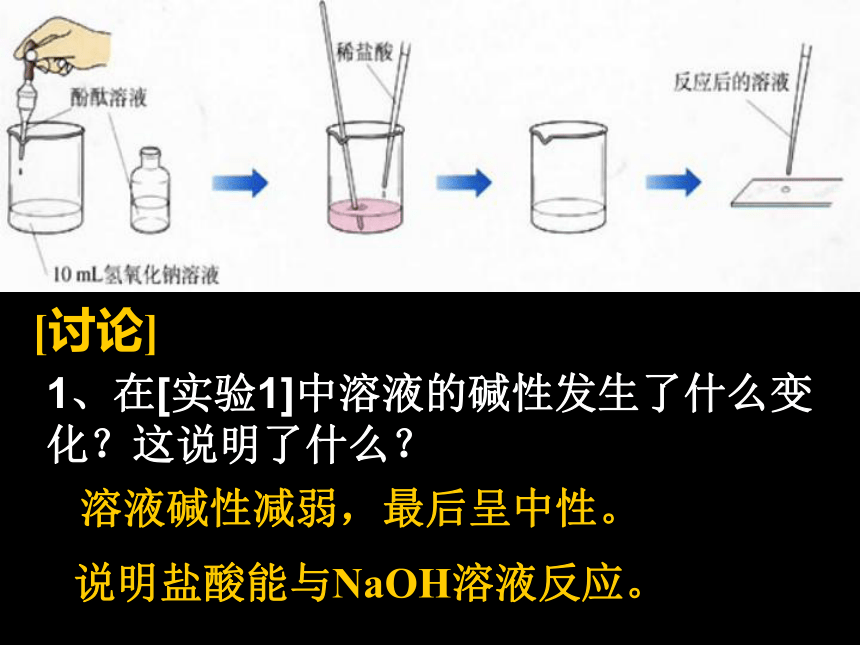
什么反应2、猜想与假设:酸和碱之间能发生反应,并有水生成3、设计实验方案4、进行实验探究5、分析结果,得出结论[实验1] 在烧杯中加入适量氢氧化钠溶液,滴入2~3滴无色酚酞溶液,插入一支温度计,测量溶液的温度。
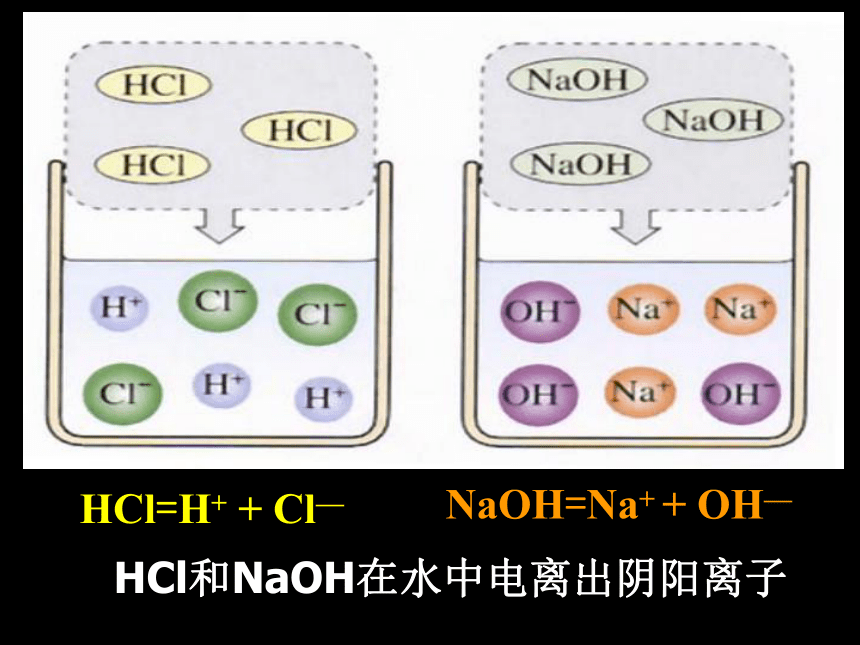
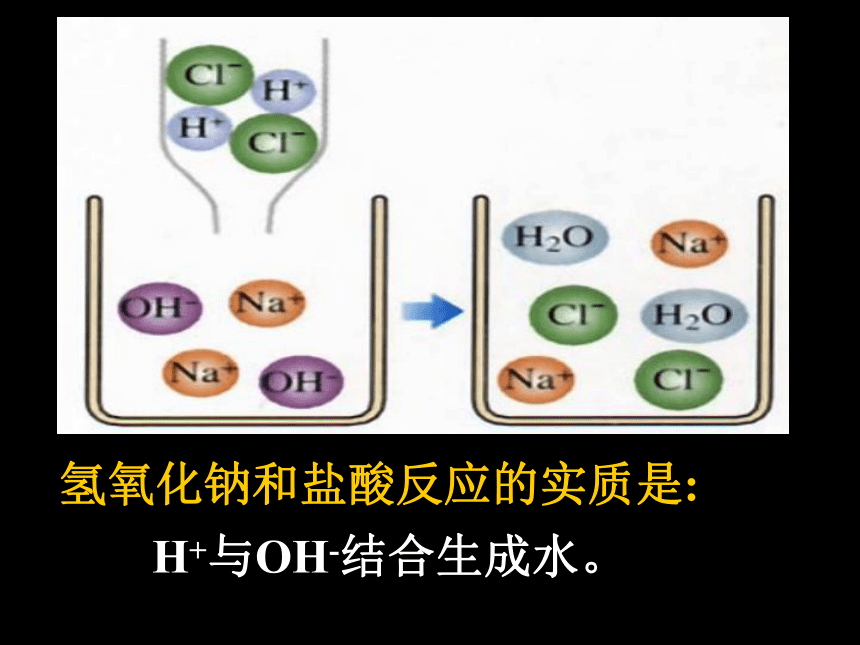
再用胶头滴管吸取盐酸逐滴加入盛有氢氧化钠溶液的烧杯中。边滴边搅拌,当烧杯中溶液刚好变成无色时,停止加入盐酸。同时观察温度的变化情况。 活动探究一溶液碱性减弱,最后呈中性。说明盐酸能与NaOH溶液反应。3、在[实验1]中,当滴入的盐酸较少时,溶液为什么颜色?这又说明了什么?溶液显什么(酸、碱、中)性?2、在[实验1]中溶液的温度有什么变化?这说明了什么?溶液温度升高,说明NaOH和盐酸反应时放出热量。溶液仍为红色,说明溶液中NaOH溶液有剩余,溶液呈碱性。4、在[实验1]中,当滴入的盐酸恰好使烧杯中溶液变成无色时,这又说明了什么?溶液显什么(酸、碱、中)性?5、在[实验1]中,当滴入的盐酸恰好使烧杯中溶液变成无色时继续滴加一些盐酸,溶液为什么颜色?溶液显什么(酸、碱、中)性?说明盐酸与NaOH溶液恰好完全反应。溶液呈中性。溶液显无色,溶液呈酸性(盐酸有剩余)[实验2] 取[实验1]所得的少量溶液于一支试管中,另用一支胶头滴管,向试管中加入一滴氢氧化钠溶液,溶液的颜色又发生什么变化?这说明了什么?溶液显什么(酸、碱、中)性?活动探究二说明NaOH溶液多余,溶液又呈碱性。溶液颜色又变红色,[实验3] 取[实验1]所得的少量溶液于蒸发皿中,加热至蒸干,观察到什么现象?这说明了什么?活动探究三蒸发皿中出现白色固体HCl=H+ + Cl—NaOH=Na+ + OH— HCl和NaOH在水中电离出阴阳离子氢氧化钠和盐酸反应的实质是:H+与OH-结合生成水。酸碱盐水中和反应:反应的化学方程式NaOH + HCl =NaCl + H2O酸和碱作用使各自的特性都消失,生成盐和水的反应叫做中和反应。酸+碱→盐+水(放热)中和反应属于复分解反应[练习]
NaOH + H2SO4=Ca(OH)2+ HCl =2 Na2SO4 + 2H2O2 CaCl2 + 2H2O[提问]以上反应有什么共同特征?[回答] ①反应物都是酸和碱
②生成物都是盐和水都属于中和反应下列哪些是属于中和反应?为什么 ?①Fe2O3 + 6HCl =2FeCl3 + 3H2O②CO2 + 2NaOH = Na2CO3 + H2O③H2SO4 + Ba(OH)2 = BaSO4 ↓ +2H2O不是不是是二、中和反应的应用[交流与讨论]
1、参照氢氧化钠与盐酸反应的化学方程式,写出氢氧化钙与稀硫酸反应的化学方程式。Ca(OH)2+H2SO4 =CaSO4 + 2H2O2、有些化工厂排放的废水中含有硫酸,如果用氨水(NH3·H2O)中和它,能得到一种氮肥——硫酸铵[(NH4)2SO4]。写出该反应的化学方程式。3、施用熟石灰可以改良酸性土壤;被蚂蚁、蚊子咬了,昆虫分泌的酸性物质进入肌肉,使肌肉酸痛,涂上稀氨水或肥皂水可以止痛、消肿。你知道其中的道理吗?H2SO4+2NH3·H2O =(NH4)2SO4 + 2H2O碱性物质能中和酸性物质。 4、胃酸(含盐酸)过多的病人服用一种药物叫胃舒平[主要成分是Al(OH)3]。它起什么作用?写出有关反应的化学方程式。 5、做馒头时,面团经过发酵后生成一些酸,此时可加一些纯碱溶液,用力揉和,然后做成馒头,加热蒸熟,蒸熟的馒头能变得疏松多孔,为什么?这种药物能中和过多的胃酸。
Al(OH)3+3HCl=AlCl 3 +3H2O 发酵产生的酸和加入的纯碱(Na2CO3)反应,生成CO2气体,是馒头内生成许多小洞,因此馒头疏松多孔。小结:中和反应的应用1、改良酸性土壤。2、处理工厂废水中的酸。
3、用于医药——中和胃酸及昆虫分泌的酸性物质等。 一、某同学想探究酸碱中和反应是否放热反应。进行下列实验操作:取溶质质量分数为20%的稀硫酸30mL,用温度计测出其温度为13℃。然后向其中加入5.6gNaOH固体,恰好完全反应。再用温度计测出温度为22℃。由此,该同学得出NaOH与稀硫酸发生的中和反应是放热反应的结论。请回答下列问题:
(1)该同学所得的结论的依据是否科
学? (选填“科学”或“不科学”)理由是: 不科学 因为固体氢氧化钠溶于水
也要放热。(2)根据本实验的目的,请你改进他的实验操作。 把固体氢氧化钠改成氢氧化钠溶液和稀硫酸反应来测定中和反应放热与否。二、在一定体积的10%的氢氧化钠溶液中滴加10%的盐酸,反应中溶液的温度与加入盐酸的体积变化如下:(1)试绘出溶液的温度与加入盐酸的体积之间的变化关系曲线。(2)根据曲线讨论溶液温度变化的原因。
① 加入盐酸的量在2~10mL之间时:
;
② 加入盐酸的量在10mL时:
。
③加入盐酸的量在10~20mL之间时:
。 随盐酸量增加,中和反应放出热量增大,
溶液温度上升; 过量盐酸起冷却降温作用,反应停止热量散失。加入10mL盐酸时,盐酸和NaOH 溶液恰好完全中和,放出热量最多。三、一张洁白干燥的滤纸上,依次喷洒A、B、C三种无色液体。当喷洒A时,滤纸无明显变化;再喷洒B时,滤纸上出现一只红猫;最后喷洒C时,小猫渐渐消失。
回答下列问题:
无色液体:A是____,B是____,C是____ ;
或A是____,B是____,C是____ 。
(从 氢氧化钾溶液、稀硫酸、酚酞溶液中选择填写) KOH酚酞稀硫酸稀硫酸酚酞KOH四、2005年苏州市初中化学实验操作考核中大多数学校选择了“酸碱中和反应实验”,现将某学生的实验操作考核过程回放:测温度加酚酞加HCl测温度加HCl加NaOH该学生在实验操作中存在的明显错误以及可能造成的后果是(同类型错误不再复述)① __________________________:_____________________________
② __________________________:_____________________________
③ __________________________:_____________________________
④ __________________________:_____________________________瓶塞不能倒放腐蚀桌面和沾污试剂沾污滴管或造成试剂的污染滴管不能伸入锥形瓶玻璃棒不能在焰心或内焰上加热玻璃棒断裂灯帽不能横放灯帽易滑落到地下(2)实验中为使稀盐酸能与NaOH溶液充分接触,该选择________(填“振荡”或“搅拌”)
(3)该学生在进行G步操作时滴入1滴(或2滴) 溶液时应该看到的现象是 。若无此现象,则可能性最大的原因
是: 振荡NaOH溶液由无色变为红色E步时加盐酸酸过量(4)你用图表的形式表示该同学在G步操作中加入某溶液至出现应见的现象过程中溶液pH值的变化,并完成溶液温度的变化曲线.HCl过量NaOH过量NaOH和HCl反应放热(5)实验结束后,同学们分别交流实验测得的△t值,发现他们所得的数据差异较大.老师说可能是学生在测定温度时方法不正确或温度计读数有误差造成。但有两位同学说“我们在测定溶液温度的方法正确和对温度读数时都很仔细,怎么也会有差异呢?”,请你帮助他们找找还可能引起△t数据差异的原因:取用NaOH溶液的体积多于或少于该实验规定的体积作业:1、完成书P197~198: 1、2、4、
5、82、预习:二、盐下课制作:朱丙龙常熟市
实验中学
实验中学制作:朱丙龙下表为家庭中一些常见物质的pH:1、提出问题:酸和碱之间会发生
什么反应2、猜想与假设:酸和碱之间能发生反应,并有水生成3、设计实验方案4、进行实验探究5、分析结果,得出结论[实验1] 在烧杯中加入适量氢氧化钠溶液,滴入2~3滴无色酚酞溶液,插入一支温度计,测量溶液的温度。
再用胶头滴管吸取盐酸逐滴加入盛有氢氧化钠溶液的烧杯中。边滴边搅拌,当烧杯中溶液刚好变成无色时,停止加入盐酸。同时观察温度的变化情况。 活动探究一溶液碱性减弱,最后呈中性。说明盐酸能与NaOH溶液反应。3、在[实验1]中,当滴入的盐酸较少时,溶液为什么颜色?这又说明了什么?溶液显什么(酸、碱、中)性?2、在[实验1]中溶液的温度有什么变化?这说明了什么?溶液温度升高,说明NaOH和盐酸反应时放出热量。溶液仍为红色,说明溶液中NaOH溶液有剩余,溶液呈碱性。4、在[实验1]中,当滴入的盐酸恰好使烧杯中溶液变成无色时,这又说明了什么?溶液显什么(酸、碱、中)性?5、在[实验1]中,当滴入的盐酸恰好使烧杯中溶液变成无色时继续滴加一些盐酸,溶液为什么颜色?溶液显什么(酸、碱、中)性?说明盐酸与NaOH溶液恰好完全反应。溶液呈中性。溶液显无色,溶液呈酸性(盐酸有剩余)[实验2] 取[实验1]所得的少量溶液于一支试管中,另用一支胶头滴管,向试管中加入一滴氢氧化钠溶液,溶液的颜色又发生什么变化?这说明了什么?溶液显什么(酸、碱、中)性?活动探究二说明NaOH溶液多余,溶液又呈碱性。溶液颜色又变红色,[实验3] 取[实验1]所得的少量溶液于蒸发皿中,加热至蒸干,观察到什么现象?这说明了什么?活动探究三蒸发皿中出现白色固体HCl=H+ + Cl—NaOH=Na+ + OH— HCl和NaOH在水中电离出阴阳离子氢氧化钠和盐酸反应的实质是:H+与OH-结合生成水。酸碱盐水中和反应:反应的化学方程式NaOH + HCl =NaCl + H2O酸和碱作用使各自的特性都消失,生成盐和水的反应叫做中和反应。酸+碱→盐+水(放热)中和反应属于复分解反应[练习]
NaOH + H2SO4=Ca(OH)2+ HCl =2 Na2SO4 + 2H2O2 CaCl2 + 2H2O[提问]以上反应有什么共同特征?[回答] ①反应物都是酸和碱
②生成物都是盐和水都属于中和反应下列哪些是属于中和反应?为什么 ?①Fe2O3 + 6HCl =2FeCl3 + 3H2O②CO2 + 2NaOH = Na2CO3 + H2O③H2SO4 + Ba(OH)2 = BaSO4 ↓ +2H2O不是不是是二、中和反应的应用[交流与讨论]
1、参照氢氧化钠与盐酸反应的化学方程式,写出氢氧化钙与稀硫酸反应的化学方程式。Ca(OH)2+H2SO4 =CaSO4 + 2H2O2、有些化工厂排放的废水中含有硫酸,如果用氨水(NH3·H2O)中和它,能得到一种氮肥——硫酸铵[(NH4)2SO4]。写出该反应的化学方程式。3、施用熟石灰可以改良酸性土壤;被蚂蚁、蚊子咬了,昆虫分泌的酸性物质进入肌肉,使肌肉酸痛,涂上稀氨水或肥皂水可以止痛、消肿。你知道其中的道理吗?H2SO4+2NH3·H2O =(NH4)2SO4 + 2H2O碱性物质能中和酸性物质。 4、胃酸(含盐酸)过多的病人服用一种药物叫胃舒平[主要成分是Al(OH)3]。它起什么作用?写出有关反应的化学方程式。 5、做馒头时,面团经过发酵后生成一些酸,此时可加一些纯碱溶液,用力揉和,然后做成馒头,加热蒸熟,蒸熟的馒头能变得疏松多孔,为什么?这种药物能中和过多的胃酸。
Al(OH)3+3HCl=AlCl 3 +3H2O 发酵产生的酸和加入的纯碱(Na2CO3)反应,生成CO2气体,是馒头内生成许多小洞,因此馒头疏松多孔。小结:中和反应的应用1、改良酸性土壤。2、处理工厂废水中的酸。
3、用于医药——中和胃酸及昆虫分泌的酸性物质等。 一、某同学想探究酸碱中和反应是否放热反应。进行下列实验操作:取溶质质量分数为20%的稀硫酸30mL,用温度计测出其温度为13℃。然后向其中加入5.6gNaOH固体,恰好完全反应。再用温度计测出温度为22℃。由此,该同学得出NaOH与稀硫酸发生的中和反应是放热反应的结论。请回答下列问题:
(1)该同学所得的结论的依据是否科
学? (选填“科学”或“不科学”)理由是: 不科学 因为固体氢氧化钠溶于水
也要放热。(2)根据本实验的目的,请你改进他的实验操作。 把固体氢氧化钠改成氢氧化钠溶液和稀硫酸反应来测定中和反应放热与否。二、在一定体积的10%的氢氧化钠溶液中滴加10%的盐酸,反应中溶液的温度与加入盐酸的体积变化如下:(1)试绘出溶液的温度与加入盐酸的体积之间的变化关系曲线。(2)根据曲线讨论溶液温度变化的原因。
① 加入盐酸的量在2~10mL之间时:
;
② 加入盐酸的量在10mL时:
。
③加入盐酸的量在10~20mL之间时:
。 随盐酸量增加,中和反应放出热量增大,
溶液温度上升; 过量盐酸起冷却降温作用,反应停止热量散失。加入10mL盐酸时,盐酸和NaOH 溶液恰好完全中和,放出热量最多。三、一张洁白干燥的滤纸上,依次喷洒A、B、C三种无色液体。当喷洒A时,滤纸无明显变化;再喷洒B时,滤纸上出现一只红猫;最后喷洒C时,小猫渐渐消失。
回答下列问题:
无色液体:A是____,B是____,C是____ ;
或A是____,B是____,C是____ 。
(从 氢氧化钾溶液、稀硫酸、酚酞溶液中选择填写) KOH酚酞稀硫酸稀硫酸酚酞KOH四、2005年苏州市初中化学实验操作考核中大多数学校选择了“酸碱中和反应实验”,现将某学生的实验操作考核过程回放:测温度加酚酞加HCl测温度加HCl加NaOH该学生在实验操作中存在的明显错误以及可能造成的后果是(同类型错误不再复述)① __________________________:_____________________________
② __________________________:_____________________________
③ __________________________:_____________________________
④ __________________________:_____________________________瓶塞不能倒放腐蚀桌面和沾污试剂沾污滴管或造成试剂的污染滴管不能伸入锥形瓶玻璃棒不能在焰心或内焰上加热玻璃棒断裂灯帽不能横放灯帽易滑落到地下(2)实验中为使稀盐酸能与NaOH溶液充分接触,该选择________(填“振荡”或“搅拌”)
(3)该学生在进行G步操作时滴入1滴(或2滴) 溶液时应该看到的现象是 。若无此现象,则可能性最大的原因
是: 振荡NaOH溶液由无色变为红色E步时加盐酸酸过量(4)你用图表的形式表示该同学在G步操作中加入某溶液至出现应见的现象过程中溶液pH值的变化,并完成溶液温度的变化曲线.HCl过量NaOH过量NaOH和HCl反应放热(5)实验结束后,同学们分别交流实验测得的△t值,发现他们所得的数据差异较大.老师说可能是学生在测定温度时方法不正确或温度计读数有误差造成。但有两位同学说“我们在测定溶液温度的方法正确和对温度读数时都很仔细,怎么也会有差异呢?”,请你帮助他们找找还可能引起△t数据差异的原因:取用NaOH溶液的体积多于或少于该实验规定的体积作业:1、完成书P197~198: 1、2、4、
5、82、预习:二、盐下课制作:朱丙龙常熟市
实验中学
