应用广泛的酸碱盐复习课件[下学期]
图片预览









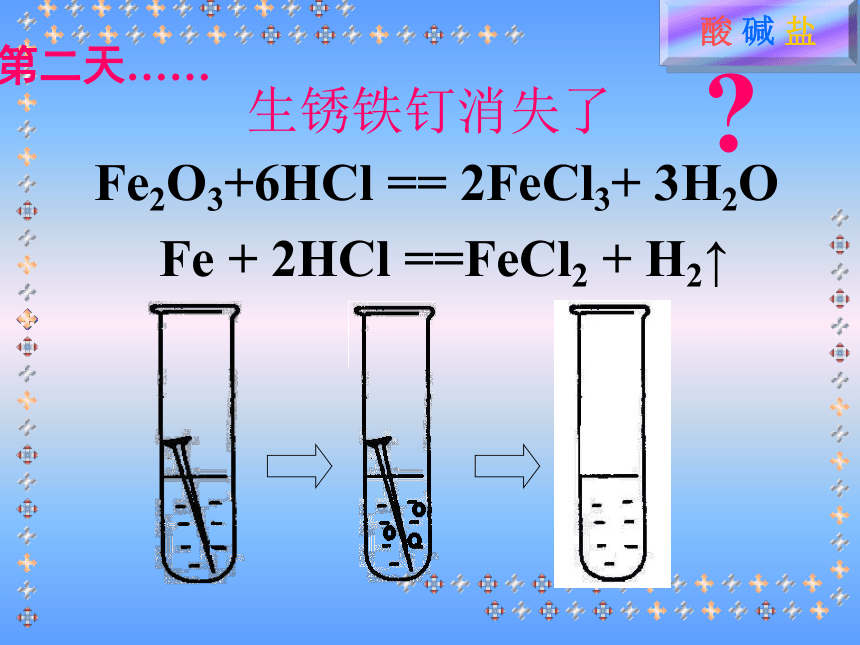
文档简介
课件51张PPT。酸碱盐复习???学习目标:
1、了解稀盐酸和稀硫酸、氢氧化钠、氢氧化钙和氨水、氯化钠和碳酸钠的物理性质,重点归纳化学性质
2、从离子的角度认识酸和碱具有某些
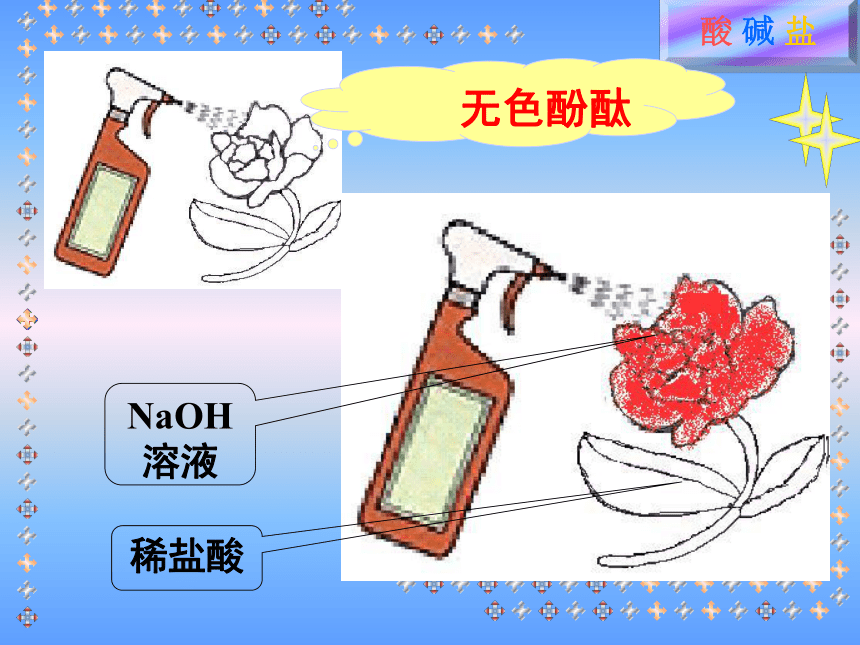
相似化学性质的原因稀盐酸NaOH溶液紫色石蕊稀盐酸NaOH溶液无色酚酞小结酸性溶液能够使紫色石蕊试液变红,
使无色酚酞试液不变色。碱性溶液能够使紫色石蕊试液变蓝,
使无色酚酞试液变红。酸性溶液使蓝色石蕊试纸变红,
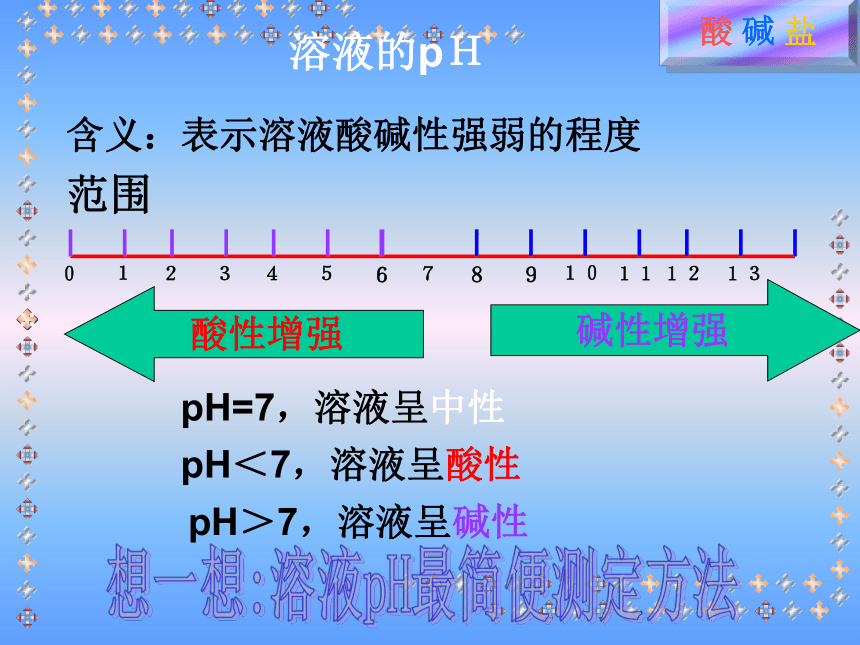
碱性溶液使红色石蕊试纸变蓝。溶液的pH含义:表示溶液酸碱性强弱的程度范围酸性增强碱性增强pH=7,溶液呈中性pH<7,溶液呈酸性pH>7,溶液呈碱性想一想:溶液pH最简便测定方法一、盐酸、硫酸的物理性质?想一想盐酸物理性质氯化氢气体的水溶液1,无色有剌激性气味的液体2,易挥发,在空气中形成白雾3,有酸味,腐蚀性4,工业品:黄色(含Fe3+)硫酸的物理性质1.无色、粘稠、油状液体2.难挥发3.吸水性、脱水性、腐蚀性、强氧化性小明看见爸爸常常用稀盐酸给铁制器皿除锈,他自己想亲自试一试。于是,他找出一颗生锈铁钉出来,放入足量稀盐酸中,然后,美滋滋地去睡觉了……生活知多D生锈铁钉消失了Fe2O3+6HCl == 2FeCl3+ 3H2O
Fe + 2HCl ==FeCl2 + H2↑第二天……?成份:氢氧化铝、碘甲基蛋氨酸等3HCl + Al(OH)3 == AlCl3 + 3H2O生活知多DCaCl2+ H2O+ CO2你知道实验室制取二氧化碳
的药品原理是什么吗?2HCl+ CaCO3==↑二、酸的化学性质:1、酸 + 指示剂2、酸 + 金属氧化物 → 盐 + 水3、酸 + 活泼金属 → 盐 + 氢气4、酸 + 碱 → 盐 + 水5、酸 + 盐 → 新盐 + 新酸食用松花皮蛋时常感到有涩味,是因为制作过程中用到了熟石灰和纯碱等原料。为了减轻涩味,可在食用时添加调味品,这种调味品最好( )。
A、食盐 B、酱油
C、香油 D、食醋D生活知多D在盛有下列固体的试管内,加入足量的稀硫酸,只能得到无色溶液的是( )。
A、ZnO B、Fe
C、Cu(OH)2 D、Fe2O3练习A鱼胆弄破后会使鱼肉粘上难溶解于水的胆汁酸(一种酸)而变苦,要减少这种苦味,用来洗涤的最佳物质是( )。
A、水 B、食盐
C、纯碱 D、食醋C生活知多D苯甲酸(C6H5COOH)可用作食品防腐剂,其酸性比醋酸强,下列对苯甲酸性质的推测,不合理的是( )
A、苯甲酸能使石蕊试液变红色
B、苯甲酸不能使酚酞变色
C、苯甲酸溶液的pH>7
D、苯甲酸溶液的pH<7练习C酸→H++酸根离子 “物质的组成与结构决定物质的性质”是化学学科中的重要观点。按照这一观点讨论:
酸溶液具有一些共同的化学性质,是因为酸溶液中都含有 ;碱溶液也具有一些共同的化学性质,是因为碱溶液中都含有 。练习碱→金属离子+OH-H+OH-三、氢氧化钠、氢氧化钙的物理性质想一想?氢氧化钠物理性质1.白色片状固体2.极易溶于水且放大量热3.易吸收水分而潮解4.强腐蚀性,故称火碱、烧碱、苛性钠5.水溶液有涩味和滑腻感氢氧化钙物理性质1.白色粉未状固体2. 微溶于水且放热,水溶液叫熟石灰 3.有一定腐蚀性,俗称熟石灰,消石灰四、氢氧化钠、氢氧化钙溶液的化学性质:1、碱 + 指示剂2、碱 + 非金属氧化物 → 盐 + 水Ca(OH)2 + CO2 === CaCO3↓ + H2O1、碱 + 指示剂2、碱 + 非金属氧化物 → 盐 + 水3、碱 + 酸→ 盐 + 水4、碱 + 盐 → 新盐 + 新碱四、氢氧化钠、氢氧化钙溶液的化学性质敞口的氢氧化钠固体质量会变化吗?
答案:会增大。吸水且与CO2反应
2NaOH + CO2 === Na2CO3 + H2O
80 44 106 18动动脑 食品公司通常在“**雪饼”的包装袋内放入一小包干燥剂,上面的部分文字如下: 干燥剂 DESICCANT
请勿食用 DO NOT EAT
请注意:
(1)本干燥剂主要成分为生石灰
(2)请勿食用
(3)万一误入眼睛,请先用水清洗后,
求诊于医师、
(4)请慎防取玩生活知多D请仔细阅读,回答下列问题:
(1)这包干燥剂吸收水分的反应方程式是 。
(2)“请勿食用”是因为干燥剂吸水后具 。
(3)如果误食入口应该 。CaO+H2O==Ca(OH)2腐蚀性服用食醋并大量饮水生活知多D某溶液的pH是5,若将溶液的pH上升到8,应采用的措施是加入适量( )。
A、紫色石蕊试液 B、酸溶液
C、碱溶液 D、蒸馏水练习C五、几种常见的盐物理性质与用途比较五、几种常见的盐物理性质与用途的比较1、盐与指示剂
六、盐溶液的化学性质:2、盐 + 金属?金属活动顺序表:K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au 要求: 记清楚、会默写、会用应用:①判断金属能否于酸发生置换反应②判断金属能否与盐溶液发生置换反应③通过化学反应比较金属活动性的强弱④通过金属活动性比较反应的快慢2、盐 + 活泼金属===新盐 + 新金属1、前换后
2、盐可溶
3、钾、钙、钠除外要求:1、盐与指示剂
2、盐 + 活泼金属===新盐 + 新金属
3、盐与酸、碱
4、盐与盐反应六、盐溶液的化学性质:取NaOH溶液适量于小烧杯中,滴入几滴酚酞试液,然后再向该溶液中逐滴滴入稀HCl。溶液先由无色变红,再由红变无色。氢氧化钠溶液能与稀盐酸反应。动动脑日常生活中接触到的酸、碱、盐 (1)日常生活中常见的酸
胃液里常含有盐酸,食醋里含有醋酸,汽水里含有碳酸、柠檬酸,发酵后的牛 乳里含有乳酸,山楂、柑橘、柠檬等水果里含有不同的有机酸. (2)日常生活中常见的碱
作为建筑材料的熟石灰,作为化肥或医药的氨水,作为中和胃酸药物的氢氧化铝等.我们还会接触到一些生物碱(有机碱类),如烟碱(尼古丁)、金鸡钠碱(奎宁)等。 . (3)日常生活中常见的盐
用作调味剂和防腐剂的食盐,用作净水剂的明矾,用作消毒剂的高锰酸钾,用来制作模型的石膏,用作建筑材料的石灰石和大理石. ⑴人的胃液是呈 ,因为含有 ,可帮助消化。若含量过多的病人可服用一种药物叫胃舒平[主要成分是Al(OH)3]。它起什么作用?写出有关反应的化学方程式。 ⑵做馒头时,面团经过发酵后生成一些酸,此时可加一些纯碱溶液,用力揉和,然后做成馒头,加热蒸熟,蒸熟的馒头能变得疏松多孔,为什么?这种药物能中和过多的胃酸。
Al(OH)3+3HCl=AlCl 3 +3H2O 发酵产生的酸和加入的纯碱(Na2CO3)反应,生成CO2气体,使馒头内生成许多小洞,因此馒头疏松多孔。2、化学与生活酸性HCl稀HCl、H2SO4的化学性质NaOH、Ca(OH)2溶液的化学性质小结作业:总复习题P185—187
1到5题谢谢!一定条件下,同一化学反应进行的快慢与反应物的质量分数成正比。现用100克溶液质质量分数为30%的盐酸溶液与过量的锌粉反应,为了使反应慢点进行而又不生成氢气的总量,可向所用的盐酸中加入适量的( )。
A、氢氧化钠 B、水
C、氧化镁 D、碳酸钙练习B 现有白纸和几种溶液,有人用这些材料设计了一个名为“雨落叶出红花开”的趣味实验。实验的过程如下:先用洁净的毛笔蘸 (填序号,下同)在白纸上画上花,再用 画上叶,将白纸挂上墙壁,晾干后用 向纸上喷即成。
A、酚酞试液 B、石蕊试液
C、氢氧化钠溶液 D、稀盐酸练习用锌粒和盐酸反应制取的氢气中,常混有水蒸气和氯化氢气体,为了除去气体杂质,可使混合气体通过右图A、B两装置,气体通过两瓶的导管顺序正确的是( ) A、abcd B、dcba C、cdab D、bacd a b c d浓硫酸NaOH溶液练习CA B下列四种物质中,能和其他三种物质反应的是( )。
A、盐酸 B、锌
C、铁锈 D、氢氧化铜练习A下列四种物质中,能和其他三种物质反应的是( )。
A、盐酸 B、二氧化碳
C、硫酸铜 D、氢氧化钠练习D氯化钙溶液中含有少量盐酸,欲中和盐酸使溶液呈中性,且不引入新物质,在没有指示剂的条件下,可以选用下列物质中的( )。
A、Ca(OH)2 B、CaO
C、CaCO3 D、AgNO3动动脑C
1、了解稀盐酸和稀硫酸、氢氧化钠、氢氧化钙和氨水、氯化钠和碳酸钠的物理性质,重点归纳化学性质
2、从离子的角度认识酸和碱具有某些
相似化学性质的原因稀盐酸NaOH溶液紫色石蕊稀盐酸NaOH溶液无色酚酞小结酸性溶液能够使紫色石蕊试液变红,
使无色酚酞试液不变色。碱性溶液能够使紫色石蕊试液变蓝,
使无色酚酞试液变红。酸性溶液使蓝色石蕊试纸变红,
碱性溶液使红色石蕊试纸变蓝。溶液的pH含义:表示溶液酸碱性强弱的程度范围酸性增强碱性增强pH=7,溶液呈中性pH<7,溶液呈酸性pH>7,溶液呈碱性想一想:溶液pH最简便测定方法一、盐酸、硫酸的物理性质?想一想盐酸物理性质氯化氢气体的水溶液1,无色有剌激性气味的液体2,易挥发,在空气中形成白雾3,有酸味,腐蚀性4,工业品:黄色(含Fe3+)硫酸的物理性质1.无色、粘稠、油状液体2.难挥发3.吸水性、脱水性、腐蚀性、强氧化性小明看见爸爸常常用稀盐酸给铁制器皿除锈,他自己想亲自试一试。于是,他找出一颗生锈铁钉出来,放入足量稀盐酸中,然后,美滋滋地去睡觉了……生活知多D生锈铁钉消失了Fe2O3+6HCl == 2FeCl3+ 3H2O
Fe + 2HCl ==FeCl2 + H2↑第二天……?成份:氢氧化铝、碘甲基蛋氨酸等3HCl + Al(OH)3 == AlCl3 + 3H2O生活知多DCaCl2+ H2O+ CO2你知道实验室制取二氧化碳
的药品原理是什么吗?2HCl+ CaCO3==↑二、酸的化学性质:1、酸 + 指示剂2、酸 + 金属氧化物 → 盐 + 水3、酸 + 活泼金属 → 盐 + 氢气4、酸 + 碱 → 盐 + 水5、酸 + 盐 → 新盐 + 新酸食用松花皮蛋时常感到有涩味,是因为制作过程中用到了熟石灰和纯碱等原料。为了减轻涩味,可在食用时添加调味品,这种调味品最好( )。
A、食盐 B、酱油
C、香油 D、食醋D生活知多D在盛有下列固体的试管内,加入足量的稀硫酸,只能得到无色溶液的是( )。
A、ZnO B、Fe
C、Cu(OH)2 D、Fe2O3练习A鱼胆弄破后会使鱼肉粘上难溶解于水的胆汁酸(一种酸)而变苦,要减少这种苦味,用来洗涤的最佳物质是( )。
A、水 B、食盐
C、纯碱 D、食醋C生活知多D苯甲酸(C6H5COOH)可用作食品防腐剂,其酸性比醋酸强,下列对苯甲酸性质的推测,不合理的是( )
A、苯甲酸能使石蕊试液变红色
B、苯甲酸不能使酚酞变色
C、苯甲酸溶液的pH>7
D、苯甲酸溶液的pH<7练习C酸→H++酸根离子 “物质的组成与结构决定物质的性质”是化学学科中的重要观点。按照这一观点讨论:
酸溶液具有一些共同的化学性质,是因为酸溶液中都含有 ;碱溶液也具有一些共同的化学性质,是因为碱溶液中都含有 。练习碱→金属离子+OH-H+OH-三、氢氧化钠、氢氧化钙的物理性质想一想?氢氧化钠物理性质1.白色片状固体2.极易溶于水且放大量热3.易吸收水分而潮解4.强腐蚀性,故称火碱、烧碱、苛性钠5.水溶液有涩味和滑腻感氢氧化钙物理性质1.白色粉未状固体2. 微溶于水且放热,水溶液叫熟石灰 3.有一定腐蚀性,俗称熟石灰,消石灰四、氢氧化钠、氢氧化钙溶液的化学性质:1、碱 + 指示剂2、碱 + 非金属氧化物 → 盐 + 水Ca(OH)2 + CO2 === CaCO3↓ + H2O1、碱 + 指示剂2、碱 + 非金属氧化物 → 盐 + 水3、碱 + 酸→ 盐 + 水4、碱 + 盐 → 新盐 + 新碱四、氢氧化钠、氢氧化钙溶液的化学性质敞口的氢氧化钠固体质量会变化吗?
答案:会增大。吸水且与CO2反应
2NaOH + CO2 === Na2CO3 + H2O
80 44 106 18动动脑 食品公司通常在“**雪饼”的包装袋内放入一小包干燥剂,上面的部分文字如下: 干燥剂 DESICCANT
请勿食用 DO NOT EAT
请注意:
(1)本干燥剂主要成分为生石灰
(2)请勿食用
(3)万一误入眼睛,请先用水清洗后,
求诊于医师、
(4)请慎防取玩生活知多D请仔细阅读,回答下列问题:
(1)这包干燥剂吸收水分的反应方程式是 。
(2)“请勿食用”是因为干燥剂吸水后具 。
(3)如果误食入口应该 。CaO+H2O==Ca(OH)2腐蚀性服用食醋并大量饮水生活知多D某溶液的pH是5,若将溶液的pH上升到8,应采用的措施是加入适量( )。
A、紫色石蕊试液 B、酸溶液
C、碱溶液 D、蒸馏水练习C五、几种常见的盐物理性质与用途比较五、几种常见的盐物理性质与用途的比较1、盐与指示剂
六、盐溶液的化学性质:2、盐 + 金属?金属活动顺序表:K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au 要求: 记清楚、会默写、会用应用:①判断金属能否于酸发生置换反应②判断金属能否与盐溶液发生置换反应③通过化学反应比较金属活动性的强弱④通过金属活动性比较反应的快慢2、盐 + 活泼金属===新盐 + 新金属1、前换后
2、盐可溶
3、钾、钙、钠除外要求:1、盐与指示剂
2、盐 + 活泼金属===新盐 + 新金属
3、盐与酸、碱
4、盐与盐反应六、盐溶液的化学性质:取NaOH溶液适量于小烧杯中,滴入几滴酚酞试液,然后再向该溶液中逐滴滴入稀HCl。溶液先由无色变红,再由红变无色。氢氧化钠溶液能与稀盐酸反应。动动脑日常生活中接触到的酸、碱、盐 (1)日常生活中常见的酸
胃液里常含有盐酸,食醋里含有醋酸,汽水里含有碳酸、柠檬酸,发酵后的牛 乳里含有乳酸,山楂、柑橘、柠檬等水果里含有不同的有机酸. (2)日常生活中常见的碱
作为建筑材料的熟石灰,作为化肥或医药的氨水,作为中和胃酸药物的氢氧化铝等.我们还会接触到一些生物碱(有机碱类),如烟碱(尼古丁)、金鸡钠碱(奎宁)等。 . (3)日常生活中常见的盐
用作调味剂和防腐剂的食盐,用作净水剂的明矾,用作消毒剂的高锰酸钾,用来制作模型的石膏,用作建筑材料的石灰石和大理石. ⑴人的胃液是呈 ,因为含有 ,可帮助消化。若含量过多的病人可服用一种药物叫胃舒平[主要成分是Al(OH)3]。它起什么作用?写出有关反应的化学方程式。 ⑵做馒头时,面团经过发酵后生成一些酸,此时可加一些纯碱溶液,用力揉和,然后做成馒头,加热蒸熟,蒸熟的馒头能变得疏松多孔,为什么?这种药物能中和过多的胃酸。
Al(OH)3+3HCl=AlCl 3 +3H2O 发酵产生的酸和加入的纯碱(Na2CO3)反应,生成CO2气体,使馒头内生成许多小洞,因此馒头疏松多孔。2、化学与生活酸性HCl稀HCl、H2SO4的化学性质NaOH、Ca(OH)2溶液的化学性质小结作业:总复习题P185—187
1到5题谢谢!一定条件下,同一化学反应进行的快慢与反应物的质量分数成正比。现用100克溶液质质量分数为30%的盐酸溶液与过量的锌粉反应,为了使反应慢点进行而又不生成氢气的总量,可向所用的盐酸中加入适量的( )。
A、氢氧化钠 B、水
C、氧化镁 D、碳酸钙练习B 现有白纸和几种溶液,有人用这些材料设计了一个名为“雨落叶出红花开”的趣味实验。实验的过程如下:先用洁净的毛笔蘸 (填序号,下同)在白纸上画上花,再用 画上叶,将白纸挂上墙壁,晾干后用 向纸上喷即成。
A、酚酞试液 B、石蕊试液
C、氢氧化钠溶液 D、稀盐酸练习用锌粒和盐酸反应制取的氢气中,常混有水蒸气和氯化氢气体,为了除去气体杂质,可使混合气体通过右图A、B两装置,气体通过两瓶的导管顺序正确的是( ) A、abcd B、dcba C、cdab D、bacd a b c d浓硫酸NaOH溶液练习CA B下列四种物质中,能和其他三种物质反应的是( )。
A、盐酸 B、锌
C、铁锈 D、氢氧化铜练习A下列四种物质中,能和其他三种物质反应的是( )。
A、盐酸 B、二氧化碳
C、硫酸铜 D、氢氧化钠练习D氯化钙溶液中含有少量盐酸,欲中和盐酸使溶液呈中性,且不引入新物质,在没有指示剂的条件下,可以选用下列物质中的( )。
A、Ca(OH)2 B、CaO
C、CaCO3 D、AgNO3动动脑C
