富集在海水中的氯元素2[下学期]
文档属性
| 名称 | 富集在海水中的氯元素2[下学期] |  | |
| 格式 | rar | ||
| 文件大小 | 85.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-05-21 13:30:00 | ||
图片预览



文档简介
课件10张PPT。富集在海水中的元素氯4、常温下与碱溶液反应Cl2 + 2NaOH = NaCl + NaClO + H2O2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O§次氯酸的性质 1、弱酸性(酸性弱于碳酸 )
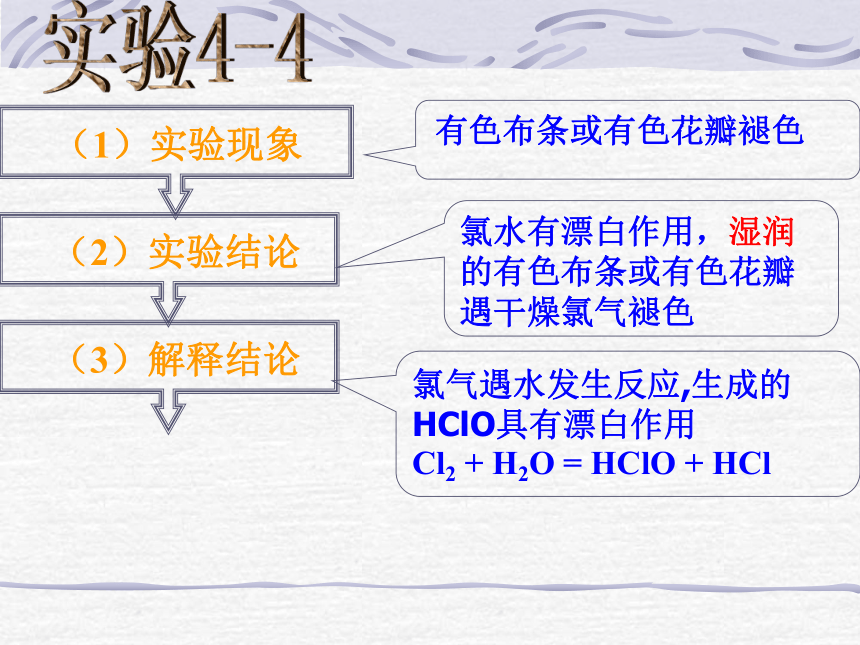
2、不稳定性3、强氧化性 HClO是一种强氧化剂,其氧化性能杀灭水里的细菌,因此,Cl2能消毒; HClO的强氧化性还能起漂白作用,使染料和有机物质褪色。 实验4-4 有色布条或有色花瓣褪色 氯水有漂白作用,湿润的有色布条或有色花瓣遇干燥氯气褪色氯气遇水发生反应,生成的HClO具有漂白作用
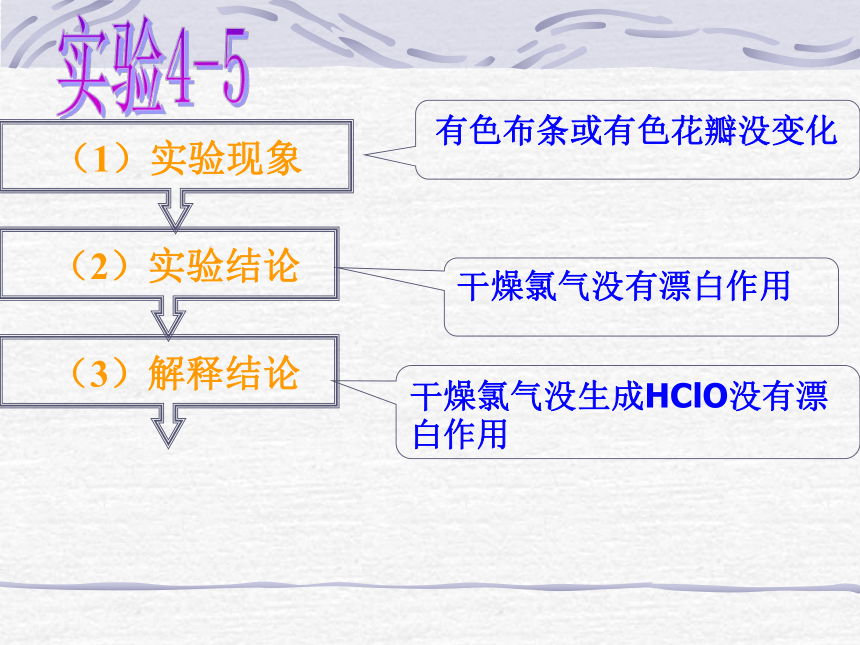
Cl2 + H2O = HClO + HCl 实验4-5 有色布条或有色花瓣没变化 干燥氯气没有漂白作用干燥氯气没生成HClO没有漂白作用氯水的漂白作用思考:新制氯水的成分?新制氯水与久置氯水成分相同吗?
分子:
离子:H2O、HClO、Cl2H+、Cl -、ClO-、OH-§漂白粉——氯气化学性质的应用原理:Cl2 + 2NaOH = NaCl + NaClO + H2O
2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O 工业上常将Cl2通入消石灰中制得漂白粉等漂白剂,其主要成分是CaCl2 和 Ca(ClO)2 ,真正有效成分是 Ca(ClO)2 。思考1:漂白粉是如何漂白的 ?思考2:久置漂白粉为何失效 ?思考3:漂白粉应如何保存?漂白粉包装要密封,避光、隔潮存放三、Cl2的用途1、作消毒剂
2、制造盐酸
3、制造漂白粉
4、Cl2是合成塑料、橡胶、农药、燃料和医药的重要原料 四、氯离子(Cl – )的检验实验4—6氯离子(Cl – )的检验所用试剂: AgNO3 溶液和稀硝酸 操作: 被检液+少量稀硝酸+ AgNO3 溶液现象:生成白色沉淀同学们再见
2、不稳定性3、强氧化性 HClO是一种强氧化剂,其氧化性能杀灭水里的细菌,因此,Cl2能消毒; HClO的强氧化性还能起漂白作用,使染料和有机物质褪色。 实验4-4 有色布条或有色花瓣褪色 氯水有漂白作用,湿润的有色布条或有色花瓣遇干燥氯气褪色氯气遇水发生反应,生成的HClO具有漂白作用
Cl2 + H2O = HClO + HCl 实验4-5 有色布条或有色花瓣没变化 干燥氯气没有漂白作用干燥氯气没生成HClO没有漂白作用氯水的漂白作用思考:新制氯水的成分?新制氯水与久置氯水成分相同吗?
分子:
离子:H2O、HClO、Cl2H+、Cl -、ClO-、OH-§漂白粉——氯气化学性质的应用原理:Cl2 + 2NaOH = NaCl + NaClO + H2O
2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O 工业上常将Cl2通入消石灰中制得漂白粉等漂白剂,其主要成分是CaCl2 和 Ca(ClO)2 ,真正有效成分是 Ca(ClO)2 。思考1:漂白粉是如何漂白的 ?思考2:久置漂白粉为何失效 ?思考3:漂白粉应如何保存?漂白粉包装要密封,避光、隔潮存放三、Cl2的用途1、作消毒剂
2、制造盐酸
3、制造漂白粉
4、Cl2是合成塑料、橡胶、农药、燃料和医药的重要原料 四、氯离子(Cl – )的检验实验4—6氯离子(Cl – )的检验所用试剂: AgNO3 溶液和稀硝酸 操作: 被检液+少量稀硝酸+ AgNO3 溶液现象:生成白色沉淀同学们再见
