化学:2.3《化学反应的利用》学案(鲁科版必修2)
文档属性
| 名称 | 化学:2.3《化学反应的利用》学案(鲁科版必修2) |

|
|
| 格式 | rar | ||
| 文件大小 | 529.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-07-05 00:00:00 | ||
图片预览


文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
课题: 第三节 化学反应的利用
(编写人:全本新 王显罡)
一、学习目标
1、 对“利用化学反应造福人类”认识进一步具体化。
2、 掌握实验室制备氯气的原理和尾气处理方法,了解制备装置及收集方法,以及原电池的工作原理。
3、 通过“活动·探究—氯气的制取和原电池的工作原理”,培养观察能力,实验能力和分析推理能力。
4、利用“化学前沿”、“资料在线”等拓展性栏目,提供丰富的材料,开拓视野,从更多角度体会化学科学与人类文明和社会发展的密切关系。
二、课时安排 2课时
三、教学过程
第3节 化学反应的利用
【第1课时】
一、利用化学反应制备新物质
【提问】一种新物质是怎样利用化学反应制备出来的呢?
1、探究实验室制取氯气
【思考】回忆氯气的物理性质和化学性质?
【活动 探究】分析以下四个制取氯气的反应原理:
1、 从氧化-还原反应知识的角度分析,有什么共同之处?
2、 你认为哪个反应原理适合工业生产,哪些反应原理可以用在实验室中?
①
②
③
④
【归纳·总结】上述四个反应都是利用了氧化剂把 价的Cl变成了 价的Cl 。
工业上利用反应④通过电解食盐水制备 。反应①是历史上曾经使用过的地康法制氯气。反应②是瑞典化学家舍勒在研究软锰矿石时,把盐酸和软锰矿矿石混合在一起加热,意外地发现有一种令人窒息的黄绿色气体生成,产生的就是氯气。至今,实验室中仍用这种方法制取氯气。反应③也是实验室中常用的制取氯气的方法之一。
实验室制取氯气的反应方程式为:
【思考、讨论】回忆实验室制取氢气、二氧化碳、氨气时所用的发生装置和收集方法,比较得出在气体发生装置和收集方法的选取上遵循的一般原则。
【小结】
物质 发生装置 收集装置
氢气 固—液 不加热型 向下排空气法、排水法
二氧化碳 固—液 不加热型 向上排空气法
氨气 固—固 加热型 向下排空气法
【讨论】选择哪些实验仪器组装成制取氯气的发生和收集装置较为合适?
可以采用固—液混合加热制气装置,向上排空气法。
仪器有:铁架台、酒精灯、烧瓶、分液漏斗、导气管、集气瓶等。
【提问】氯气有毒、有刺激性气味,对环境有污染。那么,多余的氯气应该如何处理?
【演示实验】实验室制取氯气的一般方法。
(如下图所示,在烧瓶里加入少量的二氧化锰粉末,通过分液漏斗向烧瓶中加入适量密度为1.19g/cm3的浓盐酸,缓缓加热,使反应加速进行。观察实验现象。用向上排空气法收集氯气,多余的氯气用氢氧化钠溶液吸收)
试剂
装置
实验现象
【小结】填写实验报告。
2、制备物质的一般思路
根据物质的性质选择适当的反应原理及发生装置,设计实验过程应符合科学性、安全性、可行性、简约性等。
3、化学前沿——分子设计与新物质的合成
【阅读理解】教材49页的“化学前沿——分子设计与新物质的合成”。
【练习】1、请填写下表中实验室或工厂里制备下列物质的化学反应方程式:
制备物质 化学方程式
氢气
二氧化碳
生铁(以赤铁矿为原料)
硫酸(以硫为原料)
氨
硝酸(以氨为原料)
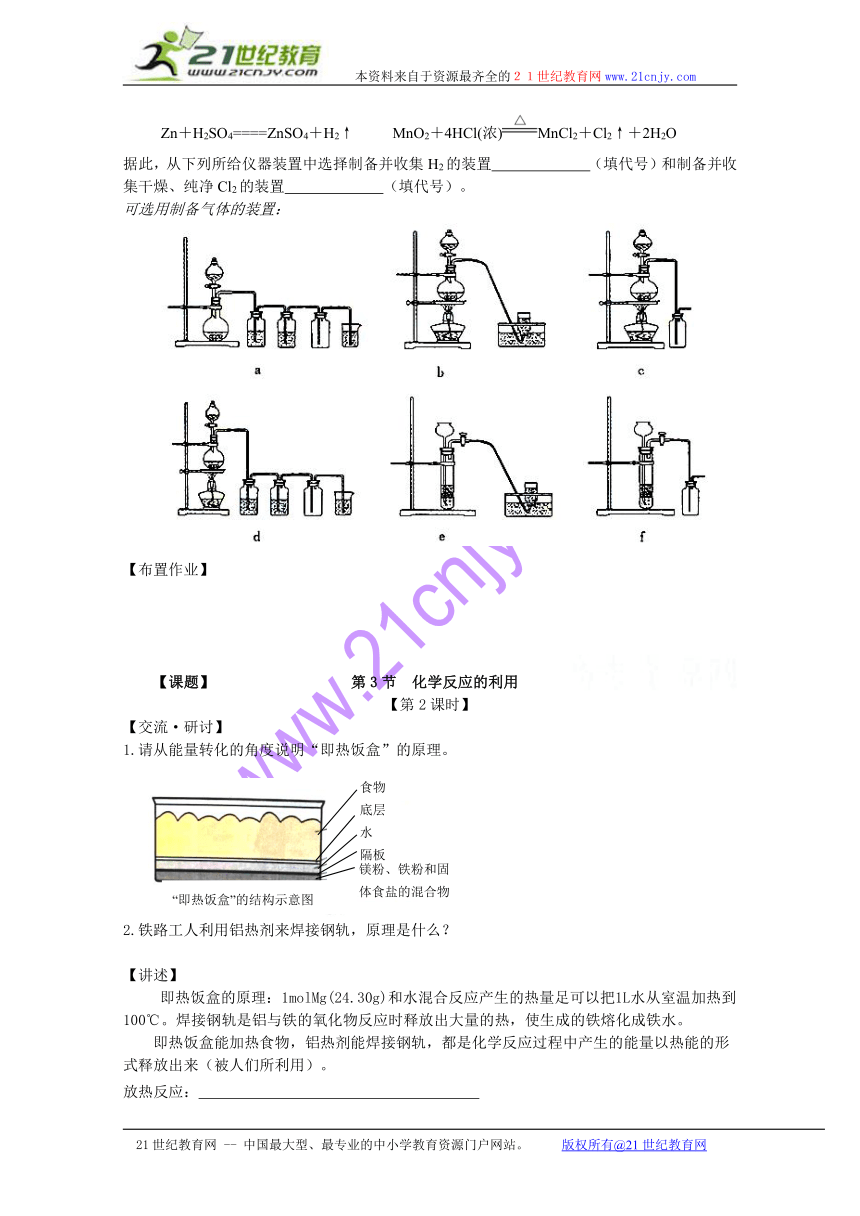
2、实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4====ZnSO4+H2↑ MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置 (填代号)和制备并收集干燥、纯净Cl2的装置 (填代号)。
可选用制备气体的装置:
【布置作业】21世纪教育网
【课题】 第3节 化学反应的利用
【第2课时】
【交流·研讨】
1.请从能量转化的角度说明“即热饭盒”的原理。
2.铁路工人利用铝热剂来焊接钢轨,原理是什么?
【讲述】
即热饭盒的原理:1molMg(24.30g)和水混合反应产生的热量足可以把1L水从室温加热到
100℃。焊接钢轨是铝与铁的氧化物反应时释放出大量的热,使生成的铁熔化成铁水。
即热饭盒能加热食物,铝热剂能焊接钢轨,都是化学反应过程中产生的能量以热能的形式释放出来(被人们所利用)。
放热反应:
吸热反应:
化学反应所产生的热能是人类生产和生活所需能量的重要来源之一。
化学能不仅可以转变成热能,人们还可以通过氧化还原反应将化学能转化成电能。电池就是利用化学反应产生电能的装置。
下面我们通过原电池的工作原理来认识化学能是如何转化成电能的。
二、化学反应为人类提供能源
【活动·探究】 原电池的工作原理:
按要求完成以下实验,通过对实验现象的观察和分析初步了解原电池的工作原理。
【演示实验】将铜片、锌片插入稀硫酸中,然后用导线将铜片、锌片连接起来,并接入一支电流表,观察发生的现象,填写下表:
实验过程 铜片上发生的现象 锌片上发生的现象 电流表指针
铜片、锌片连接前
铜片、锌片连接后
结论
【分析】在实验中,当把铜片和锌片同时浸入稀硫酸时,由于金属锌比金属铜活泼,锌原子容易失去电子被氧化成Zn2+进入溶液中,锌片上的电子通过导线流向铜片,溶液中的H+从铜片获得电子而被还原成氢原子,氢原子再结合成氢分子从铜片上逸出。这样,在连接锌片和铜片的导线中电子做定向移动,形成电流。
原电池:(利用氧化还原反应)
电极反应:
负极(Zn极):Zn - 2e- = Zn2+ (氧化反应)
正极(Cu极):2H+ + 2e- = 2H2 ↑ (还原反应)
电池总反应: Zn + 2H+ = Zn2+ + H2↑ (氧化-还原反应)
Zn + H2SO4 = ZnSO4 + H2↑ (氧化-还原反应)
【提醒】书写电极反应式时注意:
标出电极材料、电极名称、遵循电子得失守恒、质量守恒、电荷守恒原则。
【讲述】在原电池中电子流出的一极是 (如锌片),发生氧化反应;
电子流入的一极是 (如铜片),发生还原反应。
【展示】原电池的工作原理图:
【问题】指出常用的干电池的正负极。分析为什么干电池用久了外壳会变软?
21世纪教育网
【阅读】课本P.51.“追根寻源”铜片在原电池中的作用。
【原电池形成电流的条件】:
①
②
③
【注意】形成原电池,使反应速率加快,能量转化率提高。
【电池的分类】① 干电池(一次电池):日常使用的锌锰电池
② 蓄电池(二次电池):汽车用的铅蓄电池、手机用的镍氢电池、锂电池
③ 燃料电池:用于航天、军事领域。
【阅读理解】教材52页第二段:化学能与光能之间的相互转化。
【阅读】教材52页“资料在线”:合理利用化学能源、太阳能利用的前景、安全利用能源。图2-3-13、图2-3-14。
【概括、整合】
1、面临纷繁复杂的化学反应,为了研究和应用的方便,人们从不同的角度进行了分类。
21世纪教育网
举例说明以上对于化学反应的划分原则。
2、反应有许多重要的应用。
⑴在实验室里和工业上各是利用什么化学反应来制备氯气的?你还能举出实验室里和工业上利用化学反应制备物质的实例吗?
可以利用氧化还原反应的原理,设计能够产生0价的氯单质的化学反应。
⑵怎样证明化学能与热能、电能或光能之间能发生相互转化?
利用化学反应中温度的变化,电流计和光敏计的测定等方法。
⑶根据你对化学反应的规律、实质及应用的认识,进一步丰富以上有关化学反应的图示。
如:总结中使用的图示,可以再丰富。
【练习】本节练习1、2。
【布置作业】
21世纪教育网
www.
△
4HCl+O2= 2H2O+2Cl2↑
CuCl2
MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O
△
2KMnO4+16HCl(浓) =2MnCl2+2KCl+8Cl2↑+5H2O
2NaCl +2H2O=2NaOH+H2↑+Cl2↑
通电
食物
底层
水
隔板
“即热饭盒”的结构示意图
镁粉、铁粉和固
体食盐的混合物
阳离子
阴离子
化学反应的利用
确定物质的组成、结构,测定物质有关组分的含量
为人类提供能源
制造新物质
如何利用化学反应制造新物质
如何将化学能转化为电能
原电池的工作原理
物
质
变
化
能量
变化
案例:氯气的制取
化学反应
化合、分解、置换和复分解四种基本反应
有些反应
为可逆反应
有些反应为
氧化还原反应
吸热反应和放热反应
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
课题: 第三节 化学反应的利用
(编写人:全本新 王显罡)
一、学习目标
1、 对“利用化学反应造福人类”认识进一步具体化。
2、 掌握实验室制备氯气的原理和尾气处理方法,了解制备装置及收集方法,以及原电池的工作原理。
3、 通过“活动·探究—氯气的制取和原电池的工作原理”,培养观察能力,实验能力和分析推理能力。
4、利用“化学前沿”、“资料在线”等拓展性栏目,提供丰富的材料,开拓视野,从更多角度体会化学科学与人类文明和社会发展的密切关系。
二、课时安排 2课时
三、教学过程
第3节 化学反应的利用
【第1课时】
一、利用化学反应制备新物质
【提问】一种新物质是怎样利用化学反应制备出来的呢?
1、探究实验室制取氯气
【思考】回忆氯气的物理性质和化学性质?
【活动 探究】分析以下四个制取氯气的反应原理:
1、 从氧化-还原反应知识的角度分析,有什么共同之处?
2、 你认为哪个反应原理适合工业生产,哪些反应原理可以用在实验室中?
①
②
③
④
【归纳·总结】上述四个反应都是利用了氧化剂把 价的Cl变成了 价的Cl 。
工业上利用反应④通过电解食盐水制备 。反应①是历史上曾经使用过的地康法制氯气。反应②是瑞典化学家舍勒在研究软锰矿石时,把盐酸和软锰矿矿石混合在一起加热,意外地发现有一种令人窒息的黄绿色气体生成,产生的就是氯气。至今,实验室中仍用这种方法制取氯气。反应③也是实验室中常用的制取氯气的方法之一。
实验室制取氯气的反应方程式为:
【思考、讨论】回忆实验室制取氢气、二氧化碳、氨气时所用的发生装置和收集方法,比较得出在气体发生装置和收集方法的选取上遵循的一般原则。
【小结】
物质 发生装置 收集装置
氢气 固—液 不加热型 向下排空气法、排水法
二氧化碳 固—液 不加热型 向上排空气法
氨气 固—固 加热型 向下排空气法
【讨论】选择哪些实验仪器组装成制取氯气的发生和收集装置较为合适?
可以采用固—液混合加热制气装置,向上排空气法。
仪器有:铁架台、酒精灯、烧瓶、分液漏斗、导气管、集气瓶等。
【提问】氯气有毒、有刺激性气味,对环境有污染。那么,多余的氯气应该如何处理?
【演示实验】实验室制取氯气的一般方法。
(如下图所示,在烧瓶里加入少量的二氧化锰粉末,通过分液漏斗向烧瓶中加入适量密度为1.19g/cm3的浓盐酸,缓缓加热,使反应加速进行。观察实验现象。用向上排空气法收集氯气,多余的氯气用氢氧化钠溶液吸收)
试剂
装置
实验现象
【小结】填写实验报告。
2、制备物质的一般思路
根据物质的性质选择适当的反应原理及发生装置,设计实验过程应符合科学性、安全性、可行性、简约性等。
3、化学前沿——分子设计与新物质的合成
【阅读理解】教材49页的“化学前沿——分子设计与新物质的合成”。
【练习】1、请填写下表中实验室或工厂里制备下列物质的化学反应方程式:
制备物质 化学方程式
氢气
二氧化碳
生铁(以赤铁矿为原料)
硫酸(以硫为原料)
氨
硝酸(以氨为原料)
2、实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4====ZnSO4+H2↑ MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置 (填代号)和制备并收集干燥、纯净Cl2的装置 (填代号)。
可选用制备气体的装置:
【布置作业】21世纪教育网
【课题】 第3节 化学反应的利用
【第2课时】
【交流·研讨】
1.请从能量转化的角度说明“即热饭盒”的原理。
2.铁路工人利用铝热剂来焊接钢轨,原理是什么?
【讲述】
即热饭盒的原理:1molMg(24.30g)和水混合反应产生的热量足可以把1L水从室温加热到
100℃。焊接钢轨是铝与铁的氧化物反应时释放出大量的热,使生成的铁熔化成铁水。
即热饭盒能加热食物,铝热剂能焊接钢轨,都是化学反应过程中产生的能量以热能的形式释放出来(被人们所利用)。
放热反应:
吸热反应:
化学反应所产生的热能是人类生产和生活所需能量的重要来源之一。
化学能不仅可以转变成热能,人们还可以通过氧化还原反应将化学能转化成电能。电池就是利用化学反应产生电能的装置。
下面我们通过原电池的工作原理来认识化学能是如何转化成电能的。
二、化学反应为人类提供能源
【活动·探究】 原电池的工作原理:
按要求完成以下实验,通过对实验现象的观察和分析初步了解原电池的工作原理。
【演示实验】将铜片、锌片插入稀硫酸中,然后用导线将铜片、锌片连接起来,并接入一支电流表,观察发生的现象,填写下表:
实验过程 铜片上发生的现象 锌片上发生的现象 电流表指针
铜片、锌片连接前
铜片、锌片连接后
结论
【分析】在实验中,当把铜片和锌片同时浸入稀硫酸时,由于金属锌比金属铜活泼,锌原子容易失去电子被氧化成Zn2+进入溶液中,锌片上的电子通过导线流向铜片,溶液中的H+从铜片获得电子而被还原成氢原子,氢原子再结合成氢分子从铜片上逸出。这样,在连接锌片和铜片的导线中电子做定向移动,形成电流。
原电池:(利用氧化还原反应)
电极反应:
负极(Zn极):Zn - 2e- = Zn2+ (氧化反应)
正极(Cu极):2H+ + 2e- = 2H2 ↑ (还原反应)
电池总反应: Zn + 2H+ = Zn2+ + H2↑ (氧化-还原反应)
Zn + H2SO4 = ZnSO4 + H2↑ (氧化-还原反应)
【提醒】书写电极反应式时注意:
标出电极材料、电极名称、遵循电子得失守恒、质量守恒、电荷守恒原则。
【讲述】在原电池中电子流出的一极是 (如锌片),发生氧化反应;
电子流入的一极是 (如铜片),发生还原反应。
【展示】原电池的工作原理图:
【问题】指出常用的干电池的正负极。分析为什么干电池用久了外壳会变软?
21世纪教育网
【阅读】课本P.51.“追根寻源”铜片在原电池中的作用。
【原电池形成电流的条件】:
①
②
③
【注意】形成原电池,使反应速率加快,能量转化率提高。
【电池的分类】① 干电池(一次电池):日常使用的锌锰电池
② 蓄电池(二次电池):汽车用的铅蓄电池、手机用的镍氢电池、锂电池
③ 燃料电池:用于航天、军事领域。
【阅读理解】教材52页第二段:化学能与光能之间的相互转化。
【阅读】教材52页“资料在线”:合理利用化学能源、太阳能利用的前景、安全利用能源。图2-3-13、图2-3-14。
【概括、整合】
1、面临纷繁复杂的化学反应,为了研究和应用的方便,人们从不同的角度进行了分类。
21世纪教育网
举例说明以上对于化学反应的划分原则。
2、反应有许多重要的应用。
⑴在实验室里和工业上各是利用什么化学反应来制备氯气的?你还能举出实验室里和工业上利用化学反应制备物质的实例吗?
可以利用氧化还原反应的原理,设计能够产生0价的氯单质的化学反应。
⑵怎样证明化学能与热能、电能或光能之间能发生相互转化?
利用化学反应中温度的变化,电流计和光敏计的测定等方法。
⑶根据你对化学反应的规律、实质及应用的认识,进一步丰富以上有关化学反应的图示。
如:总结中使用的图示,可以再丰富。
【练习】本节练习1、2。
【布置作业】
21世纪教育网
www.
△
4HCl+O2= 2H2O+2Cl2↑
CuCl2
MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O
△
2KMnO4+16HCl(浓) =2MnCl2+2KCl+8Cl2↑+5H2O
2NaCl +2H2O=2NaOH+H2↑+Cl2↑
通电
食物
底层
水
隔板
“即热饭盒”的结构示意图
镁粉、铁粉和固
体食盐的混合物
阳离子
阴离子
化学反应的利用
确定物质的组成、结构,测定物质有关组分的含量
为人类提供能源
制造新物质
如何利用化学反应制造新物质
如何将化学能转化为电能
原电池的工作原理
物
质
变
化
能量
变化
案例:氯气的制取
化学反应
化合、分解、置换和复分解四种基本反应
有些反应
为可逆反应
有些反应为
氧化还原反应
吸热反应和放热反应
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
