元素周期表和元素周期律
图片预览

文档简介
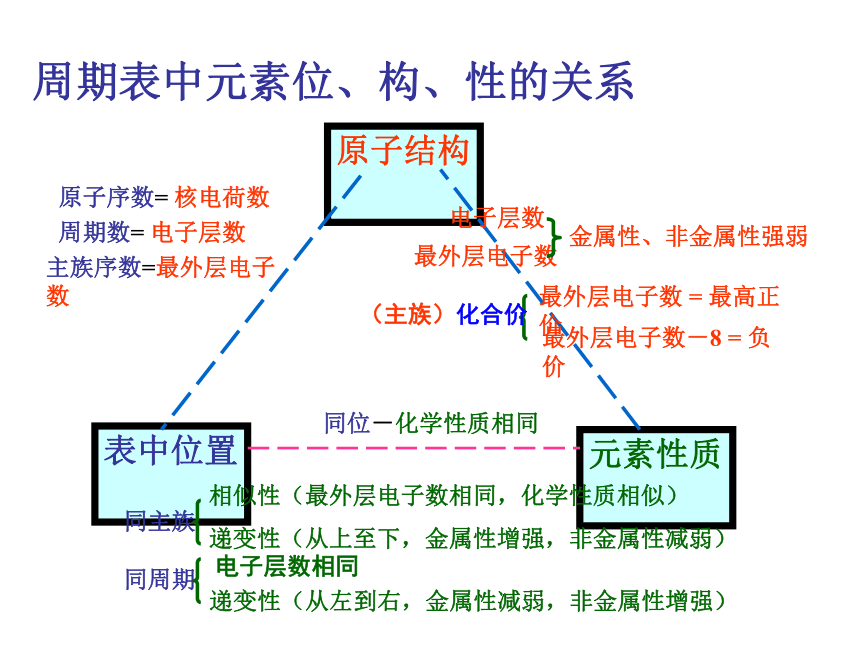
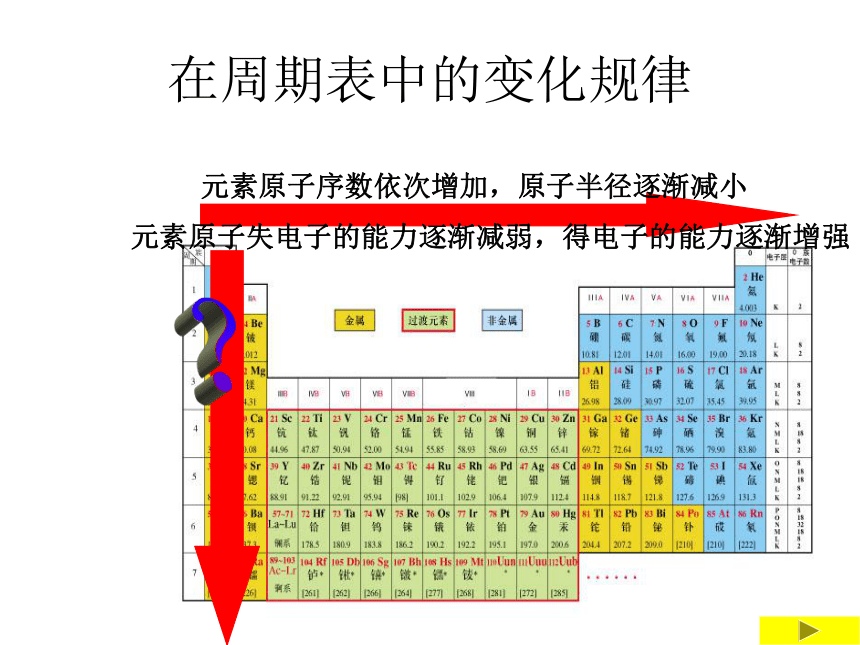
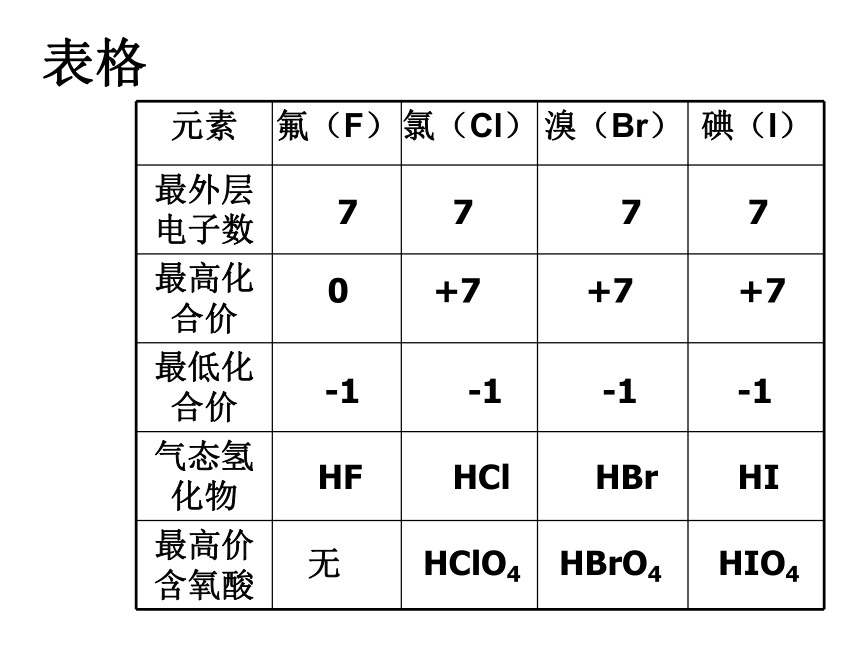
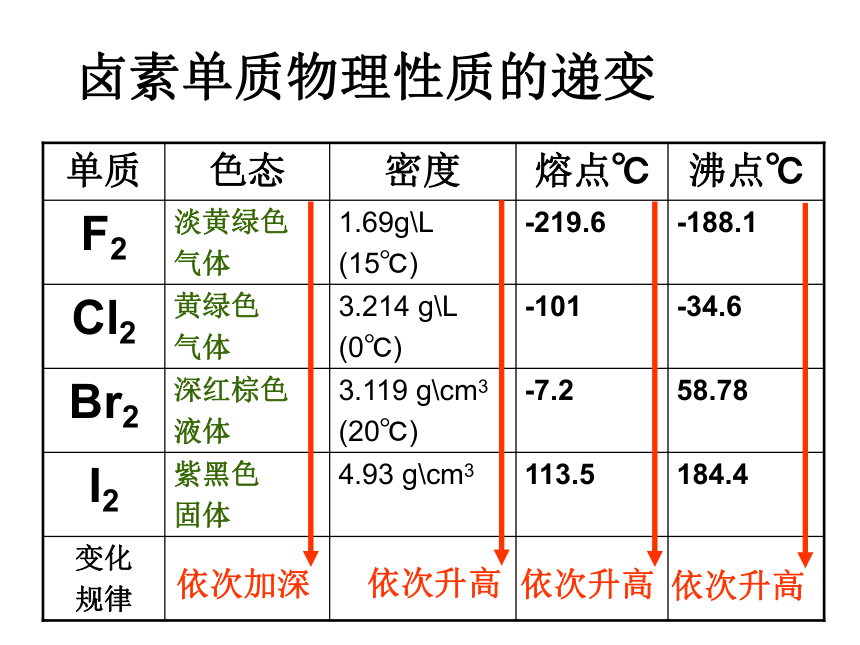
课件10张PPT。周期表中元素位、构、性的关系在周期表中的变化规律表格 7 7 7 7 0 +7 +7 +7 -1 -1 -1 -1 HF HCl HBr HI 无 HClO4 HBrO4 HIO4卤素单质物理性质的递变卤族元素单质与氢气化合的反应条件方法导引 元素原子得电子能力的强弱,可以采用下列方法间接判断:
1、元素单质与氢气化合的难易程度,一般说来,反应越容易进行,元素原子得电子的能力越强。
2、比较气态氢化物的稳定性,气态氢化物越稳定,元素原子得电子的能力越强。
3、比较元素最高价氧化物对应水化物的酸性强弱。一般说来,酸性越强,元素原子得电子的能力越强。SiO2P2O5SO3Cl2O7H4SiO4H3PO4H2SO4HClO4弱酸中强酸强酸最强酸高温加热加热点燃或光照SiH4PH3H2SHCl得电子能力逐渐增强 已知磷元素位于第3周期ⅤA族,
(1)画出磷的原子结构示意图;
(2)磷元素的最高化学价为 ,其氢化物的化学式为 。
【练习】 【训练】
1.由A、B两种元素组成的化合物,如果A、B两种元素的原子最外层电子数分别是1和6,则化合物的化学式可能是( )。
A、AB2 B.A2B C、AB D、A2B2
2.有X、Y、Z三种元素,其中X、Y属于同一主族,加热时,其单质都能与氢气形成气态氢化物H2X,H2Y。常温下,X单质为气态,X与Y可形成两种化合物YX2和YX3,Y、Z均在X的下一周期,而Z可与X生成化合物Z2X和Z2X2。试写出:
(1)元素名称X 、Y 、Z ;
(2)化合物Z2X2与H2X反应的化学方程式 ;
(3)两个由X、Y、Z三种元素所组成物质的化学式 。
1、元素单质与氢气化合的难易程度,一般说来,反应越容易进行,元素原子得电子的能力越强。
2、比较气态氢化物的稳定性,气态氢化物越稳定,元素原子得电子的能力越强。
3、比较元素最高价氧化物对应水化物的酸性强弱。一般说来,酸性越强,元素原子得电子的能力越强。SiO2P2O5SO3Cl2O7H4SiO4H3PO4H2SO4HClO4弱酸中强酸强酸最强酸高温加热加热点燃或光照SiH4PH3H2SHCl得电子能力逐渐增强 已知磷元素位于第3周期ⅤA族,
(1)画出磷的原子结构示意图;
(2)磷元素的最高化学价为 ,其氢化物的化学式为 。
【练习】 【训练】
1.由A、B两种元素组成的化合物,如果A、B两种元素的原子最外层电子数分别是1和6,则化合物的化学式可能是( )。
A、AB2 B.A2B C、AB D、A2B2
2.有X、Y、Z三种元素,其中X、Y属于同一主族,加热时,其单质都能与氢气形成气态氢化物H2X,H2Y。常温下,X单质为气态,X与Y可形成两种化合物YX2和YX3,Y、Z均在X的下一周期,而Z可与X生成化合物Z2X和Z2X2。试写出:
(1)元素名称X 、Y 、Z ;
(2)化合物Z2X2与H2X反应的化学方程式 ;
(3)两个由X、Y、Z三种元素所组成物质的化学式 。
