元素周期律及周期表PPT
图片预览


文档简介
课件18张PPT。广饶一中 李佐庆 第 二节
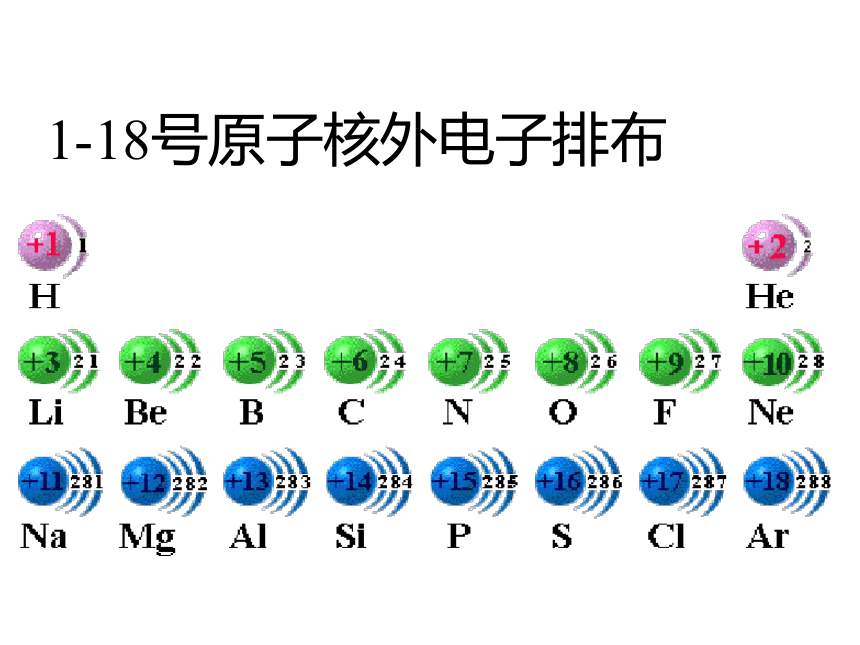
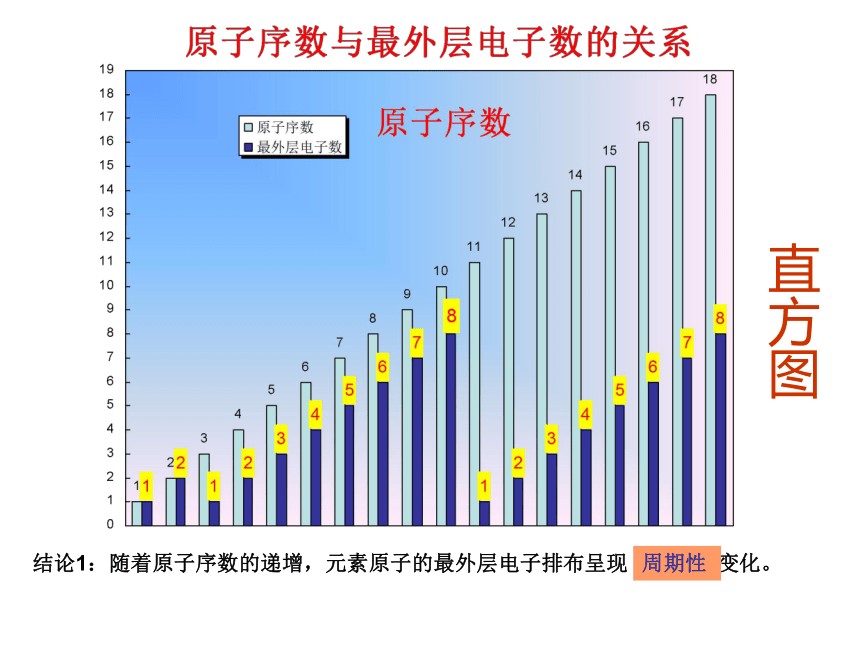
元素周期律和元素周期表1、原子核的构成2、核外电子排布规律温故知新:“五数”、“三素”1-18号原子核外电子排布直方图结论1:随着原子序数的递增,元素原子的最外层电子排布呈现 变化。
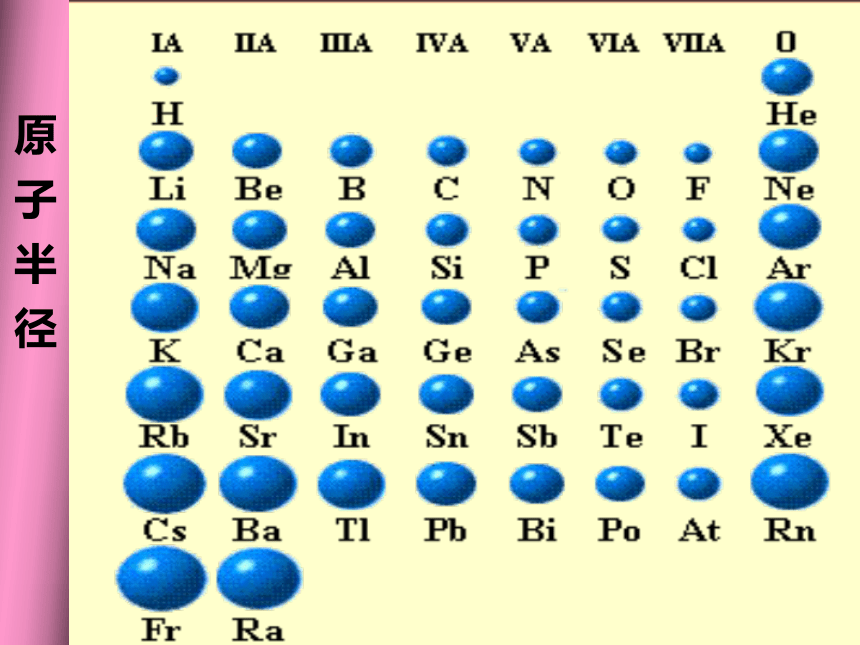
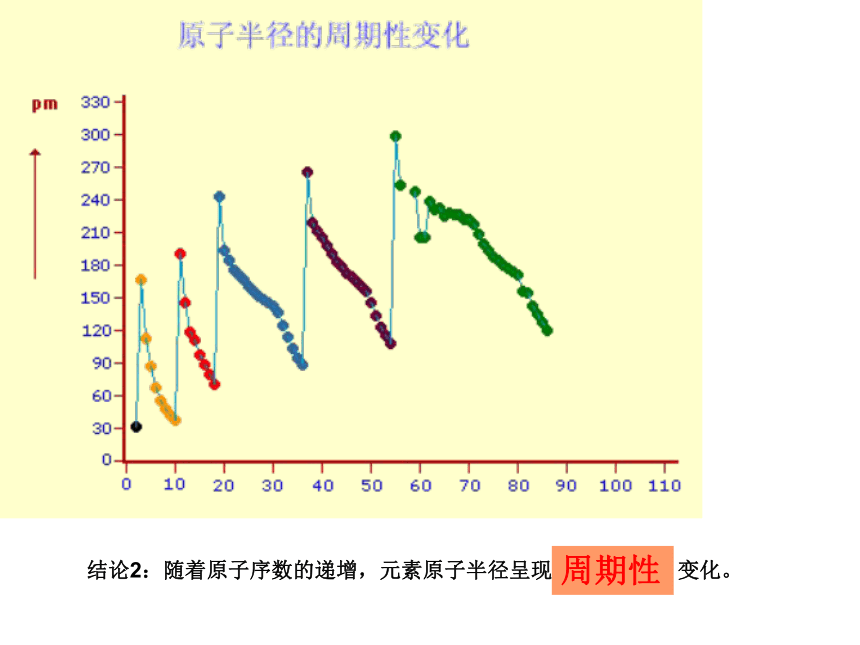
周期性 原 子 半 径结论2:随着原子序数的递增,元素原子半径呈现 变化。
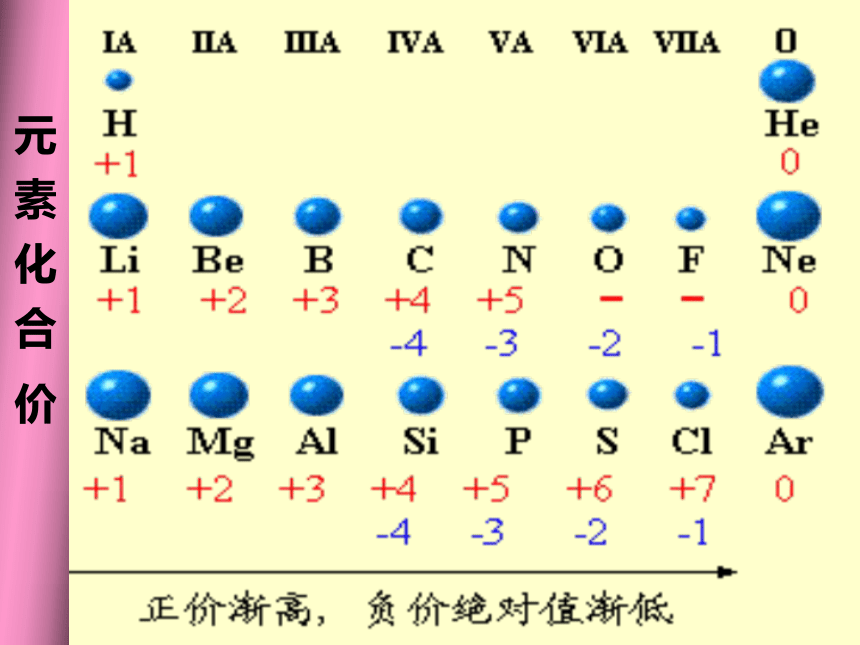
周期性 元 素 化 合 价结论3:随着原子序数的递增,元素化合价呈现 变化。
周期性原子序数与化合价的关系10123450123456700-4-3-2-1-4-3-2-10-4-202468原子序数化合价一、元素周期律元素的性质随着原子序数的递增而呈周期性变化(1)最外层电子数排布:从1 → 8(H、He除外)(2)原子半径:大 → 小(除稀有气体外)(3)元素化合价:最高正价+1 → +7
最低负价-4 → -1
稀有气体为0讨论:引起元素性质周期性变化的原因?汇总随着原子序数的递增核外电子排布呈周期性变化元素性质呈周期性变化元素周期律最外层电子数 1→8(K层电子数 1→2)原子半径 大→小(稀有气体元素突然增大)化合价:+1→+7 , -4→-1(稀有气体元素为零)决定了归纳出引起了2、实质:元素性质呈周期性变化是元素原子的核外电子排布周期性变化的必然结果。1-18号原子核外电子排布 利用元素周期律的知识,为1—18号元素编排元素周期表。练习:比较下列微粒的半径大小。Na 、 K 、 S 、O 、 F
Na 、 Na+
Cl 、 Cl-
Ca2+、 Cl-、 S2-(1)同种元素的阳离子半径小于原子半径;
同种元素的阴离子半径大于原子半径。
(2)电子排布相同的离子,核电荷数越大半径越小。
(3)核电荷数不同,电子层数越多,半径越大。 K>Na>S>O>FNa>Na+Cl(共18个纵列)短周期:第1、2、3周期,分别有2、8、8种元素长周期:第4、5、6周期,分别有18、18、32种元素不完全周期:第7周期,有20多种元素,排满应为32种元素主族:7个(ⅠA~Ⅶ A)副族:7个( Ⅰ B~Ⅶ B)第Ⅷ族:1个(第8、9、10三个纵列)零族:1个(稀有气体)三长三短一不全七主七副零八族七横十八纵课堂练习下列元素中, Na 、Fe Cu He K F
1、属于短周期的主族元素是: 。
2、属于长周期的主族元素是: 。
3、属于非金属主族元素是: 。
4、属于零族元素是: 。
5、属于副族元素是: 。
6、属于第八族元素是: 。NaFKFHeCuFe原子结构与元素周期表的关系 ⑴ 电子层数=周期序数(电子层数决定周期数)⑵ 最外层电子数=主族序数=元素的最高正价
(F、O除外)⑶ 核内质子数=原子序数 =原子的核外电子数
(质子数决定元素的种类)1)某主族元素的负一价阴离子核外有四个电子层,该元素在周期表中的位置是 。
2)某主族元素的正一价阳离子核外有四个电子层,该元素在周期表中的位置是: 。
3)A+ B-具有相同的电子层排布,则它们是否是同一周期的元素 。若A是第三周期元素,则B是 。课堂练习第五周期、ⅠA族第四周期、 Ⅶ A族不是第二周期Ⅶ A元素(氟元素)谢谢!
元素周期律和元素周期表1、原子核的构成2、核外电子排布规律温故知新:“五数”、“三素”1-18号原子核外电子排布直方图结论1:随着原子序数的递增,元素原子的最外层电子排布呈现 变化。
周期性 原 子 半 径结论2:随着原子序数的递增,元素原子半径呈现 变化。
周期性 元 素 化 合 价结论3:随着原子序数的递增,元素化合价呈现 变化。
周期性原子序数与化合价的关系10123450123456700-4-3-2-1-4-3-2-10-4-202468原子序数化合价一、元素周期律元素的性质随着原子序数的递增而呈周期性变化(1)最外层电子数排布:从1 → 8(H、He除外)(2)原子半径:大 → 小(除稀有气体外)(3)元素化合价:最高正价+1 → +7
最低负价-4 → -1
稀有气体为0讨论:引起元素性质周期性变化的原因?汇总随着原子序数的递增核外电子排布呈周期性变化元素性质呈周期性变化元素周期律最外层电子数 1→8(K层电子数 1→2)原子半径 大→小(稀有气体元素突然增大)化合价:+1→+7 , -4→-1(稀有气体元素为零)决定了归纳出引起了2、实质:元素性质呈周期性变化是元素原子的核外电子排布周期性变化的必然结果。1-18号原子核外电子排布 利用元素周期律的知识,为1—18号元素编排元素周期表。练习:比较下列微粒的半径大小。Na 、 K 、 S 、O 、 F
Na 、 Na+
Cl 、 Cl-
Ca2+、 Cl-、 S2-(1)同种元素的阳离子半径小于原子半径;
同种元素的阴离子半径大于原子半径。
(2)电子排布相同的离子,核电荷数越大半径越小。
(3)核电荷数不同,电子层数越多,半径越大。 K>Na>S>O>FNa>Na+Cl
1、属于短周期的主族元素是: 。
2、属于长周期的主族元素是: 。
3、属于非金属主族元素是: 。
4、属于零族元素是: 。
5、属于副族元素是: 。
6、属于第八族元素是: 。NaFKFHeCuFe原子结构与元素周期表的关系 ⑴ 电子层数=周期序数(电子层数决定周期数)⑵ 最外层电子数=主族序数=元素的最高正价
(F、O除外)⑶ 核内质子数=原子序数 =原子的核外电子数
(质子数决定元素的种类)1)某主族元素的负一价阴离子核外有四个电子层,该元素在周期表中的位置是 。
2)某主族元素的正一价阳离子核外有四个电子层,该元素在周期表中的位置是: 。
3)A+ B-具有相同的电子层排布,则它们是否是同一周期的元素 。若A是第三周期元素,则B是 。课堂练习第五周期、ⅠA族第四周期、 Ⅶ A族不是第二周期Ⅶ A元素(氟元素)谢谢!
