饮食中的有机化合物
图片预览





文档简介
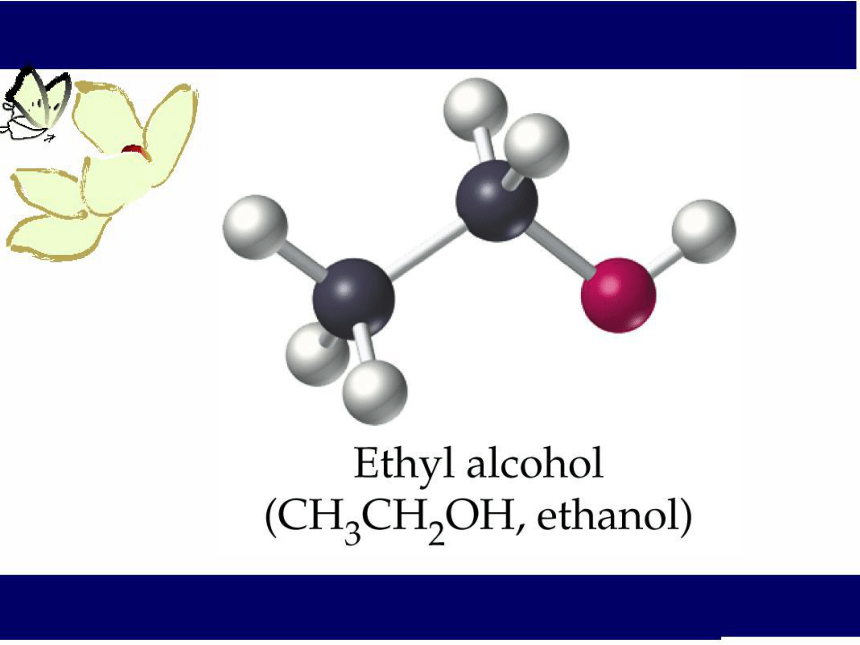
课件16张PPT。乙 醇 饮食中的有机化合物(第一课时)油脂糖蛋白质一、乙醇的物理性质颜 色 :无色透明
状 态 :液态
气 味 :特殊香味
溶解性:跟水以任意比互溶
能够溶解多种无机物和有机物
挥发性:易挥发
沸 点: 78 ℃
密 度: ?普通酒精 → 无水乙醇(99.5%以上)加CaO
蒸馏无水乙醇的制备:1、我们研究物质的化学性质,一般情况下有什么样的方法和
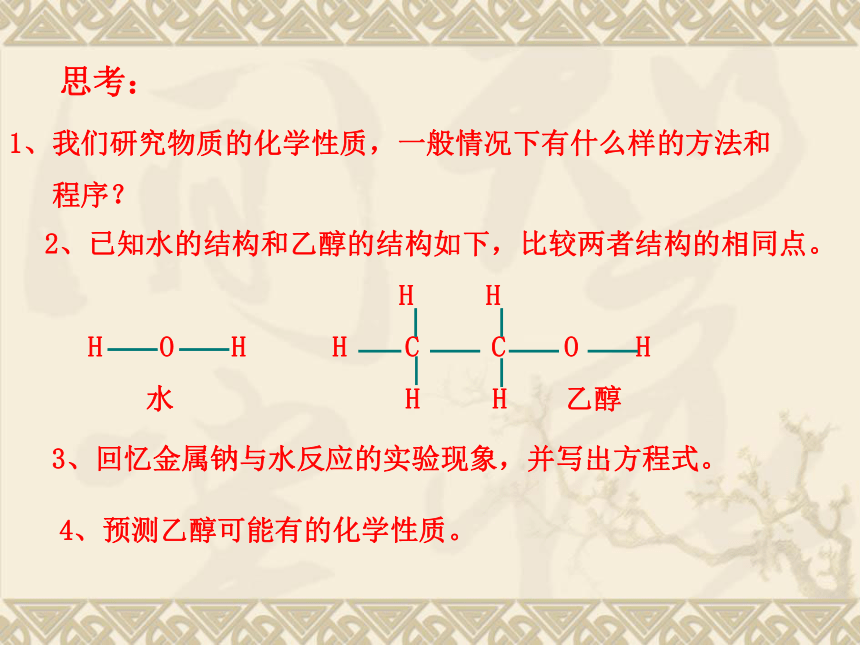
程序?2、已知水的结构和乙醇的结构如下,比较两者结构的相同点。
H H
H O H H C C O H
水 H H 乙醇 思考:3、回忆金属钠与水反应的实验现象,并写出方程式。4、预测乙醇可能有的化学性质。二、乙醇的化学性质
1、乙醇与金属Na的反应:[活动·探究]乙醇与金属钠的反应[方法导引]1、取一只干燥洁净的试管,加入2~3ml无水乙醇。
2、从试剂瓶中取出绿豆粒大小的金属钠,擦干表
面的煤油,将其放到试管中。
3、注意观察金属钠在乙醇中的位置,比较乙醇与
水的密度大小。
4、记录钠在乙醇中反应的实验现象。化学反应方程式:2、乙醇的氧化反应(1)乙醇在空气中燃烧?: 现象:产生淡蓝色火焰,同时放出大量热。 [活动·探究]探究铜在乙醇的催化氧化反应中的作用1取一只干燥洁净的试管,向其中加入3~4ml无水乙醇。
2、将绕成螺旋状的铜丝在酒精灯的外焰上加热。
3、将红热的铜丝插入无水乙醇中。
4、注意观察三个阶段铜丝的颜色:
a、没加热之前铜丝的颜色;
b、加热后铜丝的颜色;
c、伸入无水乙醇后铜丝的颜色。
3、反复几次,小心闻试管中液体产生的气味。
红色→黑色黑色→红色?铜丝在实验中作催化剂 小 结乙醇分子式:
结构式: C2H6O
物理性质:无色、透明,具有特殊香味的液体,密度小于水,沸点低于水,易挥发,可做溶剂。化学性质:与金属反应:氧化反应:2CH3CH2OH+O2 2 CH3CHO+2H2OC2H5 OH + 3 O2
2CO2 +3H2O
点燃Cu 2C2H5OH + 2Na 2CH3CH2ONa + H2用 途1.乙醇可以作燃料;
2.做饮料;
3.作有机溶剂;
4.消毒;
5.做化工原料。思考:
1、看右图,交警在干什么?他利
用了我们学习的什么知识?
2、乙醇汽油的主要成分是什么?
3、我们为什么要使用乙醇汽油?
4、饮酒对人是有利还是有弊?
5、乙醇在工业上还有哪些用途?
6、我们中学生是否应该饮酒呢?
状 态 :液态
气 味 :特殊香味
溶解性:跟水以任意比互溶
能够溶解多种无机物和有机物
挥发性:易挥发
沸 点: 78 ℃
密 度: ?普通酒精 → 无水乙醇(99.5%以上)加CaO
蒸馏无水乙醇的制备:1、我们研究物质的化学性质,一般情况下有什么样的方法和
程序?2、已知水的结构和乙醇的结构如下,比较两者结构的相同点。
H H
H O H H C C O H
水 H H 乙醇 思考:3、回忆金属钠与水反应的实验现象,并写出方程式。4、预测乙醇可能有的化学性质。二、乙醇的化学性质
1、乙醇与金属Na的反应:[活动·探究]乙醇与金属钠的反应[方法导引]1、取一只干燥洁净的试管,加入2~3ml无水乙醇。
2、从试剂瓶中取出绿豆粒大小的金属钠,擦干表
面的煤油,将其放到试管中。
3、注意观察金属钠在乙醇中的位置,比较乙醇与
水的密度大小。
4、记录钠在乙醇中反应的实验现象。化学反应方程式:2、乙醇的氧化反应(1)乙醇在空气中燃烧?: 现象:产生淡蓝色火焰,同时放出大量热。 [活动·探究]探究铜在乙醇的催化氧化反应中的作用1取一只干燥洁净的试管,向其中加入3~4ml无水乙醇。
2、将绕成螺旋状的铜丝在酒精灯的外焰上加热。
3、将红热的铜丝插入无水乙醇中。
4、注意观察三个阶段铜丝的颜色:
a、没加热之前铜丝的颜色;
b、加热后铜丝的颜色;
c、伸入无水乙醇后铜丝的颜色。
3、反复几次,小心闻试管中液体产生的气味。
红色→黑色黑色→红色?铜丝在实验中作催化剂 小 结乙醇分子式:
结构式: C2H6O
物理性质:无色、透明,具有特殊香味的液体,密度小于水,沸点低于水,易挥发,可做溶剂。化学性质:与金属反应:氧化反应:2CH3CH2OH+O2 2 CH3CHO+2H2OC2H5 OH + 3 O2
2CO2 +3H2O
点燃Cu 2C2H5OH + 2Na 2CH3CH2ONa + H2用 途1.乙醇可以作燃料;
2.做饮料;
3.作有机溶剂;
4.消毒;
5.做化工原料。思考:
1、看右图,交警在干什么?他利
用了我们学习的什么知识?
2、乙醇汽油的主要成分是什么?
3、我们为什么要使用乙醇汽油?
4、饮酒对人是有利还是有弊?
5、乙醇在工业上还有哪些用途?
6、我们中学生是否应该饮酒呢?
