化学(鲁科版必修2):《化学反应的快慢和限度》课件
文档属性
| 名称 | 化学(鲁科版必修2):《化学反应的快慢和限度》课件 |

|
|
| 格式 | rar | ||
| 文件大小 | 547.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-02-21 00:00:00 | ||
图片预览







文档简介
课件25张PPT。化学:2.2《化学反应的快慢和限度》课件PPT(鲁科版必修2)1、氢气在氧气中燃烧生成水,水在电解时生成氢气和氧气,H2+O2=H2O是可逆反应。
2、硫酸铜晶体加热变成白色粉末,冷却又变成蓝色,所以无水硫酸铜结合结晶水的反应是可逆反应。
3、氯化铵加热变成氨气和氯化氢气体,两种气体又自发变成氯化铵,氯化铵的分解是可逆反应。阅读教材43页
思考:问题1:下列反应是否为可逆反应?在相同条件下同时向正、反两个方向进行的反应称为可逆反应正向反应:反应物→生成物逆向反应:生成物→反应物问题2:可逆反应
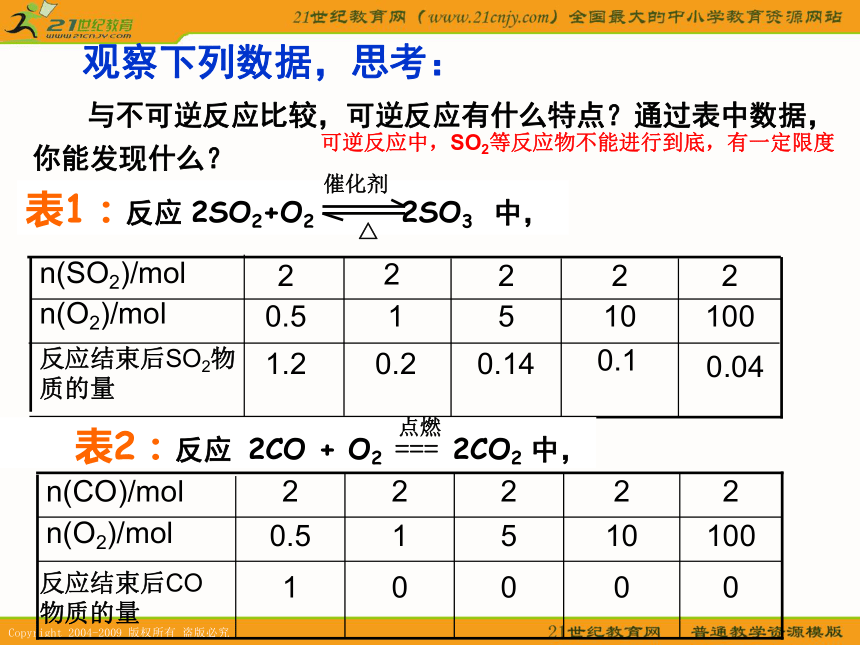
有什么特点?1、可逆反应 观察下列数据,思考:
与不可逆反应比较,可逆反应有什么特点?通过表中数据,你能发现什么?表1:反应 中,0.040.1 0.140.21.2反应结束后SO2物质的量10010510.5n(O2)/mol22222n(SO2)/mol2SO2+O2 2SO3△催化剂可逆反应中,SO2等反应物不能进行到底,有一定限度1、可逆反应可逆反应的特点:
(1)不能进行到底,有一定限度
(2)正反两个方向的反应同时进行18O2 + 2 SO2 2SO3,
此化学反应进行到最后,混合物中
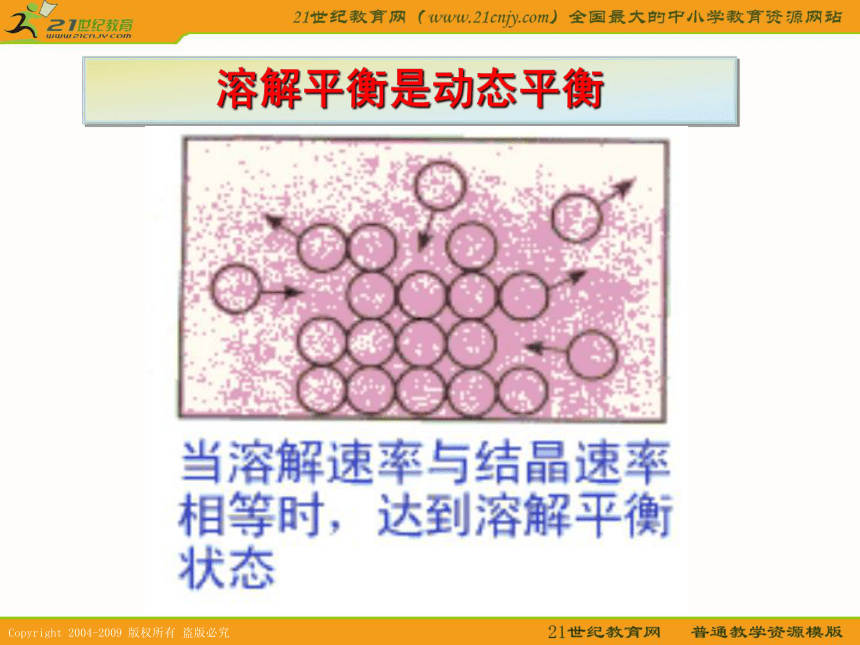
含18O的粒子有 。随堂练习SO2、O2、SO3催化剂△研究素材 在一定条件下,有人将一定质量的蔗糖放入它的饱和水溶液中,过了一天之后再来看时,发现许多小的颗粒不见了,而大的颗粒变得更大,取出干燥后称量,发现质量却与原来一样。1、这里有二个过程,溶解和结晶,在饱和溶液中 这二个过程停止了吗?
2、为什么固体的总质量没变?溶解平衡是动态平衡物质的量浓度物质单位:mol/L探究1:请绘制密闭容器内浓度随时间变化图像和某一物质
正逆反应速率随时间变化图像
探究2:从数据与图像中你得出的该反应进行过程中浓度、
速率随时间变化的特点
探究3:化学反应的限度特点,达到平衡的标志和实质
?时间速率O时间浓度O探究1.请绘制密闭容器内浓度随时间变化图像和某一物质正逆反应速率随时间变化图像ひ正=ひ逆 ≠ 0探究2:从数据与图像中你得出的该反应进行过程中浓度、速率随时间变化的特点反应开始时,反应物浓度最大,正反应速率最大;生成物浓度为零,逆反应速率为零。
随着反应的进行,反应物浓度降低,正反应速率减小;生成物浓度增大,逆反应速率增大。
?从数据与图像中你得出的该反应进行过程中浓度、速率随时间变化的特点新概念 化学平衡 化学平衡状态就是指在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应物和生成物的浓度不再发 生变化的状态概念的理解:前提 :实质 :是一定条件下的可逆反应是ひ正=ひ逆 ≠ 0是反应混合物中各组分的浓度保持不变外观表现: 反应 2NO2 N2O4(红棕色)(无色)说明:正向进行的反应为放热反应思考:能否通过改变反应条件来控制反应进行的程度? 冷水中温度降低,平衡被破坏,新的条件下达到新的平衡NO2浓度减小 ,N2O4浓度增大,颜色变浅。
热水中温度升高,平衡被破坏,在新的平衡 条件下NO2浓度增大 ,N2O4浓度减小,颜色加深。冷水常温热水化学平衡移动 当条件改变时,原来的化学平衡被破坏,并在新的条件下建立新的化学平衡。影响化学平衡移动的因素:温度、 反应物浓度、压强等 人们可以利用化学平衡的移动规律控制化学反应进行的程度,这对于化工生产来说具有十分重要的意义小结 1. 化学平衡的特征(1) 逆—— 可逆反应 变—— 当浓度、压强、温度等条件改变
变时,化学平衡即发生移动(2) 等—— ひ正=ひ逆 ≠ 0(3) 动—— 动态平衡 定—— 平衡状态时,反应混合物中各
组分的浓度保持不变练习1、N2+3H2 2NH3反应达到平衡时,下列说法正确的是( )
A、N2和H2不再化合了
B、N2、H2、NH3的浓度相等
C、平衡建立前体系的总质量在不断变化而平衡建立后体系的总质量就不再变了
D、N2、H2、NH3的浓度保持不变D练习2、在一定温度下,可逆反应:
A(g)+3B(g) 2C(g)达到平衡的标志是( )
A.A生成的速率与C分解的速率相等
B.A、B、C的浓度不再变化
C.单位时间生成n molA同时消耗3n molB
D.A、B、C的分子数之比为1:3:2BC1.用同一种物质来表示反应速率时,
该物质的生成速率与消耗速率相等。
即单位时间内生成与消耗某反应物(生成物)的量相等。2.用不同种物质来
表示反应速率时速
率不一定相等但必
须符合两方面(ii)速率之比=浓度的变化量之比
=物质的量的变化量之比=
化学方程式中相应的化学计量数之比。V正=V逆它的具体含义有两个方面22 3.在一定的温度下,可逆反应:A(g)+ 3B(g)=== 2C(g)达到平衡的标志是
A.C的生成速率与C的分解速率相等。
B.单位时间生成n molA,同时生成3n molB。
C.A、B、C的物质的量浓度保持不变。
D.A、B、C的分子数之比为1 :3 :2 。
A、C、4、下列说法中可以充分说明反应: P(气)+Q(气) R(气)+S(气) , 在恒温下已达平衡状态的是( )
反应容器内压强不随时间变化
P和S的生成速率相等
C. 反应容器内P、Q、R、S四者共存
D.反应容器内总物质的量不随时间而变化B5、下列说法可以证明反应N2+3H2 2NH3 已达平衡状态的是
A.1个N≡N键断裂的同时,有3个H-H键形成
B.1个N≡N键断裂的同时,有3个H-H键断裂
C.1个N≡N键断裂的同时,有6个N-H键断裂
D.1个N≡N键断裂的同时,有6个N-H键形成AC
2、硫酸铜晶体加热变成白色粉末,冷却又变成蓝色,所以无水硫酸铜结合结晶水的反应是可逆反应。
3、氯化铵加热变成氨气和氯化氢气体,两种气体又自发变成氯化铵,氯化铵的分解是可逆反应。阅读教材43页
思考:问题1:下列反应是否为可逆反应?在相同条件下同时向正、反两个方向进行的反应称为可逆反应正向反应:反应物→生成物逆向反应:生成物→反应物问题2:可逆反应
有什么特点?1、可逆反应 观察下列数据,思考:
与不可逆反应比较,可逆反应有什么特点?通过表中数据,你能发现什么?表1:反应 中,0.040.1 0.140.21.2反应结束后SO2物质的量10010510.5n(O2)/mol22222n(SO2)/mol2SO2+O2 2SO3△催化剂可逆反应中,SO2等反应物不能进行到底,有一定限度1、可逆反应可逆反应的特点:
(1)不能进行到底,有一定限度
(2)正反两个方向的反应同时进行18O2 + 2 SO2 2SO3,
此化学反应进行到最后,混合物中
含18O的粒子有 。随堂练习SO2、O2、SO3催化剂△研究素材 在一定条件下,有人将一定质量的蔗糖放入它的饱和水溶液中,过了一天之后再来看时,发现许多小的颗粒不见了,而大的颗粒变得更大,取出干燥后称量,发现质量却与原来一样。1、这里有二个过程,溶解和结晶,在饱和溶液中 这二个过程停止了吗?
2、为什么固体的总质量没变?溶解平衡是动态平衡物质的量浓度物质单位:mol/L探究1:请绘制密闭容器内浓度随时间变化图像和某一物质
正逆反应速率随时间变化图像
探究2:从数据与图像中你得出的该反应进行过程中浓度、
速率随时间变化的特点
探究3:化学反应的限度特点,达到平衡的标志和实质
?时间速率O时间浓度O探究1.请绘制密闭容器内浓度随时间变化图像和某一物质正逆反应速率随时间变化图像ひ正=ひ逆 ≠ 0探究2:从数据与图像中你得出的该反应进行过程中浓度、速率随时间变化的特点反应开始时,反应物浓度最大,正反应速率最大;生成物浓度为零,逆反应速率为零。
随着反应的进行,反应物浓度降低,正反应速率减小;生成物浓度增大,逆反应速率增大。
?从数据与图像中你得出的该反应进行过程中浓度、速率随时间变化的特点新概念 化学平衡 化学平衡状态就是指在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应物和生成物的浓度不再发 生变化的状态概念的理解:前提 :实质 :是一定条件下的可逆反应是ひ正=ひ逆 ≠ 0是反应混合物中各组分的浓度保持不变外观表现: 反应 2NO2 N2O4(红棕色)(无色)说明:正向进行的反应为放热反应思考:能否通过改变反应条件来控制反应进行的程度? 冷水中温度降低,平衡被破坏,新的条件下达到新的平衡NO2浓度减小 ,N2O4浓度增大,颜色变浅。
热水中温度升高,平衡被破坏,在新的平衡 条件下NO2浓度增大 ,N2O4浓度减小,颜色加深。冷水常温热水化学平衡移动 当条件改变时,原来的化学平衡被破坏,并在新的条件下建立新的化学平衡。影响化学平衡移动的因素:温度、 反应物浓度、压强等 人们可以利用化学平衡的移动规律控制化学反应进行的程度,这对于化工生产来说具有十分重要的意义小结 1. 化学平衡的特征(1) 逆—— 可逆反应 变—— 当浓度、压强、温度等条件改变
变时,化学平衡即发生移动(2) 等—— ひ正=ひ逆 ≠ 0(3) 动—— 动态平衡 定—— 平衡状态时,反应混合物中各
组分的浓度保持不变练习1、N2+3H2 2NH3反应达到平衡时,下列说法正确的是( )
A、N2和H2不再化合了
B、N2、H2、NH3的浓度相等
C、平衡建立前体系的总质量在不断变化而平衡建立后体系的总质量就不再变了
D、N2、H2、NH3的浓度保持不变D练习2、在一定温度下,可逆反应:
A(g)+3B(g) 2C(g)达到平衡的标志是( )
A.A生成的速率与C分解的速率相等
B.A、B、C的浓度不再变化
C.单位时间生成n molA同时消耗3n molB
D.A、B、C的分子数之比为1:3:2BC1.用同一种物质来表示反应速率时,
该物质的生成速率与消耗速率相等。
即单位时间内生成与消耗某反应物(生成物)的量相等。2.用不同种物质来
表示反应速率时速
率不一定相等但必
须符合两方面(ii)速率之比=浓度的变化量之比
=物质的量的变化量之比=
化学方程式中相应的化学计量数之比。V正=V逆它的具体含义有两个方面22 3.在一定的温度下,可逆反应:A(g)+ 3B(g)=== 2C(g)达到平衡的标志是
A.C的生成速率与C的分解速率相等。
B.单位时间生成n molA,同时生成3n molB。
C.A、B、C的物质的量浓度保持不变。
D.A、B、C的分子数之比为1 :3 :2 。
A、C、4、下列说法中可以充分说明反应: P(气)+Q(气) R(气)+S(气) , 在恒温下已达平衡状态的是( )
反应容器内压强不随时间变化
P和S的生成速率相等
C. 反应容器内P、Q、R、S四者共存
D.反应容器内总物质的量不随时间而变化B5、下列说法可以证明反应N2+3H2 2NH3 已达平衡状态的是
A.1个N≡N键断裂的同时,有3个H-H键形成
B.1个N≡N键断裂的同时,有3个H-H键断裂
C.1个N≡N键断裂的同时,有6个N-H键断裂
D.1个N≡N键断裂的同时,有6个N-H键形成AC
