第2节 化学反应的快慢和限度
图片预览








文档简介
课件26张PPT。第二章 化学反应与能量第三节
《化学反应的速率
和限度》炸药的爆炸、水溶液中的酸碱反应、感光反应等瞬间即可完成。快!室温下金属生锈、溶洞形成和塑料或橡胶的老化速率按年计,而地壳内煤或石油的形成要经过几十万年的时间。慢结合课本P47的图片,思考:
大家熟悉的化学反应中,哪些进行得快,哪些进行得慢?思考与交流不同的化学反应,快慢不同化学反应有快有慢:判断化学反应进行得快慢的方法有哪些?1、产生气泡的快慢;
2、固体质量的变化;
3、温度的变化;
4、浑浊程度;
5、颜色变化……归纳只能粗略的估计化学反应进行的快慢(定性角度)准确的反应化 学反应的快慢需要统一的定量标准化学反应速率的定义:单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)来表示v=ΔtΔc注意:1. v表示平均反应速率,且为正值;2. Δc表示指定物质的反应前后的变化浓度;3. Δt表示变化所对应的时间;4.浓度常用mol.L-1,时间常用s,min。
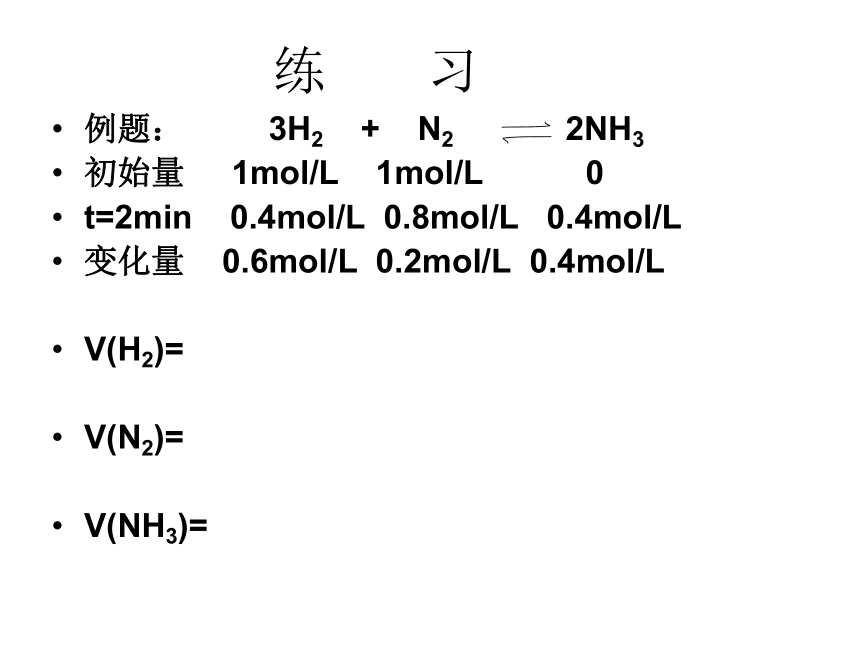
化学反应的速率单位为:mol/(L·min)或mol/(L·s)练 习例题: 3H2 + N2 2NH3
初始量 1mol/L 1mol/L 0
t=2min 0.4mol/L 0.8mol/L 0.4mol/L
变化量 0.6mol/L 0.2mol/L 0.4mol/L
V(H2)=
V(N2)=
V(NH3)=
例题: 3H2 + N2 2NH3
初始量 1mol/L 1mol/L 0
t=2min 0.4mol/L 0.8mol/L 0.4mol/L
变化量 0.6mol/L 0.2mol/L 0.4mol/L
V(H2)=
V(N2)=
V(NH3)=
化学反应速率之比等于方程式中它们的计量数之比。化学反应速率的特点①同一反应,可用不同物质在单位时间
内浓度的变化来表示,但必须指明是
用哪种反应物或哪种生成物来表示。
②用不同物质在单位时间内浓度变化表
示时,速率比等于方程式中的系数比
③均取正值,且是某一段时间内的平均
速率。
化学反应速率1.化学反应速率是用来衡量化学反应过程进行快
慢程度的一个物理量。3.化学反应速率是表示一段时间内的平均速率而
不是瞬时速率。4.表示一个化学反应的反应速率必需指明是
那种物质的反应速率。2.化学反应速率均取正值。5.固体物质或纯液体物质的物质的量浓度为常数,固它们的化学反应速率视为常数。6.用不同的物质表示的化学反应速率一般是不同的。
同一化学反应中,各物质的化学反应速率之比等于
其计量数之比。
二、影响化学反应速率的因素
实验探究等质量(金属颗粒大小相同)的镁条和铝条分别置于两支加有3mL 3mol/L 稀硫酸溶液的试管中。观察产生气泡的快慢;实验现象:实验结论:动手时间 镁比铝的反应剧烈,产生气泡快镁比铝反应速率快
影响化学反应速率的内因是:
物质本身性质(即物质结构)外部因素:实验2-5产生气泡速率增大,
带火星火柴 复燃升高温度,
反应速率增大有气泡冒出产生气泡速率减小降低温度,
反应速率减小实验2-6气泡冒出速率增大气泡冒出速率增大有气泡冒出,较慢MnO2能加快
反应速率FeCl3能加快
反应速率无催化剂
反应较慢外部因素:影响化学反应速率的条件除温度和催化剂以外,还有哪些条件?1.为什么要将食物存放在温度低的地方(如电冰箱)?
2.实验时,通常要将两种块状或颗粒状的固体药品研细
,并混匀后再进行化学实验,原因是什么?
3.人们常把固体试剂溶于水配成溶液后再进行化学实验
原因是什么?
4.实验常用约30%左右的硫酸溶液(约3.7mol/L)与锌粒
反应制取氢气,当反应进行一段时间后,气泡变得稀少
了(锌粒还有剩余),如果添加适当浓度的硫酸溶液到
反应溶液中,气泡又会重新增多起来。原因是什么?规律:增大浓度反应速率加快,减小浓度反应速率减慢(只适用于气体和溶液)。浓度的影响原因:增加浓度,单位体积粒子总数增加,增加了粒子之间的碰撞,有效碰撞次数增加,反应速率加快。5.实验室制取氢气时,是用粗锌好还是用纯锌好,为什么?形成原电池可以加快反应速率。形成原电池4.实验室进行化学反应 时,常常把一些固体物质溶于水配成溶液再进行反应。为什么?增大固体表面积可以加快反应速率(接触充分)固体表面积离子反应速率快,瞬间完成。(粒子的接触充分)3.块状CaCO3、粉末状CaCO3与0.1 mol/L的盐酸反应谁快谁慢?为什么?一.化学反应的速率:定性表示:定量表示:快或慢V=ΔcΔt=c2–c1t2–t11.表示二.影响化学反应速率的因素:1.决定因素: 参与反应的物质的自身性质(内因)2.影响因素:(1)温度:升温反应速率加快,降温反应速率减慢; (2)浓度:增大浓度反应速率加快,反之,减慢;(3)催化剂:一般是加快化学反应速率。【课堂小结】(4)其他:压强、固体表面积、光、射线和原电池等
下列过程中,需要加快化学反应速率的是
( )A.钢铁腐蚀 B.食物腐坏
C.炼钢 D.塑料老化C一个小问题在相同条件下,等质量(金属颗粒大小相同)的下列金属与足量1mol/L 盐酸反应时,
速率最快的是
A 镁 B 铝
C 钠 D 铁课后作业课本P53
1. 4. 5(作业本)
练习册自学P49 神奇的催化剂 催化剂能极大地改变反应速率,而自身的
组成、化学性质和质量在反应前后不发生
变化,具有高度的选择性(或专一性)物理性质呢?改变吗?再见
《化学反应的速率
和限度》炸药的爆炸、水溶液中的酸碱反应、感光反应等瞬间即可完成。快!室温下金属生锈、溶洞形成和塑料或橡胶的老化速率按年计,而地壳内煤或石油的形成要经过几十万年的时间。慢结合课本P47的图片,思考:
大家熟悉的化学反应中,哪些进行得快,哪些进行得慢?思考与交流不同的化学反应,快慢不同化学反应有快有慢:判断化学反应进行得快慢的方法有哪些?1、产生气泡的快慢;
2、固体质量的变化;
3、温度的变化;
4、浑浊程度;
5、颜色变化……归纳只能粗略的估计化学反应进行的快慢(定性角度)准确的反应化 学反应的快慢需要统一的定量标准化学反应速率的定义:单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)来表示v=ΔtΔc注意:1. v表示平均反应速率,且为正值;2. Δc表示指定物质的反应前后的变化浓度;3. Δt表示变化所对应的时间;4.浓度常用mol.L-1,时间常用s,min。
化学反应的速率单位为:mol/(L·min)或mol/(L·s)练 习例题: 3H2 + N2 2NH3
初始量 1mol/L 1mol/L 0
t=2min 0.4mol/L 0.8mol/L 0.4mol/L
变化量 0.6mol/L 0.2mol/L 0.4mol/L
V(H2)=
V(N2)=
V(NH3)=
例题: 3H2 + N2 2NH3
初始量 1mol/L 1mol/L 0
t=2min 0.4mol/L 0.8mol/L 0.4mol/L
变化量 0.6mol/L 0.2mol/L 0.4mol/L
V(H2)=
V(N2)=
V(NH3)=
化学反应速率之比等于方程式中它们的计量数之比。化学反应速率的特点①同一反应,可用不同物质在单位时间
内浓度的变化来表示,但必须指明是
用哪种反应物或哪种生成物来表示。
②用不同物质在单位时间内浓度变化表
示时,速率比等于方程式中的系数比
③均取正值,且是某一段时间内的平均
速率。
化学反应速率1.化学反应速率是用来衡量化学反应过程进行快
慢程度的一个物理量。3.化学反应速率是表示一段时间内的平均速率而
不是瞬时速率。4.表示一个化学反应的反应速率必需指明是
那种物质的反应速率。2.化学反应速率均取正值。5.固体物质或纯液体物质的物质的量浓度为常数,固它们的化学反应速率视为常数。6.用不同的物质表示的化学反应速率一般是不同的。
同一化学反应中,各物质的化学反应速率之比等于
其计量数之比。
二、影响化学反应速率的因素
实验探究等质量(金属颗粒大小相同)的镁条和铝条分别置于两支加有3mL 3mol/L 稀硫酸溶液的试管中。观察产生气泡的快慢;实验现象:实验结论:动手时间 镁比铝的反应剧烈,产生气泡快镁比铝反应速率快
影响化学反应速率的内因是:
物质本身性质(即物质结构)外部因素:实验2-5产生气泡速率增大,
带火星火柴 复燃升高温度,
反应速率增大有气泡冒出产生气泡速率减小降低温度,
反应速率减小实验2-6气泡冒出速率增大气泡冒出速率增大有气泡冒出,较慢MnO2能加快
反应速率FeCl3能加快
反应速率无催化剂
反应较慢外部因素:影响化学反应速率的条件除温度和催化剂以外,还有哪些条件?1.为什么要将食物存放在温度低的地方(如电冰箱)?
2.实验时,通常要将两种块状或颗粒状的固体药品研细
,并混匀后再进行化学实验,原因是什么?
3.人们常把固体试剂溶于水配成溶液后再进行化学实验
原因是什么?
4.实验常用约30%左右的硫酸溶液(约3.7mol/L)与锌粒
反应制取氢气,当反应进行一段时间后,气泡变得稀少
了(锌粒还有剩余),如果添加适当浓度的硫酸溶液到
反应溶液中,气泡又会重新增多起来。原因是什么?规律:增大浓度反应速率加快,减小浓度反应速率减慢(只适用于气体和溶液)。浓度的影响原因:增加浓度,单位体积粒子总数增加,增加了粒子之间的碰撞,有效碰撞次数增加,反应速率加快。5.实验室制取氢气时,是用粗锌好还是用纯锌好,为什么?形成原电池可以加快反应速率。形成原电池4.实验室进行化学反应 时,常常把一些固体物质溶于水配成溶液再进行反应。为什么?增大固体表面积可以加快反应速率(接触充分)固体表面积离子反应速率快,瞬间完成。(粒子的接触充分)3.块状CaCO3、粉末状CaCO3与0.1 mol/L的盐酸反应谁快谁慢?为什么?一.化学反应的速率:定性表示:定量表示:快或慢V=ΔcΔt=c2–c1t2–t11.表示二.影响化学反应速率的因素:1.决定因素: 参与反应的物质的自身性质(内因)2.影响因素:(1)温度:升温反应速率加快,降温反应速率减慢; (2)浓度:增大浓度反应速率加快,反之,减慢;(3)催化剂:一般是加快化学反应速率。【课堂小结】(4)其他:压强、固体表面积、光、射线和原电池等
下列过程中,需要加快化学反应速率的是
( )A.钢铁腐蚀 B.食物腐坏
C.炼钢 D.塑料老化C一个小问题在相同条件下,等质量(金属颗粒大小相同)的下列金属与足量1mol/L 盐酸反应时,
速率最快的是
A 镁 B 铝
C 钠 D 铁课后作业课本P53
1. 4. 5(作业本)
练习册自学P49 神奇的催化剂 催化剂能极大地改变反应速率,而自身的
组成、化学性质和质量在反应前后不发生
变化,具有高度的选择性(或专一性)物理性质呢?改变吗?再见
