高一 必修二 第一章第三节 元素周期表的应用 第一课时
文档属性
| 名称 | 高一 必修二 第一章第三节 元素周期表的应用 第一课时 |

|
|
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-02-18 00:00:00 | ||
图片预览






文档简介
第三节
元素周期表的应用
高中化学鲁科版高一《化学2》
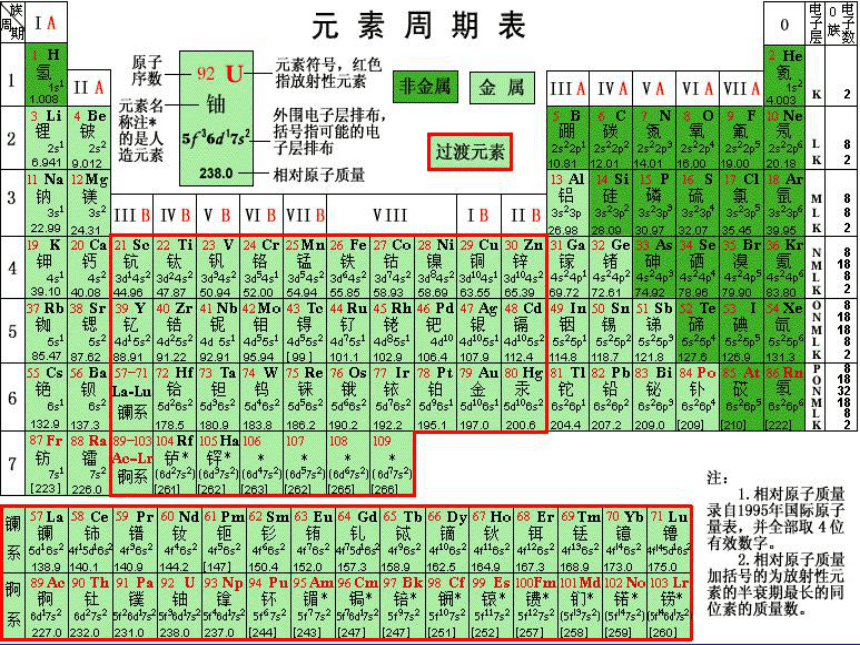
相对原子质量 原子
体积 单质
密度 二氧化物 四氯化物
密度 体积 沸点 密度 体积
类
硅 72 13 5.5 4.7 22 <100 ℃ 1.9 113
锗 72.6 13.22 5.47 4.703 22.16 86℃ 1.887
113. 35
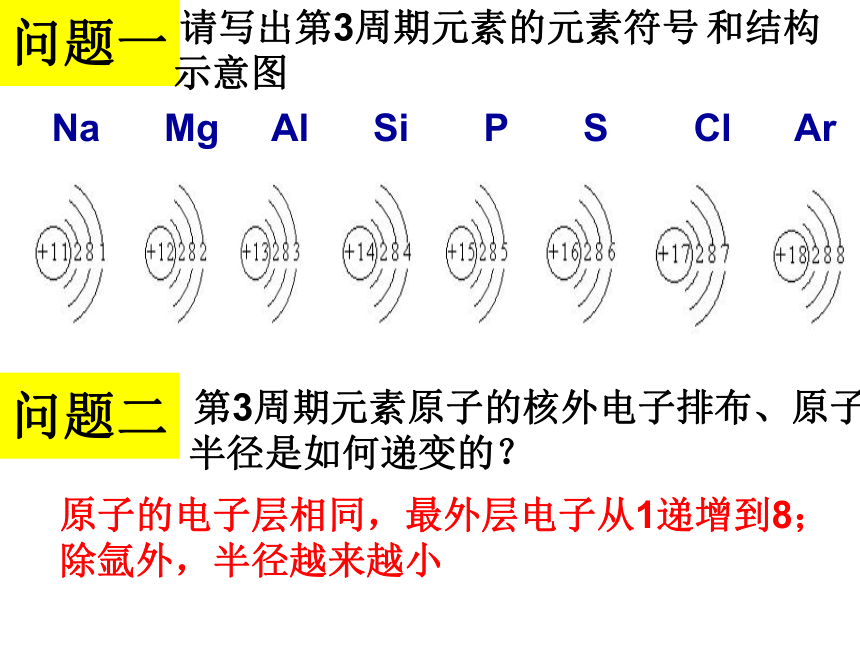
问题一
请写出第3周期元素的元素符号 和结构
示意图
问题二
第3周期元素原子的核外电子排布、原子
半径是如何递变的?
原子的电子层相同,最外层电子从1递增到8;
除氩外,半径越来越小
预测结论 寻找方法
1、尝试用元素原子的核外电子排布规律预测第3周期元素原子失电子或得电子能力的相对强弱。
2、比较元素原子失电子能力的方法有哪些?
(阅读教材21页方法导引)
第三周期元素(氩除外)从左到右,原子失电子
能力逐渐减弱,得电子能力逐渐增强
a、单质与水反应置换氢气的难易程度
b、单质与酸反应置换氢气的难易程度
c、最高价氧化物对应的水化物的碱性的强弱
3、如何用实验验证同周期中钠、镁、铝三种金属失电子能力的相对强弱,写出你的实验方案?
设计方案 探究事实
方案模板:
取…………..,加入………….,操作…………
预测的现象……………..
成果展示台
[实验一]Mg、Al和水的反应:
分别取一小段镁带、铝条,用砂纸去掉表面的氧
化膜,放入两支小试管中,加入1 ml水,并滴
入两滴酚酞溶液。观察现象。过一会儿,分别用
酒精灯给两试管加热至沸腾,并移开酒精灯,再
观察现象。
[实验二] Mg、Al和酸的反应:
取一小段镁带和一小片铝,用砂纸磨去表面的氧化
膜,分别放入两支试管中。向试管中各加入1mL
1mol/L盐酸。观察现象。
[实验三] Mg、Al和酸的反应:
试管5中 + MgCl2溶液+NaOH溶液,观察现象。
试管6中 + AlCl3溶液+NaOH溶液,观察现象
注意实验安全,每组选派一名同学作为“安全员”
试剂的取用量不易太多
试管受热时先均匀受热,然后局部受热,管口不要对着同学
小组成员之间应该相互尊重,积极参与,同时也要善于倾听别人意见,做好实验记录
每个小组须指派一名语言表达能力较强的同学对本组实验的现象和结论作全班发言
时间约5分钟
温馨提示
实验方案
[实验二] Mg、Al和酸的反应:
试管3和4分别取一小段镁带、铝条,用砂纸去掉
表面的氧化膜,加入2~3 ml1mol/L盐酸。观察现象。
[实验一]Mg、Al和水的反应:
试管1和2分别取一小段镁带、铝条,用砂纸去掉
表面的氧化膜,加入2~3 ml水,并滴入两滴酚酞。
观察现象。
分别用酒精灯给两试管加热至沸腾,再观察现象。
[实验三] Mg(OH)2、Al(0H)3的碱性:
试管5中 + MgCl2溶液+NaOH溶液,观察现象。
试管6中 + AlCl3溶液+NaOH溶液,观察现象
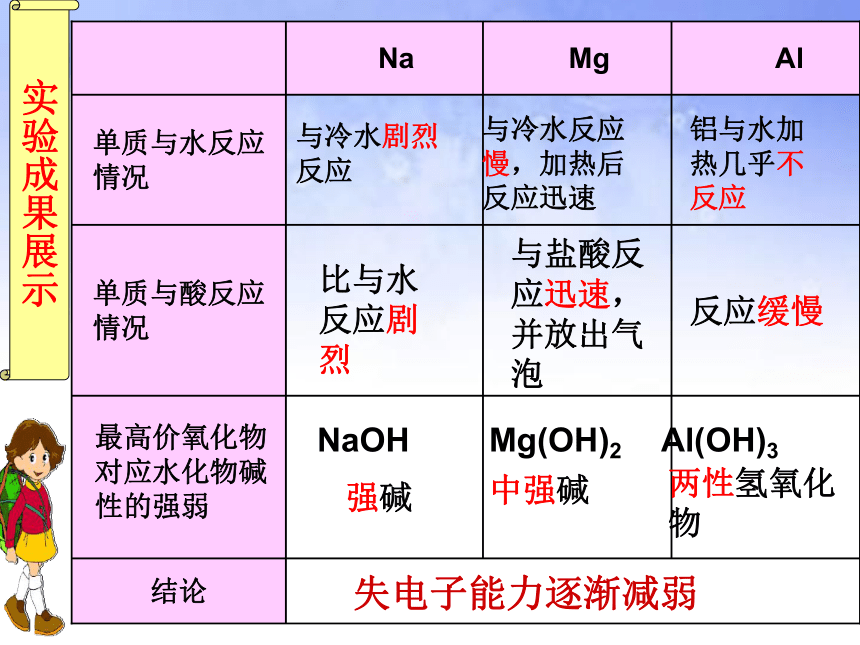
与冷水剧烈反应
与冷水反应慢,加热后反应迅速
铝与水加热几乎不反应
与盐酸反应迅速,并放出气泡
反应缓慢
强碱
中强碱
两性氢氧化物
比与水反应剧烈
最高价氧化物对应水化物碱性的强弱
失电子能力逐渐减弱
NaOH
Mg(OH)2
Al(OH)3
实验成果展示
知识存盘
同周期元素(稀有气体除外),从左到右,元素原子失电子能力越来越弱!
问题三
如何判断硅、磷、硫、氯四种非金属元素原子得电子能力的相对强弱呢?
SiO2
P2O5
SO3
Cl2O7
H4SiO4
H3PO4
H2SO4
HClO4
弱酸
中强酸
强酸
最强酸
高温
加热
加热
点燃或光照
SiH4
PH3
H2S
HCl
得电子能力逐渐增强
14Si 15P 16S 17Cl
对应最高价氧化物
最高价氧化物的
水化物
最高价含氧酸
酸性强弱
单质与H2反应条件
气态氢化物
及稳定性
结论
知识存盘
同周期元素(稀有气体除外),从左到右,元素原子得电子能力越来越强!
课堂小结
从1递增到7
减小
失e-能力减,得e-能力增
碱性减弱,酸性增强
增强
增强
减弱
最高正+1到+7,-4到-1
小试牛刀
完成导学案
《学以致用》环节
1、(1)错(2)对(3)错(4)错
小试牛刀
2、B
3、C
4、AC
5、(1)钠 铝 氯(2)HClO4
(3)H+ + OH- = H2O
Al(OH)3 + H+ = Al3+ + 3H2O
1、(1)错(2)对(3)错(4)错
2、BC
3、C
1、(1)错(2)对(3)错(4)错
布置作业
1、结合本节课的学习成果,查阅有关资料,你对元素原子得失电子相对强弱还能总结出哪些判断依据?
2、教材P28页第5题并预习第二课时的内容
1、判断下列说法是否正确:
(1) C、N、O、F原子半径依次增大
(2) PH3、H2S、HCl 稳定性依次增强
(3) HClO比H2SO4酸性强。
(4)甲、乙两种非金属元素与金属钠反应时, 甲得电子的数目多,所以甲活泼。
小试牛刀
错
对
错
错
2、下列事实能说明得电子能力Na>Mg的是:( )
A、Na最外层有一个电子,Mg最外层有2个电子;
B、Na能与冷水反应,而Mg不能;
C、碱性 NaOH >Mg(OH)2
D、 Na能从MgCl2 的溶液中把Mg置换出来;
小试牛刀
BC
3、已知X、Y、Z三种元素原子的电子层数相同,且原子序数XA、原子半径XB、得电子能力X、Y、Z逐渐减弱
C、最高价含氧酸酸性H3XO4D、气态氢化物的稳定性按照X、Y、Z顺序
减弱
C
小试牛刀
4、按C、N、O、F的顺序,下列递变规律错误的是( )
A、原子半径逐渐增大
B、元素原子得电子能力逐渐增强
C、最高正化合价逐渐增大
D、气态氢化物稳定性逐渐增大
小试牛刀
BC
5、X、Y、Z三种元素的原子具有相同的电子层数,而Y的核电荷数比X大2,Z的质子数比Y多4,1摩尔X的单质跟足量的酸起反应能置换出1克氢气,这时X转为具有氖原子相同的电子层结构的离子,根据上述条件推测:
(1) 写出三种元素的名称: X ?????? Y??????? Z ???????? ;
(2写出Z最高价氧化物对应水化物的化学式???????
(3) X、Y最高价氧化物对应水化物跟的z气态氢化物的水溶液反应的离子方程式分别为
① ,② 。
小试牛刀
元素周期表的应用
高中化学鲁科版高一《化学2》
相对原子质量 原子
体积 单质
密度 二氧化物 四氯化物
密度 体积 沸点 密度 体积
类
硅 72 13 5.5 4.7 22 <100 ℃ 1.9 113
锗 72.6 13.22 5.47 4.703 22.16 86℃ 1.887
113. 35
问题一
请写出第3周期元素的元素符号 和结构
示意图
问题二
第3周期元素原子的核外电子排布、原子
半径是如何递变的?
原子的电子层相同,最外层电子从1递增到8;
除氩外,半径越来越小
预测结论 寻找方法
1、尝试用元素原子的核外电子排布规律预测第3周期元素原子失电子或得电子能力的相对强弱。
2、比较元素原子失电子能力的方法有哪些?
(阅读教材21页方法导引)
第三周期元素(氩除外)从左到右,原子失电子
能力逐渐减弱,得电子能力逐渐增强
a、单质与水反应置换氢气的难易程度
b、单质与酸反应置换氢气的难易程度
c、最高价氧化物对应的水化物的碱性的强弱
3、如何用实验验证同周期中钠、镁、铝三种金属失电子能力的相对强弱,写出你的实验方案?
设计方案 探究事实
方案模板:
取…………..,加入………….,操作…………
预测的现象……………..
成果展示台
[实验一]Mg、Al和水的反应:
分别取一小段镁带、铝条,用砂纸去掉表面的氧
化膜,放入两支小试管中,加入1 ml水,并滴
入两滴酚酞溶液。观察现象。过一会儿,分别用
酒精灯给两试管加热至沸腾,并移开酒精灯,再
观察现象。
[实验二] Mg、Al和酸的反应:
取一小段镁带和一小片铝,用砂纸磨去表面的氧化
膜,分别放入两支试管中。向试管中各加入1mL
1mol/L盐酸。观察现象。
[实验三] Mg、Al和酸的反应:
试管5中 + MgCl2溶液+NaOH溶液,观察现象。
试管6中 + AlCl3溶液+NaOH溶液,观察现象
注意实验安全,每组选派一名同学作为“安全员”
试剂的取用量不易太多
试管受热时先均匀受热,然后局部受热,管口不要对着同学
小组成员之间应该相互尊重,积极参与,同时也要善于倾听别人意见,做好实验记录
每个小组须指派一名语言表达能力较强的同学对本组实验的现象和结论作全班发言
时间约5分钟
温馨提示
实验方案
[实验二] Mg、Al和酸的反应:
试管3和4分别取一小段镁带、铝条,用砂纸去掉
表面的氧化膜,加入2~3 ml1mol/L盐酸。观察现象。
[实验一]Mg、Al和水的反应:
试管1和2分别取一小段镁带、铝条,用砂纸去掉
表面的氧化膜,加入2~3 ml水,并滴入两滴酚酞。
观察现象。
分别用酒精灯给两试管加热至沸腾,再观察现象。
[实验三] Mg(OH)2、Al(0H)3的碱性:
试管5中 + MgCl2溶液+NaOH溶液,观察现象。
试管6中 + AlCl3溶液+NaOH溶液,观察现象
与冷水剧烈反应
与冷水反应慢,加热后反应迅速
铝与水加热几乎不反应
与盐酸反应迅速,并放出气泡
反应缓慢
强碱
中强碱
两性氢氧化物
比与水反应剧烈
最高价氧化物对应水化物碱性的强弱
失电子能力逐渐减弱
NaOH
Mg(OH)2
Al(OH)3
实验成果展示
知识存盘
同周期元素(稀有气体除外),从左到右,元素原子失电子能力越来越弱!
问题三
如何判断硅、磷、硫、氯四种非金属元素原子得电子能力的相对强弱呢?
SiO2
P2O5
SO3
Cl2O7
H4SiO4
H3PO4
H2SO4
HClO4
弱酸
中强酸
强酸
最强酸
高温
加热
加热
点燃或光照
SiH4
PH3
H2S
HCl
得电子能力逐渐增强
14Si 15P 16S 17Cl
对应最高价氧化物
最高价氧化物的
水化物
最高价含氧酸
酸性强弱
单质与H2反应条件
气态氢化物
及稳定性
结论
知识存盘
同周期元素(稀有气体除外),从左到右,元素原子得电子能力越来越强!
课堂小结
从1递增到7
减小
失e-能力减,得e-能力增
碱性减弱,酸性增强
增强
增强
减弱
最高正+1到+7,-4到-1
小试牛刀
完成导学案
《学以致用》环节
1、(1)错(2)对(3)错(4)错
小试牛刀
2、B
3、C
4、AC
5、(1)钠 铝 氯(2)HClO4
(3)H+ + OH- = H2O
Al(OH)3 + H+ = Al3+ + 3H2O
1、(1)错(2)对(3)错(4)错
2、BC
3、C
1、(1)错(2)对(3)错(4)错
布置作业
1、结合本节课的学习成果,查阅有关资料,你对元素原子得失电子相对强弱还能总结出哪些判断依据?
2、教材P28页第5题并预习第二课时的内容
1、判断下列说法是否正确:
(1) C、N、O、F原子半径依次增大
(2) PH3、H2S、HCl 稳定性依次增强
(3) HClO比H2SO4酸性强。
(4)甲、乙两种非金属元素与金属钠反应时, 甲得电子的数目多,所以甲活泼。
小试牛刀
错
对
错
错
2、下列事实能说明得电子能力Na>Mg的是:( )
A、Na最外层有一个电子,Mg最外层有2个电子;
B、Na能与冷水反应,而Mg不能;
C、碱性 NaOH >Mg(OH)2
D、 Na能从MgCl2 的溶液中把Mg置换出来;
小试牛刀
BC
3、已知X、Y、Z三种元素原子的电子层数相同,且原子序数X
C、最高价含氧酸酸性H3XO4
减弱
C
小试牛刀
4、按C、N、O、F的顺序,下列递变规律错误的是( )
A、原子半径逐渐增大
B、元素原子得电子能力逐渐增强
C、最高正化合价逐渐增大
D、气态氢化物稳定性逐渐增大
小试牛刀
BC
5、X、Y、Z三种元素的原子具有相同的电子层数,而Y的核电荷数比X大2,Z的质子数比Y多4,1摩尔X的单质跟足量的酸起反应能置换出1克氢气,这时X转为具有氖原子相同的电子层结构的离子,根据上述条件推测:
(1) 写出三种元素的名称: X ?????? Y??????? Z ???????? ;
(2写出Z最高价氧化物对应水化物的化学式???????
(3) X、Y最高价氧化物对应水化物跟的z气态氢化物的水溶液反应的离子方程式分别为
① ,② 。
小试牛刀
