高一 鲁科版 必修二第一章 第三节 元素周期表的应用(17张)
文档属性
| 名称 | 高一 鲁科版 必修二第一章 第三节 元素周期表的应用(17张) |

|
|
| 格式 | zip | ||
| 文件大小 | 829.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-02-19 00:00:00 | ||
图片预览





文档简介
【问题组一】
请回忆第三周期包含哪些金属元素,从氧化还原反应的角度看,金属单质在反应中表现还原性还是氧化性?其实质是什么?
根据知识储备和元素周期律预测Na、Mg、Al失电子能力的大小的强弱?
Na、Mg、Al,金属单质通常表现还原性,实质是,金属元素失电子
元素失电子能力Na>Mg > Al
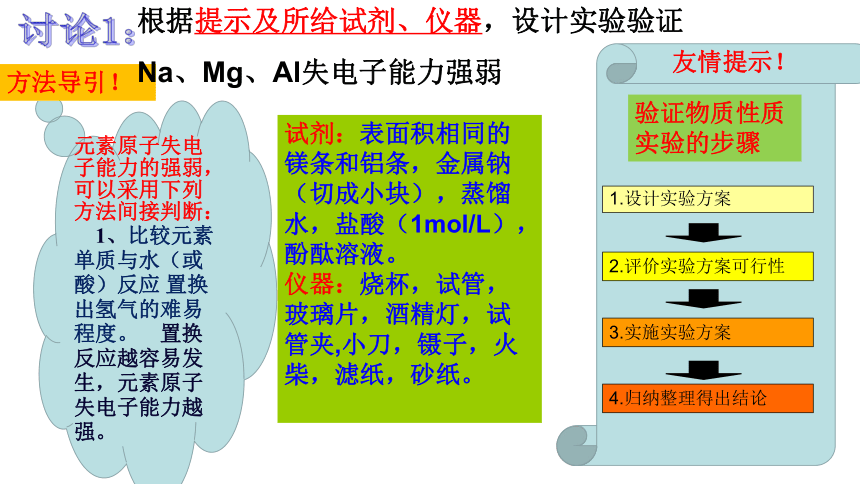
验证物质性质实验的步骤
根据提示及所给试剂、仪器,设计实验验证
Na、Mg、Al失电子能力强弱
试剂:表面积相同的镁条和铝条,金属钠(切成小块),蒸馏水,盐酸(1mol/L),酚酞溶液。
仪器:烧杯,试管,玻璃片,酒精灯,试管夹,小刀,镊子,火柴,滤纸,砂纸。
将钠、镁分别和水反应,看它们反应的条件、剧烈程度,比较钠、镁的得失电子能力。
将镁和铝分别与盐酸溶液反应,比较它们置换出氢的难易。
根据导学案的实验卡
我们开始动手操作吧!
第一组:
向小烧杯中加入少量蒸馏水→切一黄豆粒大小钠 投入水中→观察现象→滴加酚酞
向试管中加入打磨过的镁条→向其中加入约2滴管蒸馏水→观察现象(若现象不明显可以加热)→滴加酚酞
第二组:
向2支试管中分别加入打磨过的镁条和铝条→向其中加入约2滴管盐酸→观察现象
友情提示:做好实验记录哦!!!
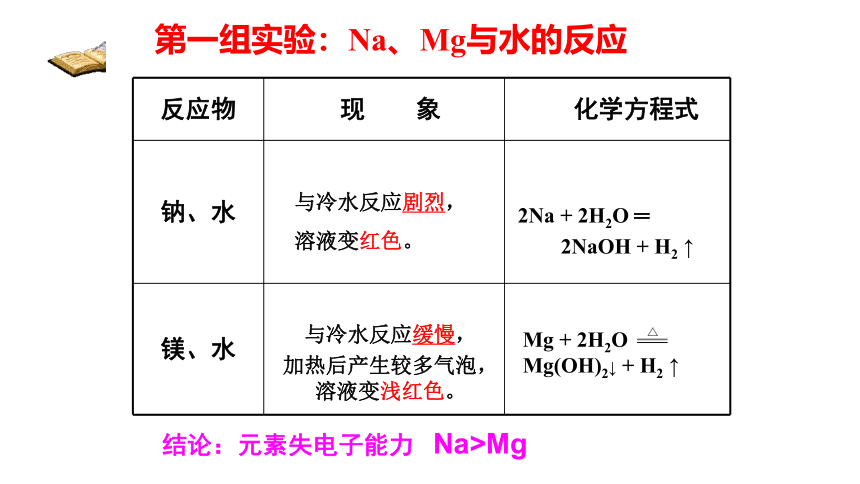
第一组实验:Na、Mg与水的反应
结论:元素失电子能力 Na>Mg
反应物 现 象 化学方程式
钠、水
镁、水
第二组实验:Mg、Al与盐酸反应
结论:元素失电子能力Mg > Al
结论:元素失电子能力Na>Mg > Al
反 应 物 现 象 离子方程式
Mg、盐酸
Al、盐酸
MgCI2溶液中有白色沉淀生成
AlCI3溶液开始有白色沉淀生成,后沉淀消失
NaOH>Mg(OH)2>Al(OH)3
2、比较元素最高价氧化物对应水化物的碱性强弱。
一般说来,碱性越强,元素原子失电子的能力越强。
方法导引
Na > Mg > Al
碱性强弱:
失电子能力强弱:
根据提示,如何设计实验验证镁铝氢氧化物碱性强弱?
分别向等体积的MgCI2溶液、AlCI3溶液中滴加NaOH溶液至过量
实验方案
动手实验 观察现象
结论
从结构认识同周期元素性质的递变
分析: Na、Mg 、Al原子结构的递变如何引起元素失电子能力的减弱。
Na
Mg
Al
从左到右,核电荷数逐渐 ,
最外层电子数逐渐 ,
原子半径逐渐 ,
失电子能力逐渐 。
增多
增多
减小
减弱
小结1:
请回忆第三周期包含哪些非金属元素,从氧化还原反应的角度看,非金属元素单质在化学反应中主要表现还原性还是氧化性?
以S、Cl2 为例比较共性中的差异,你能从中体会S、Cl元素得电子能力有何不同吗?请用方程式来说明。
根据课本P22“方法导引”说说:常用于比较非金属元素原子得电子能力的强弱的实验依据有哪些?
【问题组二】 Si P S Cl元素原子得电子能力强弱的比较
1、比较元素单质与氢气化合的难易程度。
2、比较气态氢化物的稳定性
3、比较元素最高价氧化物对应水化物(最高价含氧酸)的酸性强弱。
高温、少量反应
光照或点燃爆炸
磷蒸气、相当困难
加热、较高温度分解
原子序数 14 15 16 17
元素符号 Si P S Cl
单质与H2化合的难易
气态氢化物的稳定性
最高价氧化物对应水化物的酸性
从结构认识同周期元素性质的递变
Si
P
S
Cl
交流研讨:
1. Si、P、S、Cl原子结构如何递变引起元素得电子能力的增强。
从左到右,核电荷数逐渐 ,
最外层电子数逐渐 ,
原子半径逐渐 ,
得电子能力逐渐 。
增多
减小
增多
增强
小结2:
稀有气体元素
失电子能力逐渐减弱,得电子能力逐渐增强
同周期元素性质的递变规律:
金属单质与水(或酸)反应 置换出氢气越来越难。
非金属单质与氢气反应越来越容易,气态氢化物的稳定性增强。
最高价氧化物对应水化物的酸性增强 碱性减弱
原子序数 11 12 13 14 15 16 17 18
元素符号 Na Mg Al Si P S Cl Ar
单质和水(或酸)反应情况 冷水剧烈 热水较快
盐酸剧烈 盐酸较快
【课堂巩固练习】----牛刀小试
1、用元素符号表达原子序数11~18号的元素的有关问题:
(1)除稀有气体外,
原子半径最大的是 ;
原子半径最小的是 ;
(2)最高价氧化物的水化物
碱性最强的是 ;
酸性最强的是 ;
呈两性的是 ;
(4)能形成气态氢化物且最稳定的是 .
Cl
Na
Cl
Al
Cl
Na
2、按C、N、O、F的顺序,下列递变规律正确的是( )
A、原子半径逐渐增大
B、元素原子得电子能力逐渐减弱
C、最高正化合价逐渐增大
D、气态氢化物稳定性逐渐增大
D
3、下述事实能够说明硫原子得电子能力比氯弱的是( )
A、硫酸比盐酸稳定
B、氯化氢比硫化氢稳定
C、盐酸酸性比氢硫酸强
D、亚硫酸酸性比高氯酸弱
B
作业:
1、预习第二部分:预测同主族元素的
性质。
2、完成《导学案课后巩固区》。
请回忆第三周期包含哪些金属元素,从氧化还原反应的角度看,金属单质在反应中表现还原性还是氧化性?其实质是什么?
根据知识储备和元素周期律预测Na、Mg、Al失电子能力的大小的强弱?
Na、Mg、Al,金属单质通常表现还原性,实质是,金属元素失电子
元素失电子能力Na>Mg > Al
验证物质性质实验的步骤
根据提示及所给试剂、仪器,设计实验验证
Na、Mg、Al失电子能力强弱
试剂:表面积相同的镁条和铝条,金属钠(切成小块),蒸馏水,盐酸(1mol/L),酚酞溶液。
仪器:烧杯,试管,玻璃片,酒精灯,试管夹,小刀,镊子,火柴,滤纸,砂纸。
将钠、镁分别和水反应,看它们反应的条件、剧烈程度,比较钠、镁的得失电子能力。
将镁和铝分别与盐酸溶液反应,比较它们置换出氢的难易。
根据导学案的实验卡
我们开始动手操作吧!
第一组:
向小烧杯中加入少量蒸馏水→切一黄豆粒大小钠 投入水中→观察现象→滴加酚酞
向试管中加入打磨过的镁条→向其中加入约2滴管蒸馏水→观察现象(若现象不明显可以加热)→滴加酚酞
第二组:
向2支试管中分别加入打磨过的镁条和铝条→向其中加入约2滴管盐酸→观察现象
友情提示:做好实验记录哦!!!
第一组实验:Na、Mg与水的反应
结论:元素失电子能力 Na>Mg
反应物 现 象 化学方程式
钠、水
镁、水
第二组实验:Mg、Al与盐酸反应
结论:元素失电子能力Mg > Al
结论:元素失电子能力Na>Mg > Al
反 应 物 现 象 离子方程式
Mg、盐酸
Al、盐酸
MgCI2溶液中有白色沉淀生成
AlCI3溶液开始有白色沉淀生成,后沉淀消失
NaOH>Mg(OH)2>Al(OH)3
2、比较元素最高价氧化物对应水化物的碱性强弱。
一般说来,碱性越强,元素原子失电子的能力越强。
方法导引
Na > Mg > Al
碱性强弱:
失电子能力强弱:
根据提示,如何设计实验验证镁铝氢氧化物碱性强弱?
分别向等体积的MgCI2溶液、AlCI3溶液中滴加NaOH溶液至过量
实验方案
动手实验 观察现象
结论
从结构认识同周期元素性质的递变
分析: Na、Mg 、Al原子结构的递变如何引起元素失电子能力的减弱。
Na
Mg
Al
从左到右,核电荷数逐渐 ,
最外层电子数逐渐 ,
原子半径逐渐 ,
失电子能力逐渐 。
增多
增多
减小
减弱
小结1:
请回忆第三周期包含哪些非金属元素,从氧化还原反应的角度看,非金属元素单质在化学反应中主要表现还原性还是氧化性?
以S、Cl2 为例比较共性中的差异,你能从中体会S、Cl元素得电子能力有何不同吗?请用方程式来说明。
根据课本P22“方法导引”说说:常用于比较非金属元素原子得电子能力的强弱的实验依据有哪些?
【问题组二】 Si P S Cl元素原子得电子能力强弱的比较
1、比较元素单质与氢气化合的难易程度。
2、比较气态氢化物的稳定性
3、比较元素最高价氧化物对应水化物(最高价含氧酸)的酸性强弱。
高温、少量反应
光照或点燃爆炸
磷蒸气、相当困难
加热、较高温度分解
原子序数 14 15 16 17
元素符号 Si P S Cl
单质与H2化合的难易
气态氢化物的稳定性
最高价氧化物对应水化物的酸性
从结构认识同周期元素性质的递变
Si
P
S
Cl
交流研讨:
1. Si、P、S、Cl原子结构如何递变引起元素得电子能力的增强。
从左到右,核电荷数逐渐 ,
最外层电子数逐渐 ,
原子半径逐渐 ,
得电子能力逐渐 。
增多
减小
增多
增强
小结2:
稀有气体元素
失电子能力逐渐减弱,得电子能力逐渐增强
同周期元素性质的递变规律:
金属单质与水(或酸)反应 置换出氢气越来越难。
非金属单质与氢气反应越来越容易,气态氢化物的稳定性增强。
最高价氧化物对应水化物的酸性增强 碱性减弱
原子序数 11 12 13 14 15 16 17 18
元素符号 Na Mg Al Si P S Cl Ar
单质和水(或酸)反应情况 冷水剧烈 热水较快
盐酸剧烈 盐酸较快
【课堂巩固练习】----牛刀小试
1、用元素符号表达原子序数11~18号的元素的有关问题:
(1)除稀有气体外,
原子半径最大的是 ;
原子半径最小的是 ;
(2)最高价氧化物的水化物
碱性最强的是 ;
酸性最强的是 ;
呈两性的是 ;
(4)能形成气态氢化物且最稳定的是 .
Cl
Na
Cl
Al
Cl
Na
2、按C、N、O、F的顺序,下列递变规律正确的是( )
A、原子半径逐渐增大
B、元素原子得电子能力逐渐减弱
C、最高正化合价逐渐增大
D、气态氢化物稳定性逐渐增大
D
3、下述事实能够说明硫原子得电子能力比氯弱的是( )
A、硫酸比盐酸稳定
B、氯化氢比硫化氢稳定
C、盐酸酸性比氢硫酸强
D、亚硫酸酸性比高氯酸弱
B
作业:
1、预习第二部分:预测同主族元素的
性质。
2、完成《导学案课后巩固区》。
