高一 鲁科版 必修二 第一章 第1节 原子结构(第1课时)(23张)
文档属性
| 名称 | 高一 鲁科版 必修二 第一章 第1节 原子结构(第1课时)(23张) |
|
|
| 格式 | zip | ||
| 文件大小 | 984.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-02-19 00:00:00 | ||
图片预览







文档简介
鲁科版《化学2》必修
第一章 第1节 原子结构(第1课时)
原子结构模型的演变
公元前5世纪,希腊哲学家德谟克利特等人认为 :万物是由大量的不可分割的微粒构成的,即原子。
19世纪初,英国科学家道尔顿提出“原子学说”,
他认为原子是微小的不可分割的实心球体。
原子结构模型的演变
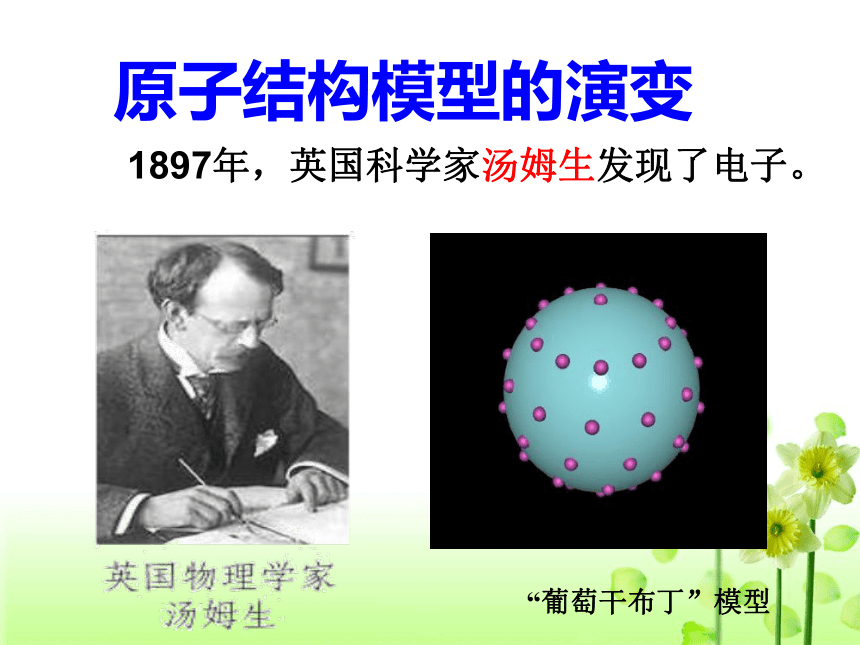
1897年,英国科学家汤姆生发现了电子。
“葡萄干布丁”模型
原子结构模型的演变
卢瑟福α粒子散射实验
1911年,他提出原子的质量几乎
全部集中在直径很小的核心区域,
叫原子核,电子在原子核外绕核
作轨道运动。原子核带正电,电
子带负电。
原子结构模型的演变
原子结构模型的演变
1913年,玻尔在卢瑟福模型的基础上,他提出了电子在核外的量子化轨道。
玻尔 玻尔原子模型
原子结构模型的演变
汤姆生 发现了电子,原子可以再分
卢瑟福 建立了核式原子模型
玻尔 提出电子在核外的量子化轨道
……
你也可以质疑,提出假说,建立模型,并验证你所提出的理论!
道尔顿 原子是不可分割的实心球体
一.原子结构
原子
原子核(+)
核外电子(-)
质子(+)
中子(不显电性)
其中,氢原子核(H)没有中子。
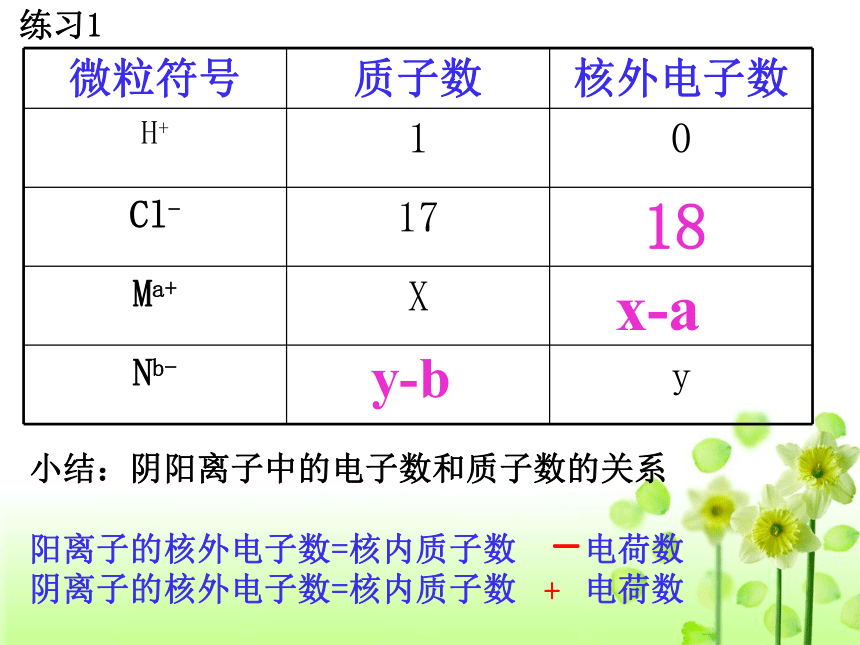
在原子中:
18
x-a
y-b
练习1
小结:阴阳离子中的电子数和质子数的关系
阳离子的核外电子数=核内质子数 电荷数
阴离子的核外电子数=核内质子数 电荷数
-
+
微粒符号 质子数 核外电子数
H+ 1 0
Cl- 17
Ma+ X
Nb- y
下表列出的是构成原子的微粒——电子、质子和中子的基本数据。
问题:1.原子的质量包括哪几部分,主要由哪些微
粒决定?
原子的质量包括质子,中子和电子的质量;
原子的质量主要由质子和中子决定,集中在原子核上。
2.若忽略电子的质量,质子、中子的相对质量分别取其近似整数值,原子的相对质量在数值上与原子核内的质子数和中子数有什么关系?
质子数(Z)+中子数(N)=质量数(A)
微粒 1个电子 1个质子 1个中子
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 0.0005484 1.007 1.008
电量/C 1.602×10-19 1.602×10-19 0
电荷 -1 +1 0
一.原子结构
核电荷数=质子数=核外电子数
1.原子的表示:
质子数(Z)+中子数(N)=质量数(A)
N(中子数)=A - Z
原子的相对原子质量与原子的质量数的区别与联系?
定义:相对原子质量是指以一个C-12原子质量的1/12作为标准,其它原子的质量跟它的比值就是这种原子的相对原子质量。
A=Z+N≈原子的相对原子质量;
区别:
定义:质量数是将原子内所有质子和中子的相对质量
取近似整数值相加而得到的数值。由于一个质子和一
个中子相对质量取近似整数时均为1,所以:
质量数(A)=质子数(Z)+中子数(N)。
联系:
意义不同,数值不同。
从定义和数值两个方面讨论
练习一答案
8
14
24
4.
生物体在生命过程中保留的一种碳原子—— 会在
其死亡后衰变。测量在考古遗址中发现的生物遗体里
的数量,可以推断出它的存在年代。请你利用所学知
识分析, 与作为相对原子质量标准的 在结构
上有何异同。
都属于碳元素
二.元素 核素 同位素
元素:
具有相同质子数(核电荷数)的同一类原子的总称。
核素:
具有一定数目质子和一定数目中子的原子称为核素。
同位素:
质子数相同而中子数不同的同一元素的不同核素
互称为同位素。
多核素元素:
只有一种核素的元素:
F,Na 等。
同位素的特点
【思考2】
1.同种元素的各种同位素化学性质_________,物理性质_______。
2.在天然存在的某种元素里,不论是游离态 还是化合态,各种同位素的原子个数百分比(丰度)一般为定值。
同位素的用途——阅读教材P5。
相同
有差异
二.元素 核素 同位素
积极稳妥的利用核能!
核污染
在福岛核电厂附近检测到铯和碘的放射性同位素,专家认为有氮和氩的放射性同位素泄出也是很自然的,钚泄漏也已经出现,情况非常令人担忧。
日本政府原子能灾害对策本部于2013年8月7日宣布,福岛第一核电站每天至少约有300吨污水流入海中。
2011年日本福岛第一核电站发生核事故后,东京电力公司曾因为污水处理设施捉襟见肘而人为向大海排放低放射性污水,以便腾出空间处理高放射性积水。当时该公司声称,在2011年6月之后,没有新的放射性污水排入海洋。
然而2013年7月22日,东京电力公司首次承认,福岛第一核电站附近被污染的地下水也正渗漏入海。
【思考3】
1.元素的种类由________决定?
2.核素的种类由_____________决定?
3.互为同位素的原子在结构上有什么特点?
质子数
质子数和中子数
______________________________。
质子数和电子数相同,中子数不同
二.元素 核素 同位素
练习二答案
1.(1)6 ,①⑤
(2)②⑥
(3)①⑥,③④
(4)同素异形体
2.A
元素、同位素、同素异形体的关系
【思考4】
H C
质子数相同,中
子数不同的同一
元素的不同原子
由同一种元素组
成的性质不同的
几种单质
具有相同核电荷
数的同一类原子
的总称
单质
广义的原子
原子
金刚石与石墨
O2与O3
联系与区别
1.联系:
2.区别:
同位素属于同一元素的原子; 同素异形体由同一元素的原子构成。
同位素种数>元素种数
元素 同位素 同素异形体
定义对象
定义
实例
核电荷数=质子数=核外电子数
质子数(Z)+中子数(N)=质量数(A)
A=Z+N≈原子的相对原子质量
微粒 1个电子 1个质子 1个中子
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 0.0005484 1.007 1.008
电量/C 1.602×10-19 1.602×10-19 0
电荷 -1 +1 0
【深度思考】35Cl的相对原子质量是34.969,37Cl的相
对原子质量是36.966,为什么我们查到的氯元素的相对
原子质量是35.45?(已知35Cl的个数百分比(丰度)是
75.77%,37Cl的丰度是24.23%)
1、相对原子质量:国际上统一规定以12C 原子质量的1/12(1.661× 10-27)为标准,其它原子的质量跟它相比较所得的值。 C:12 Fe:55.85 Na:22.99
2、元素的相对原子质量:是按它的各种天然核素相对原子质量与其原子百分组成(丰度)计算出来的平均值
第一章 第1节 原子结构(第1课时)
原子结构模型的演变
公元前5世纪,希腊哲学家德谟克利特等人认为 :万物是由大量的不可分割的微粒构成的,即原子。
19世纪初,英国科学家道尔顿提出“原子学说”,
他认为原子是微小的不可分割的实心球体。
原子结构模型的演变
1897年,英国科学家汤姆生发现了电子。
“葡萄干布丁”模型
原子结构模型的演变
卢瑟福α粒子散射实验
1911年,他提出原子的质量几乎
全部集中在直径很小的核心区域,
叫原子核,电子在原子核外绕核
作轨道运动。原子核带正电,电
子带负电。
原子结构模型的演变
原子结构模型的演变
1913年,玻尔在卢瑟福模型的基础上,他提出了电子在核外的量子化轨道。
玻尔 玻尔原子模型
原子结构模型的演变
汤姆生 发现了电子,原子可以再分
卢瑟福 建立了核式原子模型
玻尔 提出电子在核外的量子化轨道
……
你也可以质疑,提出假说,建立模型,并验证你所提出的理论!
道尔顿 原子是不可分割的实心球体
一.原子结构
原子
原子核(+)
核外电子(-)
质子(+)
中子(不显电性)
其中,氢原子核(H)没有中子。
在原子中:
18
x-a
y-b
练习1
小结:阴阳离子中的电子数和质子数的关系
阳离子的核外电子数=核内质子数 电荷数
阴离子的核外电子数=核内质子数 电荷数
-
+
微粒符号 质子数 核外电子数
H+ 1 0
Cl- 17
Ma+ X
Nb- y
下表列出的是构成原子的微粒——电子、质子和中子的基本数据。
问题:1.原子的质量包括哪几部分,主要由哪些微
粒决定?
原子的质量包括质子,中子和电子的质量;
原子的质量主要由质子和中子决定,集中在原子核上。
2.若忽略电子的质量,质子、中子的相对质量分别取其近似整数值,原子的相对质量在数值上与原子核内的质子数和中子数有什么关系?
质子数(Z)+中子数(N)=质量数(A)
微粒 1个电子 1个质子 1个中子
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 0.0005484 1.007 1.008
电量/C 1.602×10-19 1.602×10-19 0
电荷 -1 +1 0
一.原子结构
核电荷数=质子数=核外电子数
1.原子的表示:
质子数(Z)+中子数(N)=质量数(A)
N(中子数)=A - Z
原子的相对原子质量与原子的质量数的区别与联系?
定义:相对原子质量是指以一个C-12原子质量的1/12作为标准,其它原子的质量跟它的比值就是这种原子的相对原子质量。
A=Z+N≈原子的相对原子质量;
区别:
定义:质量数是将原子内所有质子和中子的相对质量
取近似整数值相加而得到的数值。由于一个质子和一
个中子相对质量取近似整数时均为1,所以:
质量数(A)=质子数(Z)+中子数(N)。
联系:
意义不同,数值不同。
从定义和数值两个方面讨论
练习一答案
8
14
24
4.
生物体在生命过程中保留的一种碳原子—— 会在
其死亡后衰变。测量在考古遗址中发现的生物遗体里
的数量,可以推断出它的存在年代。请你利用所学知
识分析, 与作为相对原子质量标准的 在结构
上有何异同。
都属于碳元素
二.元素 核素 同位素
元素:
具有相同质子数(核电荷数)的同一类原子的总称。
核素:
具有一定数目质子和一定数目中子的原子称为核素。
同位素:
质子数相同而中子数不同的同一元素的不同核素
互称为同位素。
多核素元素:
只有一种核素的元素:
F,Na 等。
同位素的特点
【思考2】
1.同种元素的各种同位素化学性质_________,物理性质_______。
2.在天然存在的某种元素里,不论是游离态 还是化合态,各种同位素的原子个数百分比(丰度)一般为定值。
同位素的用途——阅读教材P5。
相同
有差异
二.元素 核素 同位素
积极稳妥的利用核能!
核污染
在福岛核电厂附近检测到铯和碘的放射性同位素,专家认为有氮和氩的放射性同位素泄出也是很自然的,钚泄漏也已经出现,情况非常令人担忧。
日本政府原子能灾害对策本部于2013年8月7日宣布,福岛第一核电站每天至少约有300吨污水流入海中。
2011年日本福岛第一核电站发生核事故后,东京电力公司曾因为污水处理设施捉襟见肘而人为向大海排放低放射性污水,以便腾出空间处理高放射性积水。当时该公司声称,在2011年6月之后,没有新的放射性污水排入海洋。
然而2013年7月22日,东京电力公司首次承认,福岛第一核电站附近被污染的地下水也正渗漏入海。
【思考3】
1.元素的种类由________决定?
2.核素的种类由_____________决定?
3.互为同位素的原子在结构上有什么特点?
质子数
质子数和中子数
______________________________。
质子数和电子数相同,中子数不同
二.元素 核素 同位素
练习二答案
1.(1)6 ,①⑤
(2)②⑥
(3)①⑥,③④
(4)同素异形体
2.A
元素、同位素、同素异形体的关系
【思考4】
H C
质子数相同,中
子数不同的同一
元素的不同原子
由同一种元素组
成的性质不同的
几种单质
具有相同核电荷
数的同一类原子
的总称
单质
广义的原子
原子
金刚石与石墨
O2与O3
联系与区别
1.联系:
2.区别:
同位素属于同一元素的原子; 同素异形体由同一元素的原子构成。
同位素种数>元素种数
元素 同位素 同素异形体
定义对象
定义
实例
核电荷数=质子数=核外电子数
质子数(Z)+中子数(N)=质量数(A)
A=Z+N≈原子的相对原子质量
微粒 1个电子 1个质子 1个中子
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 0.0005484 1.007 1.008
电量/C 1.602×10-19 1.602×10-19 0
电荷 -1 +1 0
【深度思考】35Cl的相对原子质量是34.969,37Cl的相
对原子质量是36.966,为什么我们查到的氯元素的相对
原子质量是35.45?(已知35Cl的个数百分比(丰度)是
75.77%,37Cl的丰度是24.23%)
1、相对原子质量:国际上统一规定以12C 原子质量的1/12(1.661× 10-27)为标准,其它原子的质量跟它相比较所得的值。 C:12 Fe:55.85 Na:22.99
2、元素的相对原子质量:是按它的各种天然核素相对原子质量与其原子百分组成(丰度)计算出来的平均值
