沪教版九年级第七章第二节常见的酸和碱:常见的碱(26张PPT)
文档属性
| 名称 | 沪教版九年级第七章第二节常见的酸和碱:常见的碱(26张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-02-19 10:21:34 | ||
图片预览








文档简介
(共26张PPT)
常见的碱
如: 氢氧化钠、氢氧化钙
NaOH、 Ca(OH)2
判断方法
(1)名称以“氢氧”开头
(2)化学式以“OH”结尾
常见的碱
(1) 氢氧化钠固体(NaOH)
俗称:烧碱、火碱、苛性钠
(2)氢氧化钙固体(Ca(OH)2)
俗称:熟石灰、消石灰
(3)氨水
氢氧化钠固体俗称:
烧碱、火碱或苛性钠
(1)氢氧化钠固体是白色固体
(2)氢氧化钠固体易吸水而潮解,
易与二氧化碳反应而变质。
保存方法:密封保存
(3)氢氧化钠固体易溶于水,
溶解时放出大量的热
探究一:观察固体烧碱,在表面皿中放一些固体烧碱,露置在空气中一段时间,观察它发生什么变化。烧碱在水中的溶解情况
氢氧化钙固体的俗名是什么?在水中的溶解性如何?
如何保存?氢氧化钙固体的制取方法是什么?
(1)氢氧化钙固体的俗名:熟石灰、消石灰
(2)氢氧化钙固体微溶于水,
配成的溶液叫石灰水(饱和溶液也是稀溶液)
(3)氢氧化钙固体会与二氧化碳反应而变质,
保存方法:必须密封保存
(4)制取方法:用生石灰与水化合制得
CaO+H2O=Ca(OH)2(该反应放出大量的热)
注意:生石灰又叫氧化钙,
有很强的吸水性,
常做干燥剂(不能干燥CO2,HCl气体)
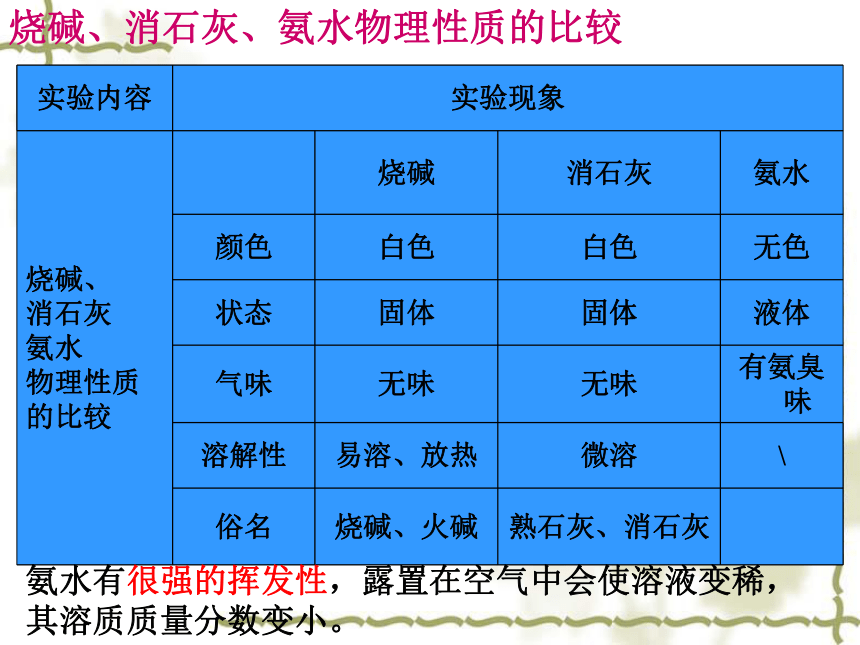
实验内容 实验现象
烧碱、
消石灰
氨水
物理性质
的比较 烧碱 消石灰 氨水
颜色 白色 白色 无色
状态 固体 固体 液体
气味 无味 无味 有氨臭味
溶解性 易溶、放热 微溶 \
俗名 烧碱、火碱 熟石灰、消石灰
烧碱、消石灰、氨水物理性质的比较
氨水有很强的挥发性,露置在空气中会使溶液变稀,
其溶质质量分数变小。
(1)与酸碱指示剂作用
A.紫色石蕊试液或红色石蕊试纸遇到碱溶液蓝;
B.无色酚酞遇到碱溶液变红
碱的化学性质
(2)与某些非金属氧化物反应
碱溶液 + 非金属氧化物 → 盐 + 水
如: 2NaOH + CO2 == Na2CO3 + H2O;
Ca(OH)2 + CO2 == CaCO3↓ + H2O;
讨论:烧碱、消石灰为什么必须密封保存?
答:不密封会与空气中的二氧化碳反应而变质(反应 方程式如上所示)。
应用(1)如果要吸收CO2 ,哪种溶液更好,为什么?
答:吸收CO2用浓NaOH溶液,因为吸收CO2要用浓溶液,吸收才更彻底。NaOH易溶于水,可以配成浓溶液。
(2)如果要检验CO2,哪种溶液更好,为什么?
答:检验CO2用Ca(OH)2溶液,因为检验证明CO2要有明显的现象便于观察。 CO2与Ca(OH)2溶液反应产生白色沉淀。 CO2与NaOH溶液反应没有明显现象。
碱的化学性质
碱的化学性质
(3)能与某些盐反应
碱溶液 + 盐溶液 → 新盐 + 新碱
如:CuSO4 + Ca(OH)2 == Cu(OH)2↓+ CaSO4;
CuSO4 + 2NaOH == Na2SO4 + Cu(OH)2↓
讨论:NaOH溶液敞口放置部分变质了(生成了Na2CO3), 如何除去溶液中的杂质?
(用适量的澄清石灰水)
Ca(OH)2+Na2CO3==2NaOH+CaCO3↓
用途:制取少量的NaOH
小组讨论:
1、氢氧化钠、氢氧化钙在组成和性质上有许多共同之处。请你尽可能多地归纳出它们的共同点,并与同学们交流。
2、请你回忆你六章有关溶液导电性实验,通过讨论,对“碱的水溶液有共同的化学性质”做出解释。
二、常见的碱的化学性质
(1)与酸碱指示剂作用
A.紫色石蕊试液或红色石蕊试纸遇到碱溶液蓝;
B.无色酚酞遇到碱溶液变红
(2)与某些非金属氧化物反应
碱溶液 + 非金属氧化物 → 盐 + 水
如: 2NaOH + CO2 == Na2CO3 + H2O;
Ca(OH)2 + CO2 == CaCO3↓ + H2O;
碱的化学性质
由于碱电离后都能生成OH-,因此也具有相同的性质
(3)能与某些盐反应
碱溶液 + 盐溶液 → 新盐 + 新碱
如:CuSO4 + Ca(OH)2 == Cu(OH)2↓+ CaSO4;
CuSO4 + 2NaOH == Na2SO4 + Cu(OH)2↓
Ca(OH)2+Na2CO3==2NaOH+CaCO3↓
CuSO4 + Ca(OH)2 == Cu(OH)2↓+ CaSO4;
CuSO4 + 2NaOH == Na2SO4 + Cu(OH)2↓
Ca(OH)2+Na2CO3==2NaOH+CaCO3↓
讨论:请观察下面的化学方程式有什么特点,请归纳出它们的一些规律。
复分解反应:有两种化合物相互交换成分,生成另外两种化合物的反应。
特点:(1)反应物、生成物均只有两种化合物;
(2)两种反应物相互交换正价元素位置;
(3)各元素的化合价在反应前后均不改变。
复分解反应:
由于碱电离后都能生成OH-,因此也具有相同的性质。如: (1)与酸碱指示剂作用
A.紫色石蕊试液或红色石蕊试纸遇到碱溶液蓝;
B.无色酚酞遇到碱溶液变红
(2)与某些非金属氧化物反应
碱溶液 + 非金属氧化物 → 盐 + 水
如: 2NaOH + CO2 == Na2CO3 + H2O;
Ca(OH)2 + CO2 == CaCO3↓ + H2O;
总结:碱的共同性质(化学性质)
(3)能与某些盐反应
碱溶液 + 盐溶液 → 新盐 + 新碱
如:CuSO4 + Ca(OH)2 == Cu(OH)2↓+ CaSO4;
CuSO4 + 2NaOH == Na2SO4 + Cu(OH)2↓
Ca(OH)2+Na2CO3==2NaOH+CaCO3↓
你能得出答案吗?
1.碱溶液有相似的化学性质的原因是碱溶液中都含有( )
A.氢离子 B.氢氧根离子
C.金属离子 D.酸根离子
B
你能得出答案吗?
2.用一种试剂(或试纸)就能一次性把Ca(OH)2、NaCl、HCl三种溶液区别开,这种试剂(或试纸)是 ( )
A. 酚酞试液 B.紫色石蕊试液
C.水 D.pH试纸
B和D
你能得出答案吗?
3.下列能正确表示加水稀释pH=10的溶液的是 ( )
D
pH
7
pH
7
pH
7
pH
7
A. B. C. D.
你能得出答案吗?
4.下列物质中常用来改良土壤酸性的是( )
A.石灰石 B.熟石灰
C.干冰 D.烧碱
B
你能得出答案吗?
5.保存NaOH溶液时,下列方法中不正确的是( )
A.不避光 B.玻璃瓶配玻璃塞
C.塑料瓶装 D.密封
B
你能得出答案吗?
6.欲除去NaOH溶液中的Na2CO3杂质,可选用下列试剂中的( )
A.稀盐酸 B.CaCl2溶液
C.CO2气体 D.澄清石灰水
D
7.用天平称量固体氢氧化钠时,应把氢氧化钠直接放在( )
A、天平的托盘上 B、滤纸上
C、小烧杯内 D、试管中
C
8.区别稀氢氧化钠溶液和石灰水可用 ( )
A.硫酸铜溶液 B.二氧化碳
C.紫色石蕊 D.酚酞
B
9.下列反应是复分解反应的是 ( )
A. 2KMnO4=K2MnO4+MnO2+O2
B. 2Al+3O2= 2Al2O3
C. Mg+2HCl=H2 +MgCl2
D. Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
E. CaCO3+2HCl=CaCl2+H2O+CO2
F. 2NaOH+CO2=Na2CO3 +H2O
D E
分解反应
化合反应
置换反应
△
10、要完成下列变化,经一步反应实现的是( )
①Na2CO3→NaOH ②CaCO3→Ca(OH)2
③CO2→Na2CO3 ④Ca(OH)2→Cu(OH)2
A.① ③ ④ B.②③ C.①②④ D.④
A
11.区别稀氢氧化钠溶液和石灰水可用 ( )
A.硫酸铜溶液 B.二氧化碳
C.紫色石蕊 D.酚酞
E.碳酸钠溶液
B.E
12.烧碱固体为什么要封闭保存?
如何检验一瓶久置的烧碱固体是否变质?写出有关化学反应方程式。
烧碱会潮解,又会与空气中的CO2反应而变质
CO2+2NaOH=Na2CO3 +H2O
Na2CO3 +2HCl=2NaCl+H2O+CO2
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
13、盛有盐酸、水、氢氧化钠的三瓶无色液体,请选用一种试剂将它们区别开 。
14、用一种简单的方法区别三种白色固体
NaCl NaOH CaCO3
15、你能以铜、稀硫酸、氢氧化钠溶液为原料制取氢氧化铜吗?
Cu———CuO———CuSO4———Cu(OH)2
+O2
△
+H2SO4
+NaOH
15.元旦联欢会上,雯雯拿出一幅画(如下图所示),表演了一个化学魔术。
(1)她向画中的衣服上喷了一种无色溶液,衣服由紫色变成红色。若衣服上预先涂过石蕊溶液,则喷的无色溶液可能是 。
(2)她向画中的灯笼上喷了另一种无色溶液,灯笼由白色变成红色,则该无色溶液及灯笼上预先涂过的试剂分别是 。
稀盐酸或稀硫酸
NaOH溶液、无色酚酞试液(其他合理答案也可)
常见的碱
如: 氢氧化钠、氢氧化钙
NaOH、 Ca(OH)2
判断方法
(1)名称以“氢氧”开头
(2)化学式以“OH”结尾
常见的碱
(1) 氢氧化钠固体(NaOH)
俗称:烧碱、火碱、苛性钠
(2)氢氧化钙固体(Ca(OH)2)
俗称:熟石灰、消石灰
(3)氨水
氢氧化钠固体俗称:
烧碱、火碱或苛性钠
(1)氢氧化钠固体是白色固体
(2)氢氧化钠固体易吸水而潮解,
易与二氧化碳反应而变质。
保存方法:密封保存
(3)氢氧化钠固体易溶于水,
溶解时放出大量的热
探究一:观察固体烧碱,在表面皿中放一些固体烧碱,露置在空气中一段时间,观察它发生什么变化。烧碱在水中的溶解情况
氢氧化钙固体的俗名是什么?在水中的溶解性如何?
如何保存?氢氧化钙固体的制取方法是什么?
(1)氢氧化钙固体的俗名:熟石灰、消石灰
(2)氢氧化钙固体微溶于水,
配成的溶液叫石灰水(饱和溶液也是稀溶液)
(3)氢氧化钙固体会与二氧化碳反应而变质,
保存方法:必须密封保存
(4)制取方法:用生石灰与水化合制得
CaO+H2O=Ca(OH)2(该反应放出大量的热)
注意:生石灰又叫氧化钙,
有很强的吸水性,
常做干燥剂(不能干燥CO2,HCl气体)
实验内容 实验现象
烧碱、
消石灰
氨水
物理性质
的比较 烧碱 消石灰 氨水
颜色 白色 白色 无色
状态 固体 固体 液体
气味 无味 无味 有氨臭味
溶解性 易溶、放热 微溶 \
俗名 烧碱、火碱 熟石灰、消石灰
烧碱、消石灰、氨水物理性质的比较
氨水有很强的挥发性,露置在空气中会使溶液变稀,
其溶质质量分数变小。
(1)与酸碱指示剂作用
A.紫色石蕊试液或红色石蕊试纸遇到碱溶液蓝;
B.无色酚酞遇到碱溶液变红
碱的化学性质
(2)与某些非金属氧化物反应
碱溶液 + 非金属氧化物 → 盐 + 水
如: 2NaOH + CO2 == Na2CO3 + H2O;
Ca(OH)2 + CO2 == CaCO3↓ + H2O;
讨论:烧碱、消石灰为什么必须密封保存?
答:不密封会与空气中的二氧化碳反应而变质(反应 方程式如上所示)。
应用(1)如果要吸收CO2 ,哪种溶液更好,为什么?
答:吸收CO2用浓NaOH溶液,因为吸收CO2要用浓溶液,吸收才更彻底。NaOH易溶于水,可以配成浓溶液。
(2)如果要检验CO2,哪种溶液更好,为什么?
答:检验CO2用Ca(OH)2溶液,因为检验证明CO2要有明显的现象便于观察。 CO2与Ca(OH)2溶液反应产生白色沉淀。 CO2与NaOH溶液反应没有明显现象。
碱的化学性质
碱的化学性质
(3)能与某些盐反应
碱溶液 + 盐溶液 → 新盐 + 新碱
如:CuSO4 + Ca(OH)2 == Cu(OH)2↓+ CaSO4;
CuSO4 + 2NaOH == Na2SO4 + Cu(OH)2↓
讨论:NaOH溶液敞口放置部分变质了(生成了Na2CO3), 如何除去溶液中的杂质?
(用适量的澄清石灰水)
Ca(OH)2+Na2CO3==2NaOH+CaCO3↓
用途:制取少量的NaOH
小组讨论:
1、氢氧化钠、氢氧化钙在组成和性质上有许多共同之处。请你尽可能多地归纳出它们的共同点,并与同学们交流。
2、请你回忆你六章有关溶液导电性实验,通过讨论,对“碱的水溶液有共同的化学性质”做出解释。
二、常见的碱的化学性质
(1)与酸碱指示剂作用
A.紫色石蕊试液或红色石蕊试纸遇到碱溶液蓝;
B.无色酚酞遇到碱溶液变红
(2)与某些非金属氧化物反应
碱溶液 + 非金属氧化物 → 盐 + 水
如: 2NaOH + CO2 == Na2CO3 + H2O;
Ca(OH)2 + CO2 == CaCO3↓ + H2O;
碱的化学性质
由于碱电离后都能生成OH-,因此也具有相同的性质
(3)能与某些盐反应
碱溶液 + 盐溶液 → 新盐 + 新碱
如:CuSO4 + Ca(OH)2 == Cu(OH)2↓+ CaSO4;
CuSO4 + 2NaOH == Na2SO4 + Cu(OH)2↓
Ca(OH)2+Na2CO3==2NaOH+CaCO3↓
CuSO4 + Ca(OH)2 == Cu(OH)2↓+ CaSO4;
CuSO4 + 2NaOH == Na2SO4 + Cu(OH)2↓
Ca(OH)2+Na2CO3==2NaOH+CaCO3↓
讨论:请观察下面的化学方程式有什么特点,请归纳出它们的一些规律。
复分解反应:有两种化合物相互交换成分,生成另外两种化合物的反应。
特点:(1)反应物、生成物均只有两种化合物;
(2)两种反应物相互交换正价元素位置;
(3)各元素的化合价在反应前后均不改变。
复分解反应:
由于碱电离后都能生成OH-,因此也具有相同的性质。如: (1)与酸碱指示剂作用
A.紫色石蕊试液或红色石蕊试纸遇到碱溶液蓝;
B.无色酚酞遇到碱溶液变红
(2)与某些非金属氧化物反应
碱溶液 + 非金属氧化物 → 盐 + 水
如: 2NaOH + CO2 == Na2CO3 + H2O;
Ca(OH)2 + CO2 == CaCO3↓ + H2O;
总结:碱的共同性质(化学性质)
(3)能与某些盐反应
碱溶液 + 盐溶液 → 新盐 + 新碱
如:CuSO4 + Ca(OH)2 == Cu(OH)2↓+ CaSO4;
CuSO4 + 2NaOH == Na2SO4 + Cu(OH)2↓
Ca(OH)2+Na2CO3==2NaOH+CaCO3↓
你能得出答案吗?
1.碱溶液有相似的化学性质的原因是碱溶液中都含有( )
A.氢离子 B.氢氧根离子
C.金属离子 D.酸根离子
B
你能得出答案吗?
2.用一种试剂(或试纸)就能一次性把Ca(OH)2、NaCl、HCl三种溶液区别开,这种试剂(或试纸)是 ( )
A. 酚酞试液 B.紫色石蕊试液
C.水 D.pH试纸
B和D
你能得出答案吗?
3.下列能正确表示加水稀释pH=10的溶液的是 ( )
D
pH
7
pH
7
pH
7
pH
7
A. B. C. D.
你能得出答案吗?
4.下列物质中常用来改良土壤酸性的是( )
A.石灰石 B.熟石灰
C.干冰 D.烧碱
B
你能得出答案吗?
5.保存NaOH溶液时,下列方法中不正确的是( )
A.不避光 B.玻璃瓶配玻璃塞
C.塑料瓶装 D.密封
B
你能得出答案吗?
6.欲除去NaOH溶液中的Na2CO3杂质,可选用下列试剂中的( )
A.稀盐酸 B.CaCl2溶液
C.CO2气体 D.澄清石灰水
D
7.用天平称量固体氢氧化钠时,应把氢氧化钠直接放在( )
A、天平的托盘上 B、滤纸上
C、小烧杯内 D、试管中
C
8.区别稀氢氧化钠溶液和石灰水可用 ( )
A.硫酸铜溶液 B.二氧化碳
C.紫色石蕊 D.酚酞
B
9.下列反应是复分解反应的是 ( )
A. 2KMnO4=K2MnO4+MnO2+O2
B. 2Al+3O2= 2Al2O3
C. Mg+2HCl=H2 +MgCl2
D. Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
E. CaCO3+2HCl=CaCl2+H2O+CO2
F. 2NaOH+CO2=Na2CO3 +H2O
D E
分解反应
化合反应
置换反应
△
10、要完成下列变化,经一步反应实现的是( )
①Na2CO3→NaOH ②CaCO3→Ca(OH)2
③CO2→Na2CO3 ④Ca(OH)2→Cu(OH)2
A.① ③ ④ B.②③ C.①②④ D.④
A
11.区别稀氢氧化钠溶液和石灰水可用 ( )
A.硫酸铜溶液 B.二氧化碳
C.紫色石蕊 D.酚酞
E.碳酸钠溶液
B.E
12.烧碱固体为什么要封闭保存?
如何检验一瓶久置的烧碱固体是否变质?写出有关化学反应方程式。
烧碱会潮解,又会与空气中的CO2反应而变质
CO2+2NaOH=Na2CO3 +H2O
Na2CO3 +2HCl=2NaCl+H2O+CO2
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
13、盛有盐酸、水、氢氧化钠的三瓶无色液体,请选用一种试剂将它们区别开 。
14、用一种简单的方法区别三种白色固体
NaCl NaOH CaCO3
15、你能以铜、稀硫酸、氢氧化钠溶液为原料制取氢氧化铜吗?
Cu———CuO———CuSO4———Cu(OH)2
+O2
△
+H2SO4
+NaOH
15.元旦联欢会上,雯雯拿出一幅画(如下图所示),表演了一个化学魔术。
(1)她向画中的衣服上喷了一种无色溶液,衣服由紫色变成红色。若衣服上预先涂过石蕊溶液,则喷的无色溶液可能是 。
(2)她向画中的灯笼上喷了另一种无色溶液,灯笼由白色变成红色,则该无色溶液及灯笼上预先涂过的试剂分别是 。
稀盐酸或稀硫酸
NaOH溶液、无色酚酞试液(其他合理答案也可)
