鲁科版 必修二 第一章 1.2 元素周期律( 25ppt)
文档属性
| 名称 | 鲁科版 必修二 第一章 1.2 元素周期律( 25ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 818.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-02-21 15:36:59 | ||
图片预览






文档简介
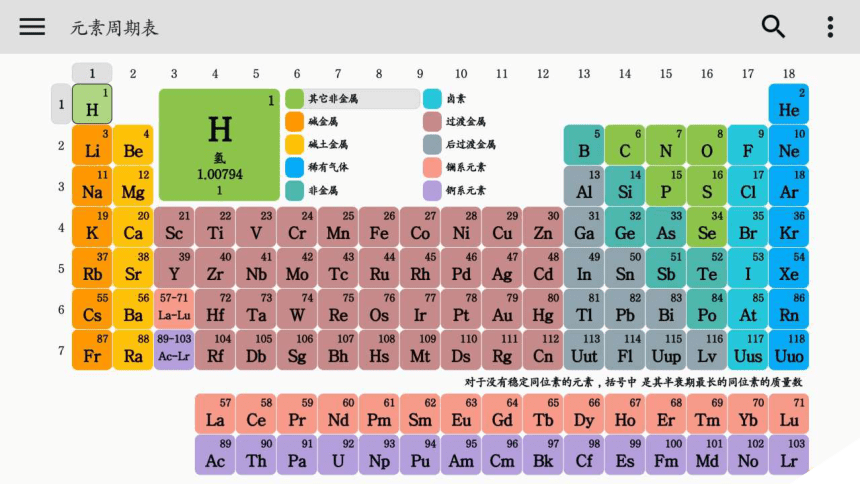
课件25张PPT。1869年,俄国化学家门捷列夫将元素按照相对原子质量由小到大依次排列,制出了第一张元素周期表,这就是现代元素周期表的雏形。元素周期律必修二第一章第二节 结合有关数据认识原子结构、元素性质呈周期性变化
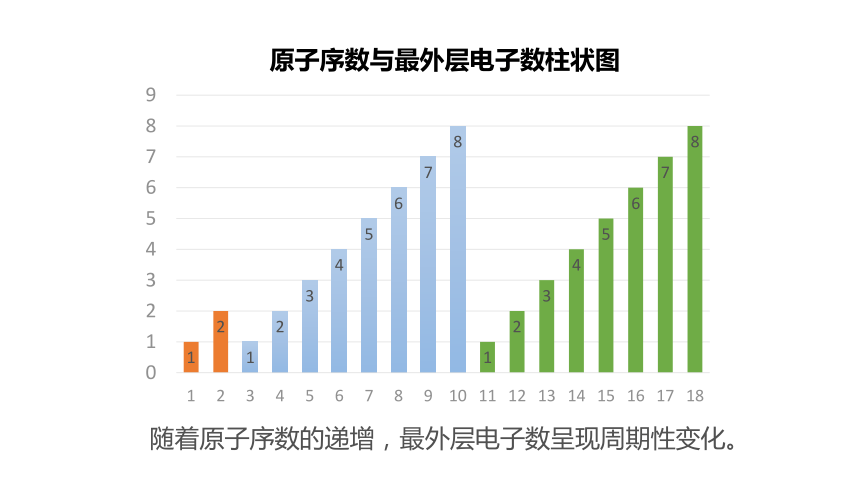
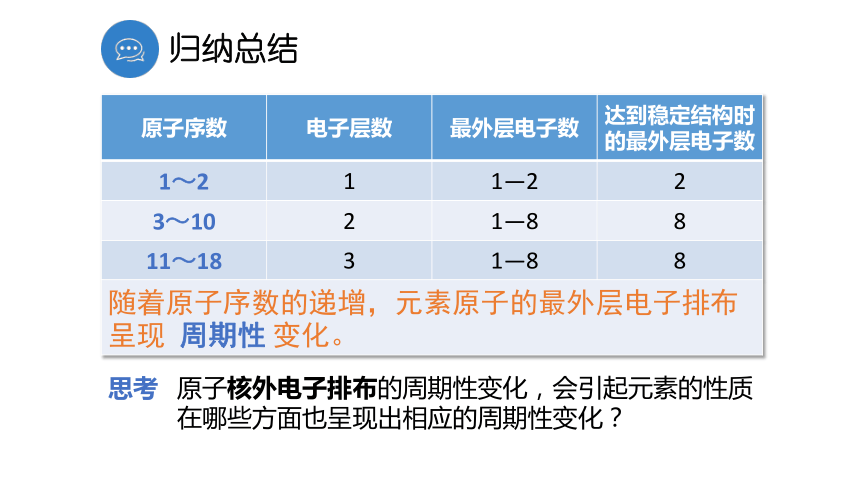
的规律,建构元素周期律。学习目标会比较微粒半径大小,并解释原因。12 探究活动原子序数与最外层电子关系原子序数与元素主要化合价关系原子序数与原子半径关系 探究活动 1原子序数与最外层电子关系原子序数与最外层电子数柱状图随着原子序数的递增,最外层电子数呈现周期性变化。归纳总结原子核外电子排布的周期性变化,会引起元素的性质在哪些方面也呈现出相应的周期性变化?思考 探究活动 2原子序数与元素主要化合价关系元素主要化合价原子序数与元素主要化合价线状图元素1 H2 He3 Li4 Be5 B6 C7 N8 O9 F10 Ne11 Na12 Mg13 Al14 Si15 P16 S17 Cl18 Ar归纳总结问题组一2、观察金属元素的化合价有何共性?1、同种元素的最高正价和最低负价有何关系?3、除稀有气体外,非金属元素既有正价又有负价。对吗?金属元素只有正价,无负价不对,F 元素没有正价 探究活动3原子序数与原子半径的关系1—18号元素原子半径表1 H0.0372 He3 Li0.1344 Be0.0905 B0.0826 C0.0777 N0.0758 O0.0739 F0.07110 Ne11 Na0.15412 Mg0.13013 Al0.11814 Si0.11115 P0.10616 S0.10217 Cl0.09918 Ar原子序数元素原子半径
/nm原子序数与原子半径线状图__-归纳总结比较Na与Mg、Al的原子半径大小比较O和S的半径大小比较Na+、O2-、Mg2+的半径大小问题组二123Na>Mg>AlONa+>Mg2+比较Na和Na+、 O和O2-半径大小4Na>Na+O 离子半径逐渐减小;微粒半径的比较:① 一般来说,电子层数越多的原子,半径越大;
当电子层数相同时,随着核电荷数的增加,原子半径逐渐减小;③ 同一元素中,阳离子半径小于相应的原子半径,
阴离子半径大于相应的原子半径;随着原子序数的增加,元素原子的半径、元素的主要化合价为什么呈现周期性变化?出现这种变化的根本原因是什么?交流与思考元素周期律的实质:元素周期律:元素的性质随着元素原子序数的递增而呈周期性变化,这个规律叫做元素周期律。随着元素原子序数的递增,原子核外电子排布呈周期性变化。结 论元素周期律内容:随着元素原子序数的递增,元素原子的最外层电子排布、原子半径、元素的化合价等均呈现周期性变化。原子序数递增核外电子排布呈周期性变化元素性质呈周期性变化元素周期律决定了引起了最外层电子数 1→8(K层电子数 1→2) 原子半径(从左到右)大→小(稀有气体元素突然增大)化合价:+1→+7(O、F除外),
-4→-1(稀有气体元素为0)课堂小结1.原子序数从11依次增加到17,下列递变关系中,错误的是 ( )
A课堂练习A.电子层数逐渐增多
B.原子半径逐渐减小
C.最高正化合价数值逐渐增大
D.从Si到Cl,最低负化合价从-4到-12.对于具有相同电子层结构的三种微粒:Bn-、An+、C,下列说法正确的是( )B课堂练习A.原子半径:A> C> B
B.微粒半径:Bn->An+
C.C元素不是稀有气体元素??????????????
D.原子序数:C>B>A
的规律,建构元素周期律。学习目标会比较微粒半径大小,并解释原因。12 探究活动原子序数与最外层电子关系原子序数与元素主要化合价关系原子序数与原子半径关系 探究活动 1原子序数与最外层电子关系原子序数与最外层电子数柱状图随着原子序数的递增,最外层电子数呈现周期性变化。归纳总结原子核外电子排布的周期性变化,会引起元素的性质在哪些方面也呈现出相应的周期性变化?思考 探究活动 2原子序数与元素主要化合价关系元素主要化合价原子序数与元素主要化合价线状图元素1 H2 He3 Li4 Be5 B6 C7 N8 O9 F10 Ne11 Na12 Mg13 Al14 Si15 P16 S17 Cl18 Ar归纳总结问题组一2、观察金属元素的化合价有何共性?1、同种元素的最高正价和最低负价有何关系?3、除稀有气体外,非金属元素既有正价又有负价。对吗?金属元素只有正价,无负价不对,F 元素没有正价 探究活动3原子序数与原子半径的关系1—18号元素原子半径表1 H0.0372 He3 Li0.1344 Be0.0905 B0.0826 C0.0777 N0.0758 O0.0739 F0.07110 Ne11 Na0.15412 Mg0.13013 Al0.11814 Si0.11115 P0.10616 S0.10217 Cl0.09918 Ar原子序数元素原子半径
/nm原子序数与原子半径线状图__-归纳总结比较Na与Mg、Al的原子半径大小比较O和S的半径大小比较Na+、O2-、Mg2+的半径大小问题组二123Na>Mg>AlO
当电子层数相同时,随着核电荷数的增加,原子半径逐渐减小;③ 同一元素中,阳离子半径小于相应的原子半径,
阴离子半径大于相应的原子半径;随着原子序数的增加,元素原子的半径、元素的主要化合价为什么呈现周期性变化?出现这种变化的根本原因是什么?交流与思考元素周期律的实质:元素周期律:元素的性质随着元素原子序数的递增而呈周期性变化,这个规律叫做元素周期律。随着元素原子序数的递增,原子核外电子排布呈周期性变化。结 论元素周期律内容:随着元素原子序数的递增,元素原子的最外层电子排布、原子半径、元素的化合价等均呈现周期性变化。原子序数递增核外电子排布呈周期性变化元素性质呈周期性变化元素周期律决定了引起了最外层电子数 1→8(K层电子数 1→2) 原子半径(从左到右)大→小(稀有气体元素突然增大)化合价:+1→+7(O、F除外),
-4→-1(稀有气体元素为0)课堂小结1.原子序数从11依次增加到17,下列递变关系中,错误的是 ( )
A课堂练习A.电子层数逐渐增多
B.原子半径逐渐减小
C.最高正化合价数值逐渐增大
D.从Si到Cl,最低负化合价从-4到-12.对于具有相同电子层结构的三种微粒:Bn-、An+、C,下列说法正确的是( )B课堂练习A.原子半径:A> C> B
B.微粒半径:Bn->An+
C.C元素不是稀有气体元素??????????????
D.原子序数:C>B>A
