鲁科版高中化学 必修二 1.3.2 同主族元素性质的递变规律(32张)
文档属性
| 名称 | 鲁科版高中化学 必修二 1.3.2 同主族元素性质的递变规律(32张) |

|
|
| 格式 | zip | ||
| 文件大小 | 960.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-02-27 00:00:00 | ||
图片预览






文档简介
鲁科版普通高中课程标准实验教科书 化学2(必修)
第一章
第三节 元素周期律的应用(2)
认识同主族元素性质的递变规律
复习回顾:
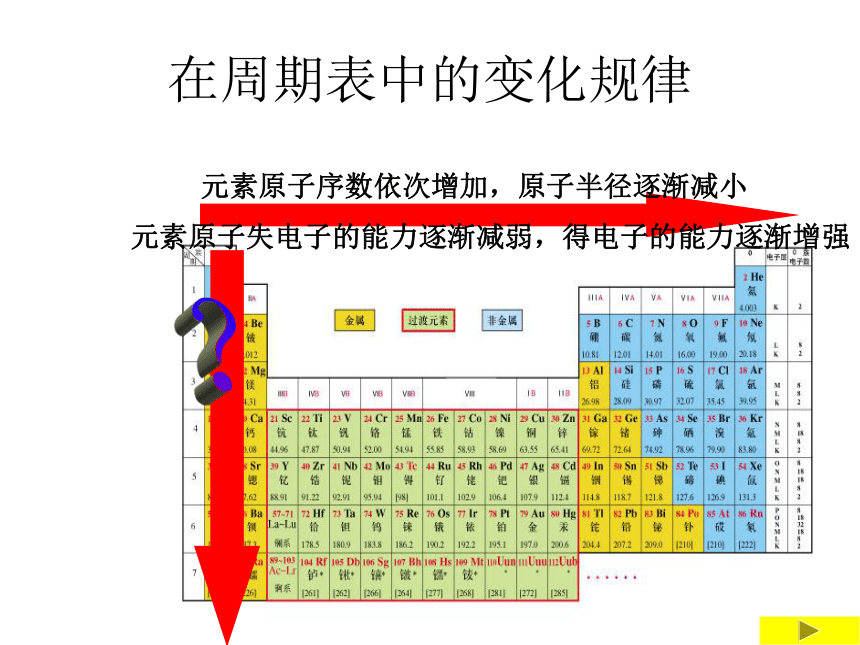
从左向右,元素的金属性逐渐减弱,非金属性逐渐增强。
试用结构观点解释为什么有这样的变化规律:
同一周期元素,电子层数相同。从左向右,核电荷数增多,原子半径减小,失电子的能力逐渐减弱,得电子的能力逐渐增强。
同一周期元素的金属性和非金属性变化有何规律?
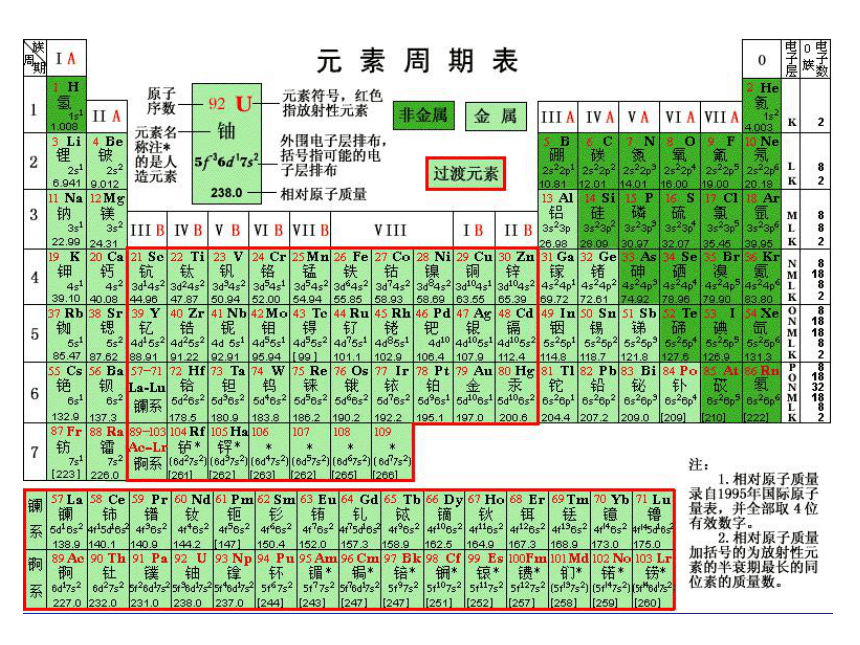
在周期表中的变化规律
二、预测同主族元素的性质
1、ⅦA族元素
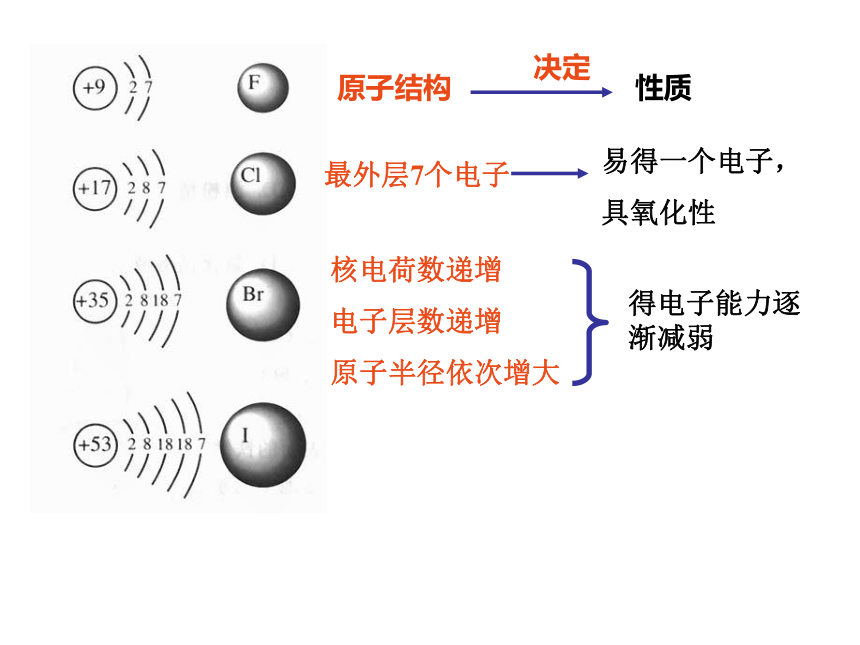
(1) ⅦA族元素的原子结构
原子结构
决定
性质
最外层7个电子
易得一个电子,
具氧化性
核电荷数递增
电子层数递增
原子半径依次增大
得电子能力逐渐减弱
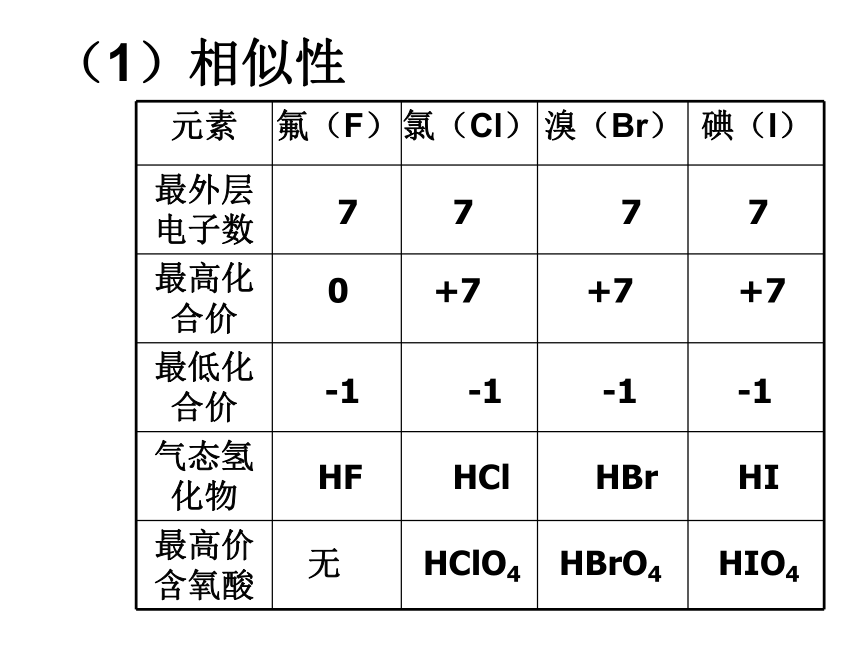
(1)相似性
7 7 7 7
0 +7 +7 +7
-1 -1 -1 -1
HF HCl HBr HI
无 HClO4 HBrO4 HIO4
元素 氟(F) 氯(Cl) 溴(Br) 碘(I)
最外层电子数
最高化合价
最低化合价
气态氢化物
最高价含氧酸
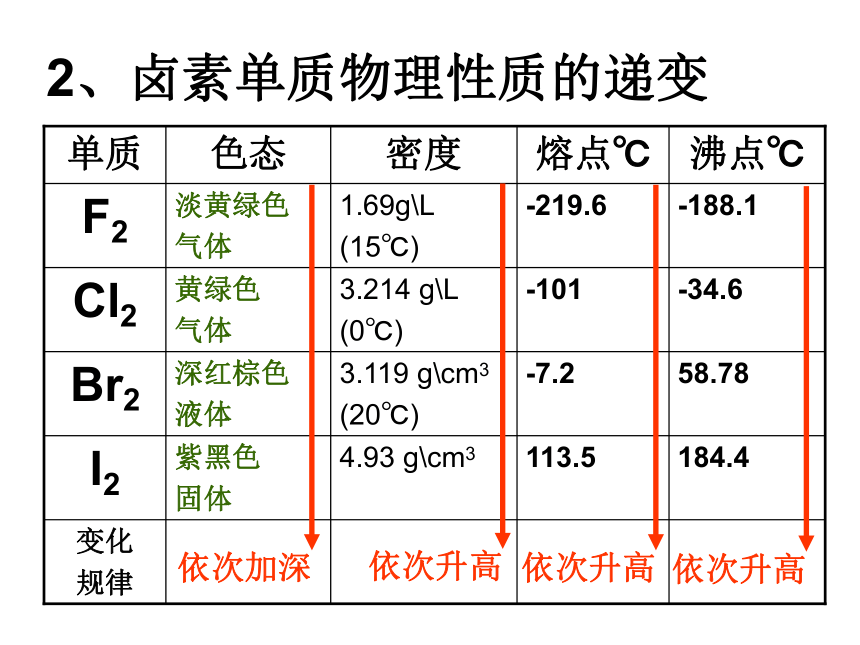
2、卤素单质物理性质的递变
3、卤族元素单质与氢气化合的反应条件
表现为:
(1)卤素单质与H2化合的难易关系:F2 >Cl2> Br2> I 2
(2)卤化氢的稳定性关系:HF > HCl > HBr > HI
小 结
卤素原子结构的相似性,决定了单质化学性质的
相似性。
与金属反应,生成卤化物。
与氢气反应,生成卤化氢。
与水反应,生成卤化氢和次卤酸。
卤素原子结构的差异性,决定了单质化学性质的
差异性和递变性
与氢反应的能力渐弱
氢化物的稳定性渐弱
与水反应的能力渐弱
特性
碘遇淀粉显蓝色。
氟气和水的反应: 2F2 +2H2O=4HF+ O2
小结
对ⅦA族元素原子从上到下,电子层数依次增多,原子半径逐渐增大,失电子能力逐渐增强,得电子能力逐渐减弱。其单质的熔、沸点在依次的增大。
对其它的主族而言适应吗?
碱金属元素
碱金属元素原子结构 原子结构
1.相同点:原子最外层电子都只有一个电子。
2.递变规律:Li Cs ,电子层数递增,原子半径渐大,核对最外层电子的引力下降。
都易失电子,具强还原性。
Li Cs越来越容易失电子,还原性逐渐增强。
化学性质
决定
请您小结
同一主族元素的金属性和非金属性变化有何规律?
自上而下,元素的金属性逐渐增强,非金属性
逐渐减弱。
试用结构观点解释为什么有这样的变化规律:
同一主族元素,最外层电子数相同。自上而下,电子层数增多,原子半径增大,失电子的能力逐渐增强,得电子的能力逐渐减弱。
在周期表中元素原子的变化规律
0
1
B
Al
Si
Ge
As
Sb
Te
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
Po
At
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
元素周期表中元素性质递变规律
大→小
小→大
电子层数相同、最外层电子增多
逐渐减小
逐渐增大
逐渐增大
逐渐减小
金属性减、非金属性增
金属性增、非金属性减
最高正价+1→+7
最高正价=族系数
碱性逐渐减弱
酸性逐渐增强
碱性逐渐增强
酸性逐渐减弱
形成:难→易
稳定性:弱→强
形成:易→难
稳定性:强→弱
电子层增多最外层电子数相同
内容 同周期(从左到右) 同主族(从上到下)
原子半径
电子层结构
失电子能力
得电子能力
金属性或非金属性
主要化合价
最高价氧化物对应的水化物酸碱性
非金属元素气态氢
化物的形成与稳定性
你能理解“位(位置)——构(结构)——性(性质)”三者之间的关系吗?
思考与交流
原子序数= 核电荷数
周期数= 电子层数
主族序数=最外层电子数
同位素-化学性质相同
相似性
递变性(从上至下,金属性增强,非金属性减弱)
同周期
同主族
递变性(从左到右,金属性减弱,非金属性增强)
电子层数
最外层电子数
金属性、非金属性强弱
(主族)最外层电子数
= 最高正价数
8 -最外层电子数= 最低负价数
原子结构
表中位置
元素性质
原子结构决定元素在周期表中的位置和性质。元素在周期表中的位置,反映了元素的原子结构和元素的性质。
1、F 没有正价,O 通常不显示正价;
2、金属元素只有正化合价而无负价。
元素周期表及元素周期律的三大意义
⑴ 学习和研究化学的规律和工具
⑵ 研究发现新物质
⑶ 论证了量变引起质变的规律性
预言新元素,研究新农药,寻找新的半导体材料、催化剂、耐高温耐腐蚀材料、寻找新的矿物质。
课堂练习:
1、相邻三个周期的主族元素A、B、C、D、E,它们的原子序数依次增大,B、C、D元素在同一周期,A、E在同一主族。除A外的各元素的原子的电子层内层已填满电子。其中B的最外层有4个电子。A与B,B与C都能生成气态的化合物。D与E生成离子化合物。在离子化合物中它们化合价的绝对值相等。试回答:它们各是什么元素?
H、C、O、F、Na
2、用A表示质子数,B 中子数,C 核外电子数,
D 最外层电子数,E 电子层数 填写下列各空:
⑴ 原子(核素)种类由_____决定
⑵ 元素种类由_____决定
⑶ 元素同位素由 _____决定
⑷ 元素在周期表中的位置由______决定
⑸ 元素的原子半径由_______决定
⑹ 元素主要化合价由______决定
⑺ 元素的化学性质主要由______决定
⑻ 价电子通常是指_______
A B
A
B
D E
A E
D
D
D
(3)实质:元素性质周期性变化是由于______
___________________________周期性
变化的必然结果。
(2)内容:元素性质的周期性变化主要体现在
_________________________、_____
________________、______________
___________等方面。
(1)定义:____________随着原子________
___________________________的规律叫做元素周期律。
元素的性质
原子序数
原子核外电子排布的周期性变化
元素
原子
元素主要化合价的
半径的周期性变化
周期性变化
的递增而呈现周期性的变化
的原子核外电子排布的周期性变化
填空
例1:下列各组元素性质递变情况错误的是( )
A.Li、Be、B原子最外层电子数依次增多
B.P、S、Cl元素最高正化合价依次升高
C.B、C、N、O、F 原子半径依次增大
D.Li、Na、K、Rb 的金属性依次增强
例2 :某元素的气态氢化物化学式为H2R,此元素最高价氧化物对应水化物的化学式可能为 ( )
A.H2RO3 B.H2RO4
C.HRO3 D.H3RO4
C
B
例题3:周期表前20号元素中,某两种元素的原子序数相差3,周期数相差1,它们形成化合物时原子数之比为1∶2。写出这些化合物的化学式是_____
____________________________。
例题4:已知A为ⅡA族元素,B为ⅢA族元素,它们的原子序数分别为m和n,且A、B为同一周期元素。下列关系式错误的是 ( )
A.n = m+1 B.n = m + 11
C.n = m + 25 D.n = m + 10
例题5:X、Y两元素处于同一主族相邻周期,则X、Y两元素的原子序数相差不可能为下列哪一数值
( )
A.2 B.8 C.10 D.18
例题6:第114号元素是化学家和物理学家很感兴趣的元素,试推测此元素在周期表中的位置 ( )
A.第八周期ⅢA族 B.第六周期ⅤA族
C.第七周期ⅣB族 D.第七周期ⅣA族
1.主族元素的最高正化合价一般等于其_____序数,非金属元素的负化合价等于_____________________。
2.卤族元素的原子最外层上的电子数是____,其中,非金属性最强的是____。卤素的最高价氧化物对应水化物的化学式是______(以X表示卤素)。
主族
8-主族序数(8-最高正价)
7
F
HXO
注:氟元素无最高价氧化物及其水合物,因为氟元素无正化合价
3.下列性质的递变中,正确的是 ( )?
A.O、S、Na的原子半径依次增大
B.LiOH、KOH、CsOH的碱性依次增强
C.HF、NH3、SiH4的稳定性依次增强
D.HCl、HBr、HI的还原性依次减弱?
AB
4.某元素X的原子序数为52,下列叙述正确的是 ( )?
A.X的主要化合价是-2、+4、+6?
B.X可以形成稳定的气态氢化物?
C.X的最高价氧化物对应水化物的酸性
比HBrO4的酸性强?
D.X原子的还原性比碘原子强?
AD
5.已知铍(Be)的原子序数为4。下列对铍及其化合物的叙述中,正确的是 ( )
A.铍的原子半径大于硼的原子半径?
B.氯化铍化学式中铍原子的最外层电子
数是8*?
C.氢氧化铍的碱性比氢氧化钙的弱?
D.单质铍跟冷水反应产生氢气
AC
6.X、Y是元素周期表中Ⅶ A族中的两种元素,下列叙述中能说明X的非金属比Y强的是
( )
A.X原子的电子层数比Y原子的电子层数多
B.X的氢化物的沸点比Y的氢化物沸点低*
C.X的气态氢化物比Y的气态氢化物稳定
D.Y的单质能将X从NaX的溶液中置换出来
C
7、下列变化的比较, 不正确的是:( )
A.???酸性强弱: HClO4 > H2SO4 > H3PO4 > H4SiO4
B.??? 原子半径大小: Na > S > O
C.??? 碱性强弱: KOH > NaOH > LiOH????
D.??? 还原性强弱: F- > Cl- > I-
8、下列各组中,属于同位素的是:( ? )
A.H2、D2、T2?? B 金刚石和足球烯C60???
C。H2O和D2O???? D 16O和18O
D
D
第一章
第三节 元素周期律的应用(2)
认识同主族元素性质的递变规律
复习回顾:
从左向右,元素的金属性逐渐减弱,非金属性逐渐增强。
试用结构观点解释为什么有这样的变化规律:
同一周期元素,电子层数相同。从左向右,核电荷数增多,原子半径减小,失电子的能力逐渐减弱,得电子的能力逐渐增强。
同一周期元素的金属性和非金属性变化有何规律?
在周期表中的变化规律
二、预测同主族元素的性质
1、ⅦA族元素
(1) ⅦA族元素的原子结构
原子结构
决定
性质
最外层7个电子
易得一个电子,
具氧化性
核电荷数递增
电子层数递增
原子半径依次增大
得电子能力逐渐减弱
(1)相似性
7 7 7 7
0 +7 +7 +7
-1 -1 -1 -1
HF HCl HBr HI
无 HClO4 HBrO4 HIO4
元素 氟(F) 氯(Cl) 溴(Br) 碘(I)
最外层电子数
最高化合价
最低化合价
气态氢化物
最高价含氧酸
2、卤素单质物理性质的递变
3、卤族元素单质与氢气化合的反应条件
表现为:
(1)卤素单质与H2化合的难易关系:F2 >Cl2> Br2> I 2
(2)卤化氢的稳定性关系:HF > HCl > HBr > HI
小 结
卤素原子结构的相似性,决定了单质化学性质的
相似性。
与金属反应,生成卤化物。
与氢气反应,生成卤化氢。
与水反应,生成卤化氢和次卤酸。
卤素原子结构的差异性,决定了单质化学性质的
差异性和递变性
与氢反应的能力渐弱
氢化物的稳定性渐弱
与水反应的能力渐弱
特性
碘遇淀粉显蓝色。
氟气和水的反应: 2F2 +2H2O=4HF+ O2
小结
对ⅦA族元素原子从上到下,电子层数依次增多,原子半径逐渐增大,失电子能力逐渐增强,得电子能力逐渐减弱。其单质的熔、沸点在依次的增大。
对其它的主族而言适应吗?
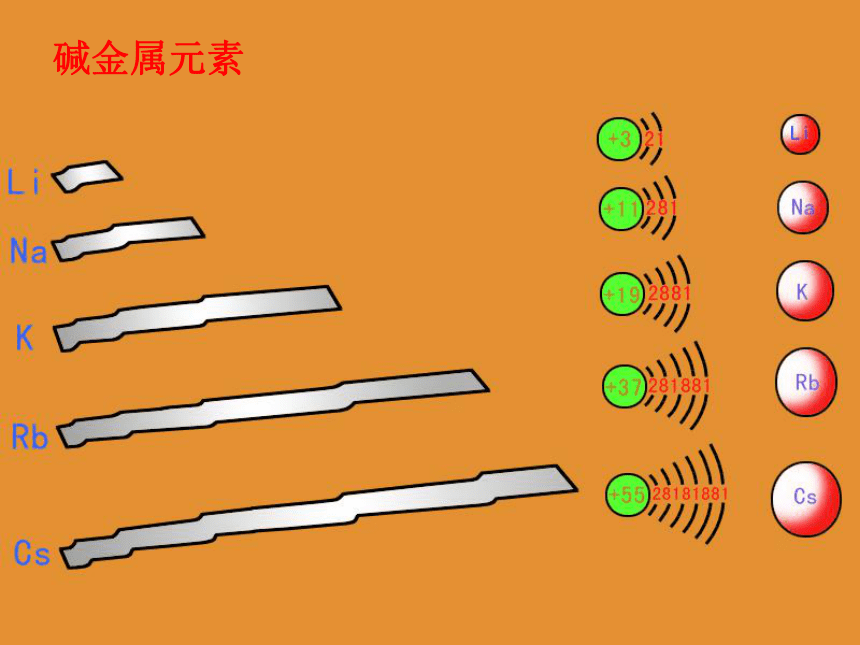
碱金属元素
碱金属元素原子结构 原子结构
1.相同点:原子最外层电子都只有一个电子。
2.递变规律:Li Cs ,电子层数递增,原子半径渐大,核对最外层电子的引力下降。
都易失电子,具强还原性。
Li Cs越来越容易失电子,还原性逐渐增强。
化学性质
决定
请您小结
同一主族元素的金属性和非金属性变化有何规律?
自上而下,元素的金属性逐渐增强,非金属性
逐渐减弱。
试用结构观点解释为什么有这样的变化规律:
同一主族元素,最外层电子数相同。自上而下,电子层数增多,原子半径增大,失电子的能力逐渐增强,得电子的能力逐渐减弱。
在周期表中元素原子的变化规律
0
1
B
Al
Si
Ge
As
Sb
Te
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
Po
At
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
元素周期表中元素性质递变规律
大→小
小→大
电子层数相同、最外层电子增多
逐渐减小
逐渐增大
逐渐增大
逐渐减小
金属性减、非金属性增
金属性增、非金属性减
最高正价+1→+7
最高正价=族系数
碱性逐渐减弱
酸性逐渐增强
碱性逐渐增强
酸性逐渐减弱
形成:难→易
稳定性:弱→强
形成:易→难
稳定性:强→弱
电子层增多最外层电子数相同
内容 同周期(从左到右) 同主族(从上到下)
原子半径
电子层结构
失电子能力
得电子能力
金属性或非金属性
主要化合价
最高价氧化物对应的水化物酸碱性
非金属元素气态氢
化物的形成与稳定性
你能理解“位(位置)——构(结构)——性(性质)”三者之间的关系吗?
思考与交流
原子序数= 核电荷数
周期数= 电子层数
主族序数=最外层电子数
同位素-化学性质相同
相似性
递变性(从上至下,金属性增强,非金属性减弱)
同周期
同主族
递变性(从左到右,金属性减弱,非金属性增强)
电子层数
最外层电子数
金属性、非金属性强弱
(主族)最外层电子数
= 最高正价数
8 -最外层电子数= 最低负价数
原子结构
表中位置
元素性质
原子结构决定元素在周期表中的位置和性质。元素在周期表中的位置,反映了元素的原子结构和元素的性质。
1、F 没有正价,O 通常不显示正价;
2、金属元素只有正化合价而无负价。
元素周期表及元素周期律的三大意义
⑴ 学习和研究化学的规律和工具
⑵ 研究发现新物质
⑶ 论证了量变引起质变的规律性
预言新元素,研究新农药,寻找新的半导体材料、催化剂、耐高温耐腐蚀材料、寻找新的矿物质。
课堂练习:
1、相邻三个周期的主族元素A、B、C、D、E,它们的原子序数依次增大,B、C、D元素在同一周期,A、E在同一主族。除A外的各元素的原子的电子层内层已填满电子。其中B的最外层有4个电子。A与B,B与C都能生成气态的化合物。D与E生成离子化合物。在离子化合物中它们化合价的绝对值相等。试回答:它们各是什么元素?
H、C、O、F、Na
2、用A表示质子数,B 中子数,C 核外电子数,
D 最外层电子数,E 电子层数 填写下列各空:
⑴ 原子(核素)种类由_____决定
⑵ 元素种类由_____决定
⑶ 元素同位素由 _____决定
⑷ 元素在周期表中的位置由______决定
⑸ 元素的原子半径由_______决定
⑹ 元素主要化合价由______决定
⑺ 元素的化学性质主要由______决定
⑻ 价电子通常是指_______
A B
A
B
D E
A E
D
D
D
(3)实质:元素性质周期性变化是由于______
___________________________周期性
变化的必然结果。
(2)内容:元素性质的周期性变化主要体现在
_________________________、_____
________________、______________
___________等方面。
(1)定义:____________随着原子________
___________________________的规律叫做元素周期律。
元素的性质
原子序数
原子核外电子排布的周期性变化
元素
原子
元素主要化合价的
半径的周期性变化
周期性变化
的递增而呈现周期性的变化
的原子核外电子排布的周期性变化
填空
例1:下列各组元素性质递变情况错误的是( )
A.Li、Be、B原子最外层电子数依次增多
B.P、S、Cl元素最高正化合价依次升高
C.B、C、N、O、F 原子半径依次增大
D.Li、Na、K、Rb 的金属性依次增强
例2 :某元素的气态氢化物化学式为H2R,此元素最高价氧化物对应水化物的化学式可能为 ( )
A.H2RO3 B.H2RO4
C.HRO3 D.H3RO4
C
B
例题3:周期表前20号元素中,某两种元素的原子序数相差3,周期数相差1,它们形成化合物时原子数之比为1∶2。写出这些化合物的化学式是_____
____________________________。
例题4:已知A为ⅡA族元素,B为ⅢA族元素,它们的原子序数分别为m和n,且A、B为同一周期元素。下列关系式错误的是 ( )
A.n = m+1 B.n = m + 11
C.n = m + 25 D.n = m + 10
例题5:X、Y两元素处于同一主族相邻周期,则X、Y两元素的原子序数相差不可能为下列哪一数值
( )
A.2 B.8 C.10 D.18
例题6:第114号元素是化学家和物理学家很感兴趣的元素,试推测此元素在周期表中的位置 ( )
A.第八周期ⅢA族 B.第六周期ⅤA族
C.第七周期ⅣB族 D.第七周期ⅣA族
1.主族元素的最高正化合价一般等于其_____序数,非金属元素的负化合价等于_____________________。
2.卤族元素的原子最外层上的电子数是____,其中,非金属性最强的是____。卤素的最高价氧化物对应水化物的化学式是______(以X表示卤素)。
主族
8-主族序数(8-最高正价)
7
F
HXO
注:氟元素无最高价氧化物及其水合物,因为氟元素无正化合价
3.下列性质的递变中,正确的是 ( )?
A.O、S、Na的原子半径依次增大
B.LiOH、KOH、CsOH的碱性依次增强
C.HF、NH3、SiH4的稳定性依次增强
D.HCl、HBr、HI的还原性依次减弱?
AB
4.某元素X的原子序数为52,下列叙述正确的是 ( )?
A.X的主要化合价是-2、+4、+6?
B.X可以形成稳定的气态氢化物?
C.X的最高价氧化物对应水化物的酸性
比HBrO4的酸性强?
D.X原子的还原性比碘原子强?
AD
5.已知铍(Be)的原子序数为4。下列对铍及其化合物的叙述中,正确的是 ( )
A.铍的原子半径大于硼的原子半径?
B.氯化铍化学式中铍原子的最外层电子
数是8*?
C.氢氧化铍的碱性比氢氧化钙的弱?
D.单质铍跟冷水反应产生氢气
AC
6.X、Y是元素周期表中Ⅶ A族中的两种元素,下列叙述中能说明X的非金属比Y强的是
( )
A.X原子的电子层数比Y原子的电子层数多
B.X的氢化物的沸点比Y的氢化物沸点低*
C.X的气态氢化物比Y的气态氢化物稳定
D.Y的单质能将X从NaX的溶液中置换出来
C
7、下列变化的比较, 不正确的是:( )
A.???酸性强弱: HClO4 > H2SO4 > H3PO4 > H4SiO4
B.??? 原子半径大小: Na > S > O
C.??? 碱性强弱: KOH > NaOH > LiOH????
D.??? 还原性强弱: F- > Cl- > I-
8、下列各组中,属于同位素的是:( ? )
A.H2、D2、T2?? B 金刚石和足球烯C60???
C。H2O和D2O???? D 16O和18O
D
D
