鲁科版高中化学必修二2,2 化学反应的限度(40张ppt)
文档属性
| 名称 | 鲁科版高中化学必修二2,2 化学反应的限度(40张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 887.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-03-05 00:00:00 | ||
图片预览










文档简介
课件40张PPT。第二章 化学反应的方向、限度与速率化学反应的限度第二节知识回顾 已知合成氨反应: N2(g)+3H2(g) 2NH3(g)
在298K时:ΔH=-92.2kJ·mol-1
ΔS= -198.2J·K -1 ·mol-1
请根据反应的焓变和熵变分析298K时合成氨反应能否自发进行。根据判据计算:
ΔH - TΔS
= -92.2kJ·mol-1 -298K×(-198.2×10-3kJ·K -1 ·mol-1 )
=-33.1 kJ·mol-1 <0
该反应常温下能自发进行,这是否就足够了呢?1.可逆反应
(1)定义:
条件下,既能向 方向进行,又能向 方向进行的化学反应。
(2)特点
①相同条件,正、逆反应 ;
②反应物与生成物同时存在;
③任一组分的转化率均 100%。相同正反应逆反应同时进行小于知识回顾2.化学平衡状态
(1)概念:一定条件下的可逆反应中,正反应速率与逆反应速率 ,反应体系中所有参加反应的物质的 保持不变的状态。
(2)特征
①动:化学平衡是一种动态平衡。
②等: 。
③定:反应物和生成物的 保持不变。
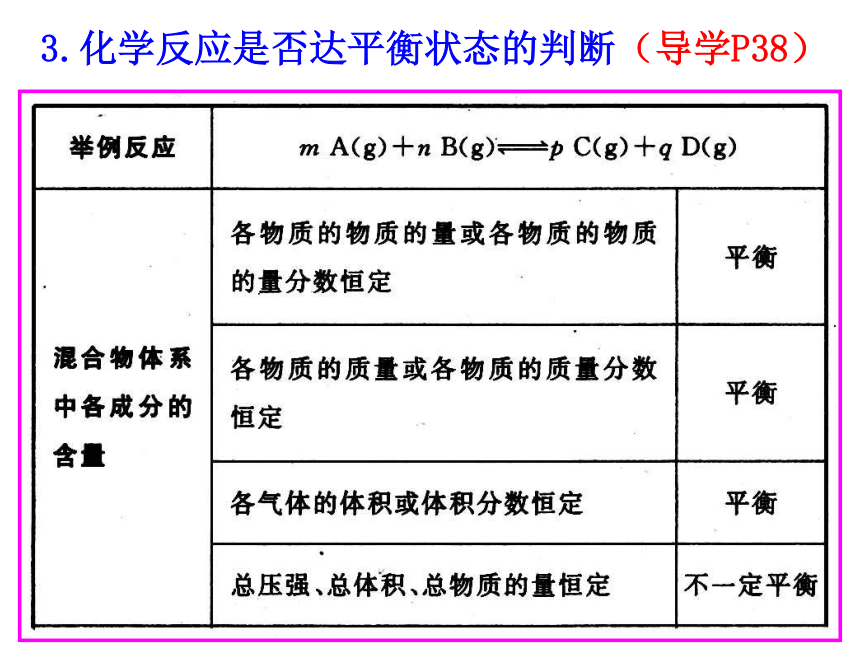
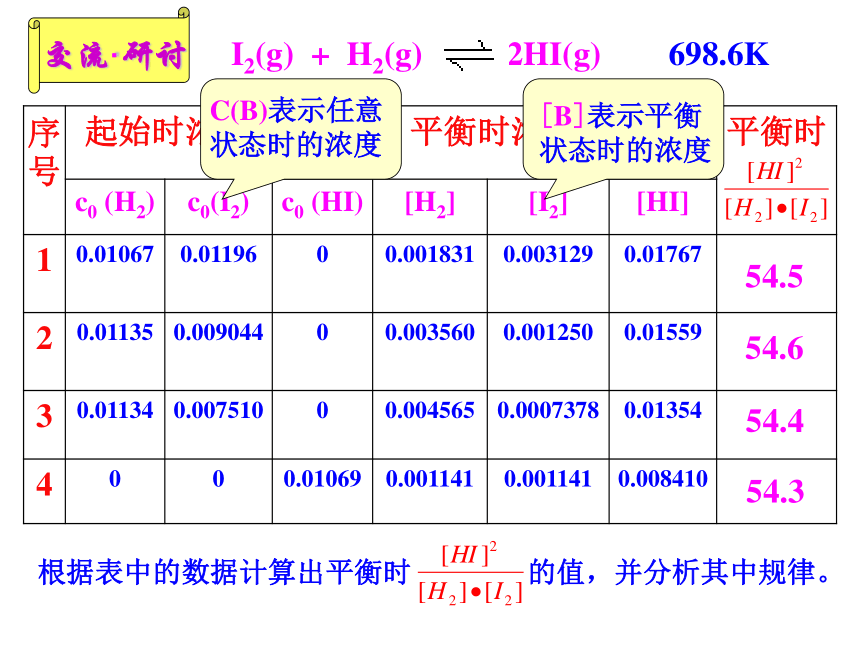
④变:条件改变,平衡状态可能改变,新条件下建立新的平衡状态。v(正)=v(逆)相等浓度浓度知识回顾3.化学反应是否达平衡状态的判断(导学P38)3.化学反应是否达平衡状态的判断(导学P38)3.化学反应是否达平衡状态的判断(导学P38) 可逆反应进行到一定程度就会达到平衡状态,你知道这时平衡体系中反应物和生成物各占多少吗?反应到底进行到什么程度? 为更准确的了解可逆反应的进程,定量的描述化学反应的限度,我们将学习一个新的概念—— 化学平衡常数54.554.654.454.3规律小结(课本P42第一段)通过分析实验数据得出:
(1)温度相同时,达到化学平衡状态
为一常数;
(2)这个常数与反应的起始浓度大小无关;
(3)这个常数与正向建立还是逆向建立平衡无关即与平衡建立的过程无关。一、化学平衡常数(K)1、定义:
在一定温度时,当一个可逆反应达到平衡状态时,生成物平衡浓度的幂次方之积与反应物平衡浓度的幂次方之积的比值是一个常数,这个常数称为化学平衡常数简称平衡常数。2、表达式:3、平衡常数关系式的书写规则(2)同一个可逆反应,平衡常数的表达式不是唯一的,它与化学方程式的书写方式有关。书写方式不同,各反应物、生成物的化学计量数不同,平衡常数表达式就不同。每个化学方程式都有自己的平衡常数关系式及相应的平衡常数。(阅读课本P43)
(3)对于同一个反应,正反应和逆反应的平衡常数互为倒数。
(4)平衡常数的单位与化学方程式表示形式相对应。写出下表中各反应的平衡常数表达式。mol·L-11(mol·L-1 )2(mol·L-1) -1(mol·L-1) -2(mol·L-1) 2 平衡常数的大小反映了化学反应可能进行的程度,平衡常数的数值越大,说明反应进行得越完全。
一般说来,如果一个反应的平衡常数大于105,通常认为反应可以进行得较完全;相反,如果一个反应的平衡常数小于10-5,则认为这个反应很难进行。(阅读课本P43表2-2-1) 4、平衡常数K的意义对于放热反应:
升高温度,K值 ;反之K值 。
对于吸热反应:
升高温度,K值 ;反之K值 。5、影响因素--K只与温度有关增大减小减小增大(1)判断、比较可逆反应进行程度的大小。
K值越大,反应进行的程度越大;
K值越小,反应进行的程度越小。
(2)判断可逆反应是否达到化学平衡状态
对于可逆反应aA(g)+bB(g)?? cC(g)+dD(g),在一定温度下的任意时刻,反应物与生成物浓度有如下关系:6、应用迁移应用例1、(2006上海,25)
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示 ,
K值大小与温度的关系是温度升高,
K值 。(填“一定增大”“一定减小”或“可能增大也可能减小”)。化学反应进行的程度越大可能增大也可能减小例2.
高温下,某反应达到平衡,平衡常数K= 。
恒容时,温度升高,H2浓度减小。下列说法正确的是
A.该反应是焓变为正值 ( )
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应化学方程式为CO+H2O CO2+H2A二、平衡转化率(α) 可逆反应在一定条件下达到平衡时,某一反应物的平衡转化率(常用字母α 表示)可以表示为:
该反应物的起始浓度—该反应物的平衡浓度×100%
该反应物的起始浓度α=用符号表示为: 有关化学平衡问题的计算,可按下列步骤建立模式,确定关系进行计算。例如:可逆反应mA(g)+nB(g)?? pC(g)+qD(g),假定反应物A、B的起始加入量分别为a mol、b mol,达到平衡时,设A物质转化的物质的量为mx mol。
(1)模式: mA(g)+nB(g)?? pC(g)+qD(g)
起始量 a b 0 0
转化量 mx nx px qx
平衡量 a-mx b-nx px qx
对于反应物:n(平)=n(始)-n(变)
对于生成物:n(平)=n(始)+n(变)有关化学平衡问题的“三段式”计算强调:各物质间的转化量须根据化学方程式计算(2)解题步骤
①确定反应物或生成物的起始加入量。
②确定反应过程的转化量。
③确定平衡量。
④依据题干中的条件建立等式关系进行解答。
【名师点击】解答化学平衡计算题,要注意构建解题模式,熟练掌握有关物质的量、物质的量浓度、转化率、产率、某组分百分含量等各种计算关系式,并不断总结各种题型的解题方法、技巧及规律。课本P44-45例1、例2观察、分析表2-2-2中数据,你能得出什么结论?表2-2-21200℃下,反应H2(g)+CO2(g) H2O(g)+ CO(g)
的不同反应浓度及相应的平衡转化率结论①增大一种反应物浓度,可以提高另一种反应物的转化率
②反应物初始浓度之比等于计量数之比时,其转化率相等
③由平衡常数可计算转化率,由转化率也可计算平衡常数例3、(2007海南·16)PCl5的热分解反应如下: PCl5(g) PCl3(g)+ Cl2(g) (1)? 写出反应的平衡常数表达式; (2)? 已知某温度下,在容积为10.0L的密闭容器中充入2.00mol PCl5,达到平衡后,测得容器内PCl3的浓度为0.150mol/L。计算该温度下的平衡常数。例4、(2007山东,28)
二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容这一。 (1)硫酸生产中,SO2催化氧化生成SO3:
2SO2(g)+O2 2SO3(g)
某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如图所示。根据图示回答下列问题:
①将2.0molSO2和1.0molO2置于10L密闭容器中,反应达平衡后体系总压强为0.10MPa.该反应的平衡常数等于 。
②平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”“<”或“=”)例5、已知可逆反应:
M(g)+N(g) P(g)+Q(g) ΔH>0,
请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:
c(M)=1 mol·L-1,c(N)=2.4 mol·L-1;达到平衡后,M的转化率为60%,此时N的转化率为 ;
(2)若反应温度升高,M的转化率为 (填
“增大”、“减小”或“不变”);
(3)若反应温度不变,反应物起始浓度分别为:c(M)=4 mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a= 。化学平衡移动:由于温度、压强、浓度的变化而使可逆反应由一个平衡状态变为另一个平衡状态的过程,称为化学平衡移动
平衡正向移动(或向右移动):
平衡移动的结果使生成物浓度更大
平衡逆向移动(或向左移动):
平衡移动的结果使生成物浓度小
(1)原因:反应条件改变引起 。
(2)方向:
若v(正)>v(逆)时,平衡向 方向移动;
若v(正)<v(逆)时,平衡向 方向移动。v(正)≠v(逆)正反应逆反应三、反应条件对化学平衡的影响减小正向增大逆向1.温度对化学平衡的影响正向正向 升高温度,化学平衡向吸热方向移动;
降低温度,化学平衡向放热方向移动。1、温度对化学平衡的影响(课本P47最后一段)结论温度对化学平衡的影响是通过改变平衡常数实现的。(课本P47最后一段) 在一定体积的密闭容器中,反应CO2(g) + H2(g) CO(g) + H2O(g) 的化学平衡常数和温度的关系如下表:回答下列问题:
(1)该反应的化学平衡常数表达式K= 。
(2)该反应的正反应为 反应(填“吸热”或“放热”)。
(3)某温度下,平衡浓度符合下式:c(CO2) · c(H2)
=c(CO) · c(H2O),可判断此时的温度为 ℃。吸热830迁移 应用正 向逆 向 请根据反应 Fe3+(aq) + 3SCN-(aq) Fe(SCN)3(aq)
的平衡常数K与浓度商Q = 的关系,
讨论改变反应物或生成物浓度对化学平衡的影响。Q < KQ > K2.浓度对化学平衡的影响 请根据提供的试剂和仪器,按照设计的
实验方案证明上述预测。
试剂:0.01 mol·L-1 FeCl3溶液、0.03 mol·L-1KSCN溶液、
1mol·L-1 FeCl3溶液、1mol·L-1KSCN溶液
仪器:胶头滴管、点滴板等溶液呈血红色后加深平衡正向移动溶液呈血红色后加深平衡正向移动 提高O2在原料气中的比例,使SO2的平衡转化率提高,从而降低生产成本。阅读课本P49第一段改变浓度,若Q 若Q>K,平衡逆向移动。增大反应物浓度或减小生成物浓度,平衡正向移动;
减小反应物浓度或增大生成物浓度,平衡逆向移动。结论3.压强对化学平衡的影响△γg=0△γg<0△γg>0气体体积减小气体体积增大不3.压强对化学平衡的影响①若a+b≠p + q
增大压强,平衡向 的方向移动;
减小压强,平衡向 的方向移动。
②若a+b=p + q
改变压强,平衡 移动。讨论(课本P49)阅读课本P50第一段原平衡状态 新平衡状态 平 衡 移 动浓度
可借助Q与K的相对大小判断温度
温度对化学平衡的影响是
通过改变平衡常数来实现的压强 可借助Q与K的相对大小判断1、在密闭容器中进行下列反应
CO2(g)+C(s) 2CO(g) ΔH>0,达到平衡后,改变下列条件,则指定物质的浓度及平衡如何变化:
(1)增加C,平衡________,c(CO)______。
(2)减小密闭容器体积,保持温度不变,则平衡___________,c(CO2)______。
(3)通入N2,保持密闭容器体积和温度不变,则平衡________,c(CO2)______。
(4)保持密闭容器体积不变,升高温度,则平衡_________,c(CO)________。 不移动不变逆向移动增大不移动不变正向移动增大2、关节炎病因是在关节滑液中形成尿酸钠晶体,尤其在寒冷季节易诱发关节疼痛。其化学机理为:
①HUr + H2O Ur -+ H3O+
尿酸 尿酸根离子
②Ur-(aq)+Na+(aq) NaUr(s)
下列对反应②叙述中正确的是( )
A. 正反应的△H>0
B. 正反应的△H<0
C. 升高温度,平衡正向移动
D. 降低温度,平衡正向移动B D3、(2007上海,25)
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
CO(g)+2H2(g) CH3OH(g)
(1)反应达到平衡时,平衡常数表达式K=_____,
升高温度,K值 ___ (填“增大”“减小”或“不变”)。(后略)减小同学们,再见!
在298K时:ΔH=-92.2kJ·mol-1
ΔS= -198.2J·K -1 ·mol-1
请根据反应的焓变和熵变分析298K时合成氨反应能否自发进行。根据判据计算:
ΔH - TΔS
= -92.2kJ·mol-1 -298K×(-198.2×10-3kJ·K -1 ·mol-1 )
=-33.1 kJ·mol-1 <0
该反应常温下能自发进行,这是否就足够了呢?1.可逆反应
(1)定义:
条件下,既能向 方向进行,又能向 方向进行的化学反应。
(2)特点
①相同条件,正、逆反应 ;
②反应物与生成物同时存在;
③任一组分的转化率均 100%。相同正反应逆反应同时进行小于知识回顾2.化学平衡状态
(1)概念:一定条件下的可逆反应中,正反应速率与逆反应速率 ,反应体系中所有参加反应的物质的 保持不变的状态。
(2)特征
①动:化学平衡是一种动态平衡。
②等: 。
③定:反应物和生成物的 保持不变。
④变:条件改变,平衡状态可能改变,新条件下建立新的平衡状态。v(正)=v(逆)相等浓度浓度知识回顾3.化学反应是否达平衡状态的判断(导学P38)3.化学反应是否达平衡状态的判断(导学P38)3.化学反应是否达平衡状态的判断(导学P38) 可逆反应进行到一定程度就会达到平衡状态,你知道这时平衡体系中反应物和生成物各占多少吗?反应到底进行到什么程度? 为更准确的了解可逆反应的进程,定量的描述化学反应的限度,我们将学习一个新的概念—— 化学平衡常数54.554.654.454.3规律小结(课本P42第一段)通过分析实验数据得出:
(1)温度相同时,达到化学平衡状态
为一常数;
(2)这个常数与反应的起始浓度大小无关;
(3)这个常数与正向建立还是逆向建立平衡无关即与平衡建立的过程无关。一、化学平衡常数(K)1、定义:
在一定温度时,当一个可逆反应达到平衡状态时,生成物平衡浓度的幂次方之积与反应物平衡浓度的幂次方之积的比值是一个常数,这个常数称为化学平衡常数简称平衡常数。2、表达式:3、平衡常数关系式的书写规则(2)同一个可逆反应,平衡常数的表达式不是唯一的,它与化学方程式的书写方式有关。书写方式不同,各反应物、生成物的化学计量数不同,平衡常数表达式就不同。每个化学方程式都有自己的平衡常数关系式及相应的平衡常数。(阅读课本P43)
(3)对于同一个反应,正反应和逆反应的平衡常数互为倒数。
(4)平衡常数的单位与化学方程式表示形式相对应。写出下表中各反应的平衡常数表达式。mol·L-11(mol·L-1 )2(mol·L-1) -1(mol·L-1) -2(mol·L-1) 2 平衡常数的大小反映了化学反应可能进行的程度,平衡常数的数值越大,说明反应进行得越完全。
一般说来,如果一个反应的平衡常数大于105,通常认为反应可以进行得较完全;相反,如果一个反应的平衡常数小于10-5,则认为这个反应很难进行。(阅读课本P43表2-2-1) 4、平衡常数K的意义对于放热反应:
升高温度,K值 ;反之K值 。
对于吸热反应:
升高温度,K值 ;反之K值 。5、影响因素--K只与温度有关增大减小减小增大(1)判断、比较可逆反应进行程度的大小。
K值越大,反应进行的程度越大;
K值越小,反应进行的程度越小。
(2)判断可逆反应是否达到化学平衡状态
对于可逆反应aA(g)+bB(g)?? cC(g)+dD(g),在一定温度下的任意时刻,反应物与生成物浓度有如下关系:6、应用迁移应用例1、(2006上海,25)
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示 ,
K值大小与温度的关系是温度升高,
K值 。(填“一定增大”“一定减小”或“可能增大也可能减小”)。化学反应进行的程度越大可能增大也可能减小例2.
高温下,某反应达到平衡,平衡常数K= 。
恒容时,温度升高,H2浓度减小。下列说法正确的是
A.该反应是焓变为正值 ( )
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应化学方程式为CO+H2O CO2+H2A二、平衡转化率(α) 可逆反应在一定条件下达到平衡时,某一反应物的平衡转化率(常用字母α 表示)可以表示为:
该反应物的起始浓度—该反应物的平衡浓度×100%
该反应物的起始浓度α=用符号表示为: 有关化学平衡问题的计算,可按下列步骤建立模式,确定关系进行计算。例如:可逆反应mA(g)+nB(g)?? pC(g)+qD(g),假定反应物A、B的起始加入量分别为a mol、b mol,达到平衡时,设A物质转化的物质的量为mx mol。
(1)模式: mA(g)+nB(g)?? pC(g)+qD(g)
起始量 a b 0 0
转化量 mx nx px qx
平衡量 a-mx b-nx px qx
对于反应物:n(平)=n(始)-n(变)
对于生成物:n(平)=n(始)+n(变)有关化学平衡问题的“三段式”计算强调:各物质间的转化量须根据化学方程式计算(2)解题步骤
①确定反应物或生成物的起始加入量。
②确定反应过程的转化量。
③确定平衡量。
④依据题干中的条件建立等式关系进行解答。
【名师点击】解答化学平衡计算题,要注意构建解题模式,熟练掌握有关物质的量、物质的量浓度、转化率、产率、某组分百分含量等各种计算关系式,并不断总结各种题型的解题方法、技巧及规律。课本P44-45例1、例2观察、分析表2-2-2中数据,你能得出什么结论?表2-2-21200℃下,反应H2(g)+CO2(g) H2O(g)+ CO(g)
的不同反应浓度及相应的平衡转化率结论①增大一种反应物浓度,可以提高另一种反应物的转化率
②反应物初始浓度之比等于计量数之比时,其转化率相等
③由平衡常数可计算转化率,由转化率也可计算平衡常数例3、(2007海南·16)PCl5的热分解反应如下: PCl5(g) PCl3(g)+ Cl2(g) (1)? 写出反应的平衡常数表达式; (2)? 已知某温度下,在容积为10.0L的密闭容器中充入2.00mol PCl5,达到平衡后,测得容器内PCl3的浓度为0.150mol/L。计算该温度下的平衡常数。例4、(2007山东,28)
二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容这一。 (1)硫酸生产中,SO2催化氧化生成SO3:
2SO2(g)+O2 2SO3(g)
某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如图所示。根据图示回答下列问题:
①将2.0molSO2和1.0molO2置于10L密闭容器中,反应达平衡后体系总压强为0.10MPa.该反应的平衡常数等于 。
②平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”“<”或“=”)例5、已知可逆反应:
M(g)+N(g) P(g)+Q(g) ΔH>0,
请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:
c(M)=1 mol·L-1,c(N)=2.4 mol·L-1;达到平衡后,M的转化率为60%,此时N的转化率为 ;
(2)若反应温度升高,M的转化率为 (填
“增大”、“减小”或“不变”);
(3)若反应温度不变,反应物起始浓度分别为:c(M)=4 mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a= 。化学平衡移动:由于温度、压强、浓度的变化而使可逆反应由一个平衡状态变为另一个平衡状态的过程,称为化学平衡移动
平衡正向移动(或向右移动):
平衡移动的结果使生成物浓度更大
平衡逆向移动(或向左移动):
平衡移动的结果使生成物浓度小
(1)原因:反应条件改变引起 。
(2)方向:
若v(正)>v(逆)时,平衡向 方向移动;
若v(正)<v(逆)时,平衡向 方向移动。v(正)≠v(逆)正反应逆反应三、反应条件对化学平衡的影响减小正向增大逆向1.温度对化学平衡的影响正向正向 升高温度,化学平衡向吸热方向移动;
降低温度,化学平衡向放热方向移动。1、温度对化学平衡的影响(课本P47最后一段)结论温度对化学平衡的影响是通过改变平衡常数实现的。(课本P47最后一段) 在一定体积的密闭容器中,反应CO2(g) + H2(g) CO(g) + H2O(g) 的化学平衡常数和温度的关系如下表:回答下列问题:
(1)该反应的化学平衡常数表达式K= 。
(2)该反应的正反应为 反应(填“吸热”或“放热”)。
(3)某温度下,平衡浓度符合下式:c(CO2) · c(H2)
=c(CO) · c(H2O),可判断此时的温度为 ℃。吸热830迁移 应用正 向逆 向 请根据反应 Fe3+(aq) + 3SCN-(aq) Fe(SCN)3(aq)
的平衡常数K与浓度商Q = 的关系,
讨论改变反应物或生成物浓度对化学平衡的影响。Q < KQ > K2.浓度对化学平衡的影响 请根据提供的试剂和仪器,按照设计的
实验方案证明上述预测。
试剂:0.01 mol·L-1 FeCl3溶液、0.03 mol·L-1KSCN溶液、
1mol·L-1 FeCl3溶液、1mol·L-1KSCN溶液
仪器:胶头滴管、点滴板等溶液呈血红色后加深平衡正向移动溶液呈血红色后加深平衡正向移动 提高O2在原料气中的比例,使SO2的平衡转化率提高,从而降低生产成本。阅读课本P49第一段改变浓度,若Q
减小反应物浓度或增大生成物浓度,平衡逆向移动。结论3.压强对化学平衡的影响△γg=0△γg<0△γg>0气体体积减小气体体积增大不3.压强对化学平衡的影响①若a+b≠p + q
增大压强,平衡向 的方向移动;
减小压强,平衡向 的方向移动。
②若a+b=p + q
改变压强,平衡 移动。讨论(课本P49)阅读课本P50第一段原平衡状态 新平衡状态 平 衡 移 动浓度
可借助Q与K的相对大小判断温度
温度对化学平衡的影响是
通过改变平衡常数来实现的压强 可借助Q与K的相对大小判断1、在密闭容器中进行下列反应
CO2(g)+C(s) 2CO(g) ΔH>0,达到平衡后,改变下列条件,则指定物质的浓度及平衡如何变化:
(1)增加C,平衡________,c(CO)______。
(2)减小密闭容器体积,保持温度不变,则平衡___________,c(CO2)______。
(3)通入N2,保持密闭容器体积和温度不变,则平衡________,c(CO2)______。
(4)保持密闭容器体积不变,升高温度,则平衡_________,c(CO)________。 不移动不变逆向移动增大不移动不变正向移动增大2、关节炎病因是在关节滑液中形成尿酸钠晶体,尤其在寒冷季节易诱发关节疼痛。其化学机理为:
①HUr + H2O Ur -+ H3O+
尿酸 尿酸根离子
②Ur-(aq)+Na+(aq) NaUr(s)
下列对反应②叙述中正确的是( )
A. 正反应的△H>0
B. 正反应的△H<0
C. 升高温度,平衡正向移动
D. 降低温度,平衡正向移动B D3、(2007上海,25)
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
CO(g)+2H2(g) CH3OH(g)
(1)反应达到平衡时,平衡常数表达式K=_____,
升高温度,K值 ___ (填“增大”“减小”或“不变”)。(后略)减小同学们,再见!
