鲁科版高中化学必修二第一章第二节 元素周期律和元素周期表(34张ppt)
文档属性
| 名称 | 鲁科版高中化学必修二第一章第二节 元素周期律和元素周期表(34张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 959.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-03-05 00:00:00 | ||
图片预览






文档简介
课件34张PPT。第2节 元素周期律和元素周期表【思考】
(1)第一张元素周期表是谁绘制的?
(2)元素周期表和元素周期律有什么关系?
(3)元素的哪些性质有周期性的变化?1.了解原子核外电子排布、原子半径、主要化合价的周期性变化,认识元素周期律。(重点)
2.认识元素周期表(长式)的结构,理解原子结构与元素在周期表中的位置间的关系。(重点)
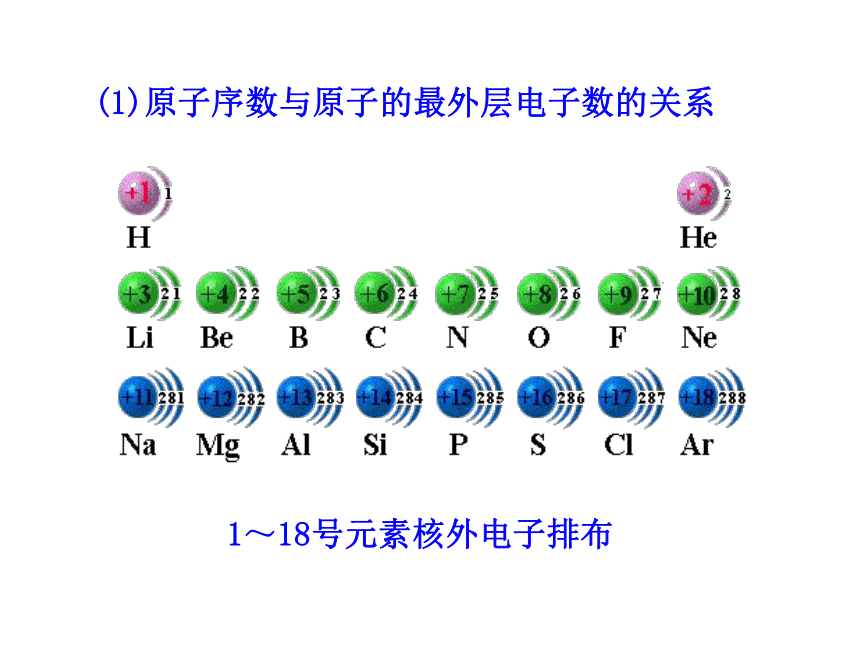
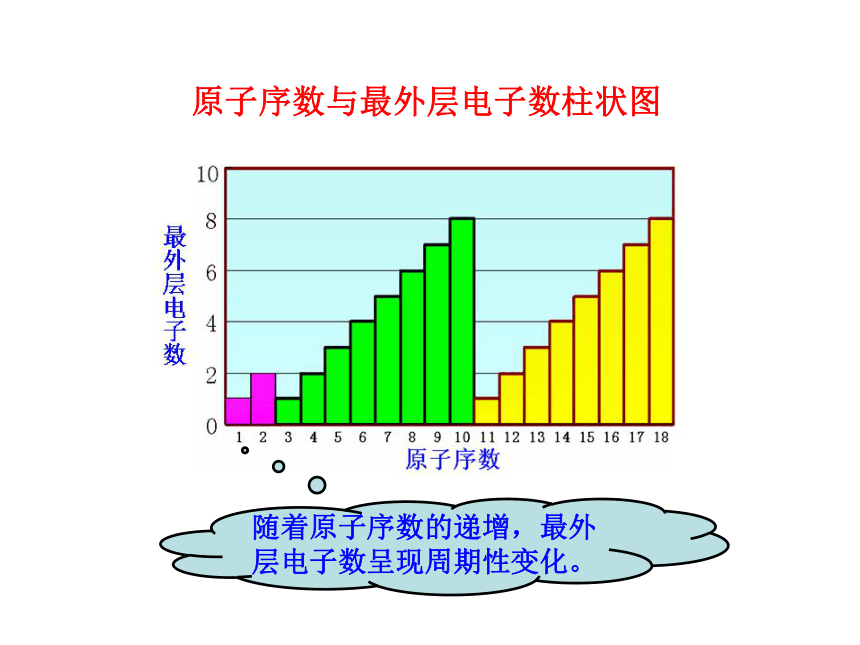
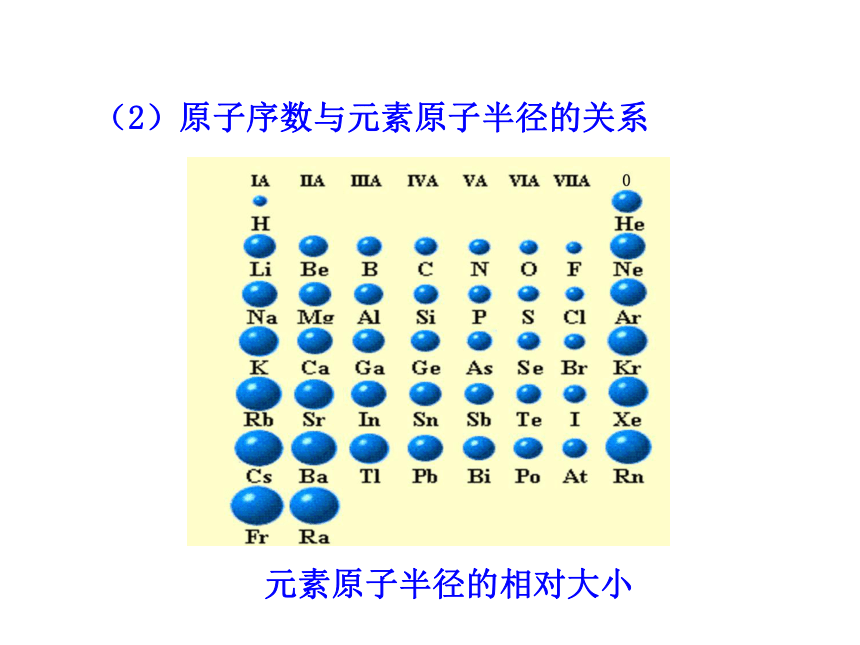
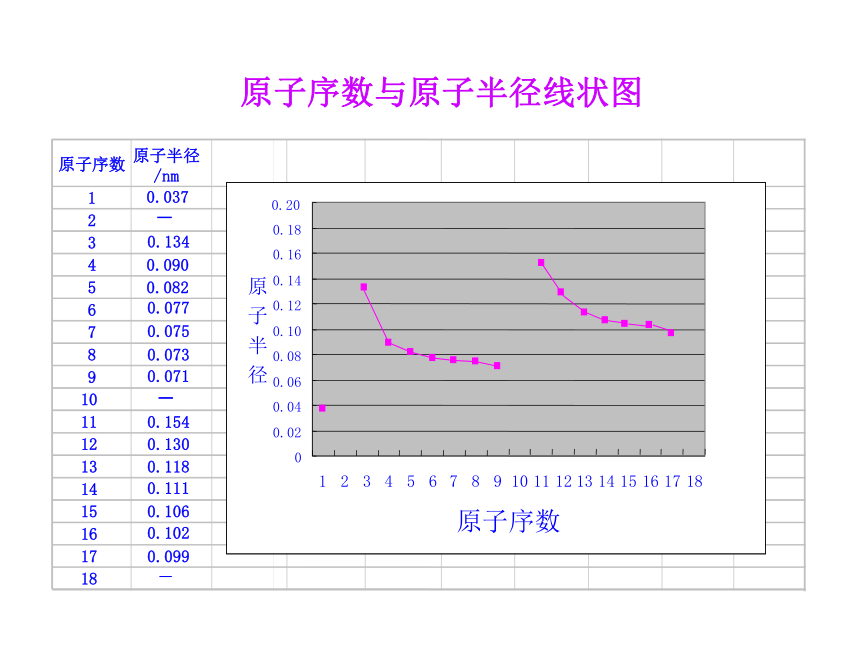
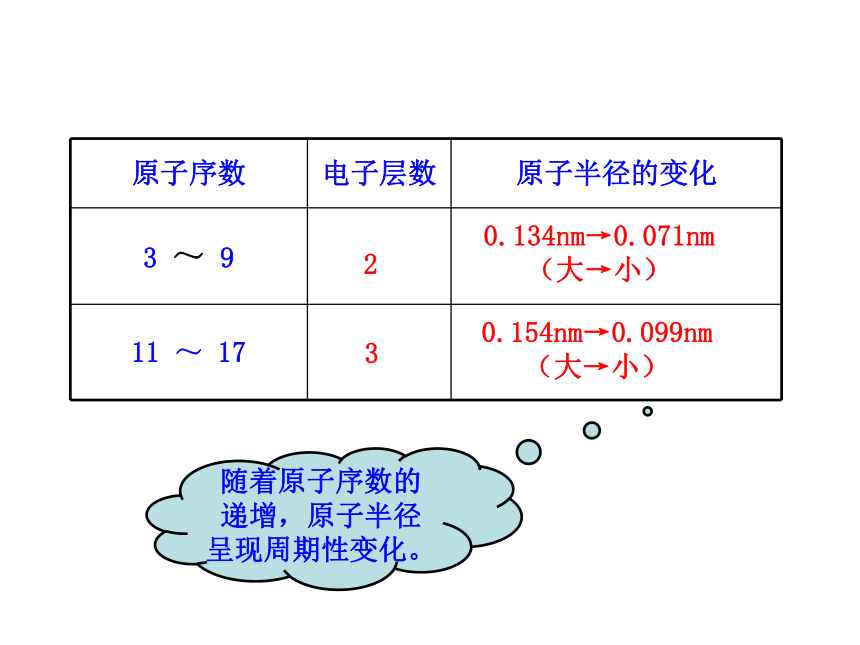
3.了解ⅡA族、ⅤA族和过渡元素的某些性质和用途。一、元素周期律1.原子序数:元素在周期表中的序号。1~18号元素核外电子排布(1)原子序数与原子的最外层电子数的关系原子序数与最外层电子数柱状图随着原子序数的递增,最外层电子数呈现周期性变化。(2)原子序数与元素原子半径的关系元素原子半径的相对大小10.037230.13440.09050.08260.07770.07580.07390.07110110.154120.130130.118140.111150.106160.102170.0991800.020.040.060.080.100.120.140.160.180.20123456789101112131415161718原子序数原子半径原子序数原子半径
/nm原子序数与原子半径线状图__-随着原子序数的递增,原子半径呈现周期性变化。230.134nm→0.071nm
(大→小)0.154nm→0.099nm
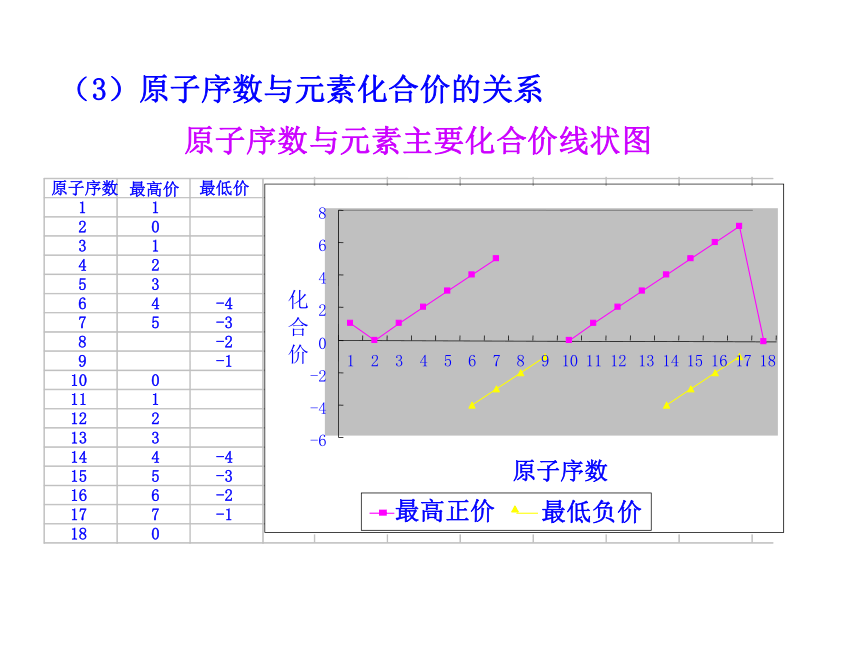
(大→小)原子序数与元素主要化合价线状图(3)原子序数与元素化合价的关系112031425364-475-38-29-1100111122133144-4155-3166-2177-1180原子序数 最高价 最低价随着原子序数的递增,元素的主要化合价呈现周期性变化。321随着原子序数的增加,元素原子的半径、元素的主要化合价为什么呈现周期性变化?出现这种变化的根本原因是什么?【思考与交流】 最外层电子数 1→8(K层电子数 1→2) 原子半径 大→小(稀有气体元素突然增大)化合价:+1→+7 ,-4→-1(稀有气体元素为零)决定了引起了3.元素周期律的实质:2.元素周期律:元素的性质随着元素原子
序数的递增而呈周期性变
化,这个规律叫做元素
周期律。随着元素原子序数的递增,原子核外电子排布呈周期性
变化。元素原子半径、
主要化合价1.电子层数相同的元素的原子半径,随着原子序数的递增一定减小吗?2.元素的最高正价和最低负价之间满足什么关系?【提示】︱最高正价︱+︱最低负价︱ = 8【提示】不一定,要把稀有气体除去,因为稀有气体元素的原子半径与其他元素的原子半径的测定依据不同,因此不具有可比性。【思考与交流】 U
铀
5f36d17s2
238.0二、元素周期表1.周期表方格中各个符号的含义包括镧系(1)周期包括锕系2.元素周期表的结构长周期同周期元素的特点:1.周期序数=电子层数。
2.同一周期元素的原子,电子层数相同,最外层电子
数依次增多。
3.除第1、7周期外,每一周期的元素都是从碱金属元素开始,逐渐过渡到非金属元素,最后以稀有气体元素结束。(2)族第8、9、10三列第18列(稀有气体)7主7副
1零族1Ⅷ族ⅠA、ⅡA、ⅢA---ⅥA、ⅦA包含长周期和短周期元素只包含长周期元素ⅢB---ⅥB、ⅦB 、ⅠB、ⅡB同主族元素的特点:1.主族序数=最外层电子数=最高正价;3.由于同一主族元素最外层电子数相同,因此每一主 族的各元素具有相似的性质。2.同一主族的元素,自上而下,最外层电子数相同,
电子层数依次增多;
氟元素没有正价态
1.“副族元素就是过渡元素”这种说法对吗?【提示】不对,过渡元素包括副族元素和第Ⅷ族元素。2. “第ⅠA、ⅡA族元素都是金属元素”对吗?【提示】不对,第ⅠA族元素中还包含氢元素,该元素属于非金属元素,除此之外都是金属元素。【思考与交流】 3.“第ⅥA族元素的最低负价为-2价,因此最高正价是+6价”对吗?【提示】不对,第ⅥA族的氧元素一般不呈现正价态。4.最外层电子数是2的元素都是第ⅡA族元素吗?【提示】不是,如0族的He,副族和Ⅷ族中的许多元素的原子最外层电子数也是2。【思考与交流】 【提示】不一定,第2、3周期相差1;第4、5周期相差11;第6周期相差25。5.同周期第ⅡA族和第ⅢA族元素的原子序数一定相差1吗?6.某主族元素的原子核外有3个电子层,最外层有3个
电子,则该元素在元素周期表中的哪个位置?【提示】第3周期,第ⅢA族【思考与交流】 3.形式多样的周期表螺旋型周期表不同种元素:电子层结构相同的微粒:1.微粒半径大小的比较电子层数相同:电子层数不相同: (同主族自上而下)
原子同种元素:价低径大,如Na+Cl序小径大序小径大如Cl- > K+层多径大主要与电子层
数、质子数有关
总结归纳:电子层数越多,原子半径越大2.元素在周期表中的位置和元素原子结构的互推方法:(1)电子层数=周期序数;
(2)质子数=原子序数;
(3)最外层电子数=主族序数;
(4)主族元素的最高正价=主族序数,
主族元素的最低负价=主族序数-8。总结归纳:元素周期表结构周期(7)族(16)元素周期律呈现周期性的变化随着原子序数的递增原子的最外层电子数原子半径主要化合价1.下列说法中正确的是 ( )
A.在元素周期表里,主族元素所在的族序数等于原子核外电子数
B.最外层电子数为8的粒子是稀有气体元素原子
C.元素的原子序数越大,其原子半径也越大
D.在元素周期表里,元素所在的周期序数等于原子核外电子层数 D2.如图是元素周期表的一部分,其中X、Y、Z、W的原子序数都小于18,下列说法正确的是( )
A.若X是氢,则Y是氦 B.若Y是氦,则Z是钠
C.若X是氟,则W是硫 D.若Y是氟,则Z是铝CB3.对于具有相同电子层结构的三种微粒:Bn-、An+ 、C,下列说法正确的是( )
A.原子半径:r(A)> r(C)> r(B)
B.微粒半径:Bn->An+
C.C元素不是稀有气体元素??????????????
D.原子序数:C>B>A4.A、B、C为短周期元素,在周期表中的位置关系如下图。
A、C两种元素的原子序数之和等于B原子的质子数, B原子
的质子数与中子数相等。
(1)A、B、C的元素名称 、 、 。
(2)B在周期表中的位置:第 周期,第 族。
(3)C的原子结构示意图 。氮硫氟 3ⅥA 不论去往何方,身后永远有不变的祝福,凝注的眼光——母校用宽大的胸怀包容我们,等待我们,期许我们。
(1)第一张元素周期表是谁绘制的?
(2)元素周期表和元素周期律有什么关系?
(3)元素的哪些性质有周期性的变化?1.了解原子核外电子排布、原子半径、主要化合价的周期性变化,认识元素周期律。(重点)
2.认识元素周期表(长式)的结构,理解原子结构与元素在周期表中的位置间的关系。(重点)
3.了解ⅡA族、ⅤA族和过渡元素的某些性质和用途。一、元素周期律1.原子序数:元素在周期表中的序号。1~18号元素核外电子排布(1)原子序数与原子的最外层电子数的关系原子序数与最外层电子数柱状图随着原子序数的递增,最外层电子数呈现周期性变化。(2)原子序数与元素原子半径的关系元素原子半径的相对大小10.037230.13440.09050.08260.07770.07580.07390.07110110.154120.130130.118140.111150.106160.102170.0991800.020.040.060.080.100.120.140.160.180.20123456789101112131415161718原子序数原子半径原子序数原子半径
/nm原子序数与原子半径线状图__-随着原子序数的递增,原子半径呈现周期性变化。230.134nm→0.071nm
(大→小)0.154nm→0.099nm
(大→小)原子序数与元素主要化合价线状图(3)原子序数与元素化合价的关系112031425364-475-38-29-1100111122133144-4155-3166-2177-1180原子序数 最高价 最低价随着原子序数的递增,元素的主要化合价呈现周期性变化。321随着原子序数的增加,元素原子的半径、元素的主要化合价为什么呈现周期性变化?出现这种变化的根本原因是什么?【思考与交流】 最外层电子数 1→8(K层电子数 1→2) 原子半径 大→小(稀有气体元素突然增大)化合价:+1→+7 ,-4→-1(稀有气体元素为零)决定了引起了3.元素周期律的实质:2.元素周期律:元素的性质随着元素原子
序数的递增而呈周期性变
化,这个规律叫做元素
周期律。随着元素原子序数的递增,原子核外电子排布呈周期性
变化。元素原子半径、
主要化合价1.电子层数相同的元素的原子半径,随着原子序数的递增一定减小吗?2.元素的最高正价和最低负价之间满足什么关系?【提示】︱最高正价︱+︱最低负价︱ = 8【提示】不一定,要把稀有气体除去,因为稀有气体元素的原子半径与其他元素的原子半径的测定依据不同,因此不具有可比性。【思考与交流】 U
铀
5f36d17s2
238.0二、元素周期表1.周期表方格中各个符号的含义包括镧系(1)周期包括锕系2.元素周期表的结构长周期同周期元素的特点:1.周期序数=电子层数。
2.同一周期元素的原子,电子层数相同,最外层电子
数依次增多。
3.除第1、7周期外,每一周期的元素都是从碱金属元素开始,逐渐过渡到非金属元素,最后以稀有气体元素结束。(2)族第8、9、10三列第18列(稀有气体)7主7副
1零族1Ⅷ族ⅠA、ⅡA、ⅢA---ⅥA、ⅦA包含长周期和短周期元素只包含长周期元素ⅢB---ⅥB、ⅦB 、ⅠB、ⅡB同主族元素的特点:1.主族序数=最外层电子数=最高正价;3.由于同一主族元素最外层电子数相同,因此每一主 族的各元素具有相似的性质。2.同一主族的元素,自上而下,最外层电子数相同,
电子层数依次增多;
氟元素没有正价态
1.“副族元素就是过渡元素”这种说法对吗?【提示】不对,过渡元素包括副族元素和第Ⅷ族元素。2. “第ⅠA、ⅡA族元素都是金属元素”对吗?【提示】不对,第ⅠA族元素中还包含氢元素,该元素属于非金属元素,除此之外都是金属元素。【思考与交流】 3.“第ⅥA族元素的最低负价为-2价,因此最高正价是+6价”对吗?【提示】不对,第ⅥA族的氧元素一般不呈现正价态。4.最外层电子数是2的元素都是第ⅡA族元素吗?【提示】不是,如0族的He,副族和Ⅷ族中的许多元素的原子最外层电子数也是2。【思考与交流】 【提示】不一定,第2、3周期相差1;第4、5周期相差11;第6周期相差25。5.同周期第ⅡA族和第ⅢA族元素的原子序数一定相差1吗?6.某主族元素的原子核外有3个电子层,最外层有3个
电子,则该元素在元素周期表中的哪个位置?【提示】第3周期,第ⅢA族【思考与交流】 3.形式多样的周期表螺旋型周期表不同种元素:电子层结构相同的微粒:1.微粒半径大小的比较电子层数相同:电子层数不相同: (同主族自上而下)
原子同种元素:价低径大,如Na+
数、质子数有关
总结归纳:电子层数越多,原子半径越大2.元素在周期表中的位置和元素原子结构的互推方法:(1)电子层数=周期序数;
(2)质子数=原子序数;
(3)最外层电子数=主族序数;
(4)主族元素的最高正价=主族序数,
主族元素的最低负价=主族序数-8。总结归纳:元素周期表结构周期(7)族(16)元素周期律呈现周期性的变化随着原子序数的递增原子的最外层电子数原子半径主要化合价1.下列说法中正确的是 ( )
A.在元素周期表里,主族元素所在的族序数等于原子核外电子数
B.最外层电子数为8的粒子是稀有气体元素原子
C.元素的原子序数越大,其原子半径也越大
D.在元素周期表里,元素所在的周期序数等于原子核外电子层数 D2.如图是元素周期表的一部分,其中X、Y、Z、W的原子序数都小于18,下列说法正确的是( )
A.若X是氢,则Y是氦 B.若Y是氦,则Z是钠
C.若X是氟,则W是硫 D.若Y是氟,则Z是铝CB3.对于具有相同电子层结构的三种微粒:Bn-、An+ 、C,下列说法正确的是( )
A.原子半径:r(A)> r(C)> r(B)
B.微粒半径:Bn->An+
C.C元素不是稀有气体元素??????????????
D.原子序数:C>B>A4.A、B、C为短周期元素,在周期表中的位置关系如下图。
A、C两种元素的原子序数之和等于B原子的质子数, B原子
的质子数与中子数相等。
(1)A、B、C的元素名称 、 、 。
(2)B在周期表中的位置:第 周期,第 族。
(3)C的原子结构示意图 。氮硫氟 3ⅥA 不论去往何方,身后永远有不变的祝福,凝注的眼光——母校用宽大的胸怀包容我们,等待我们,期许我们。
