2.7 元素符号表示的量 (课件 50张PPT)
文档属性
| 名称 | 2.7 元素符号表示的量 (课件 50张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 504.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2019-04-02 00:00:00 | ||
图片预览










文档简介
课件50张PPT。第二章 第 7 节元素符号表示的量1.993×10-26千克一个碳原子的质量是:0.00000000000000000000000001993千克 一个氢原子的质量:1.674×10-27 千克 你能算出一个甲烷分子的质量是多少吗?
一个氧原子的质量:2.657×10-26 千克 一个二氧化碳分子的质量是多少?
问题:谈一谈计算过程中有什么体会?
你有什么方法来简化吗?
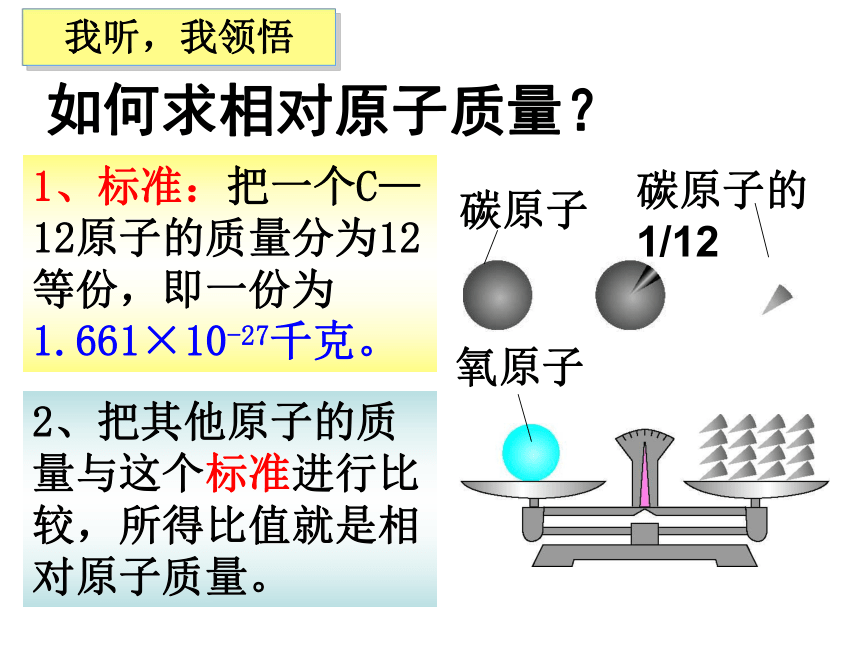
1、看到 “C”能想到什么?看到 “ C”又想到什么?126我学,我知道2、相对原子质量是如何求得的? 3、你能求出氢原子的相对原子质量吗? 国际上规定:采用相对原子质量来表示原子的质量关系。 一、相对原子质量1、定义:国际上规定以含有6个质子和6个中子的碳原子质量的1/12作为标准,其他原子的质量跟它相比较所得的数值,就是该种原子的相对原子质量。
2、相对原子质量只是一个比值,它的国际单位制单位是1( 一般不写出)。如何求相对原子质量?1、标准:把一个C—12原子的质量分为12等份,即一份为1.661×10-27千克。2、把其他原子的质量与这个标准进行比较,所得比值就是相对原子质量。我听,我领悟3、相对原子质量与原子实际质量的换算式为:某原子的相对原子质量=某原子的实际质量1/12作为标准的碳原子的实际质量相对原子质量= 2.325×10-26千克1.661×10-27千克= 141、已知一个碳-12原子的质量为1.993×10-26千克,则一个质量为2.325×10-26千克的相对原子质量是多少? *2、已知碳-12原子的实际质量为m千克,则实际质量为P千克的A原子的相对原子质量是多少?
2、相对原子质量是一个比值。
它的国际单位是一,符号是1(1一般不写出)。 1、相对原子质量不是原子的真实质量,而是相对质量。 3、原子质量大的,相对原子质量也大。提个醒,我注意1、从元素周期表(附录4)中查出下列元素的相对原子质量:
Ca_________ Al_________
Cl_________ Ag__________
2、从相对原子质量表(附录3)查出下列元素的相对原子质量:
H_________ C_________
O________ Cl__________
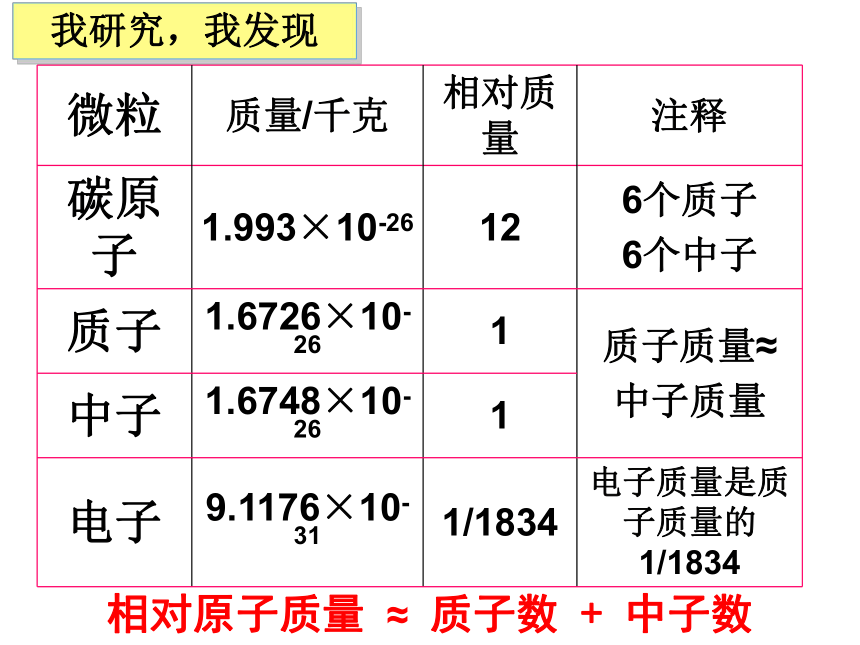
我查,我知道402735.51081121635.5我研究,我发现相对原子质量 ≈ 质子数 + 中子数思考: 1、相对原子质量最小的是什么原子?
H 2、相对原子质量不是原子的实际质量,它能否体现原子的实际质量大小?
能,相对原子质量越大,原子的实际质量越大。 3、相对原子质量与原子的实际质量相比,有什么优点?数值比较简单,便于书写、运算、记忆。
我练,我巩固碘的相对原子质量是127,已知碘原子的核电荷数是53,则它的中子数是 ,质子数是 ,核外电子数是 。
我再学,知更多1、什么是相对分子质量?2、求相对分子质量应注意什么步骤?3、你知道什么物质的相对分子质量最小?4、相对分子质量有没有单位? 二、相对分子质量(或式量)原子质量可以用相对质量表示,分子质量也可以用相对分子质量表示。相对分子质量总和:相对分子质量与分子 个数的乘积。
相对分子质量:一个分子中各原子的 相对原子质量总和。
计算二氧化碳、硫酸的相对分子质量步骤:
1、写出正确的化学式
2、查出各元素的相对原子质量
3、相对分子质量=各原子的相对原子质量总和
试一试:计算二氧化碳、硫酸的相对分子质量:试一试:CO2(二氧化碳分子)的相对分子质量:
12 + 16×2 = 44
H2SO4(硫酸分子)的相对分子质量:
1×2 + 32 + 16×4 = 98
求下列物质的相对分子质量:(1)三氧化硫(SO3)的相对分子质量
(2)氧化钙(CaO)的相对分子质量
=40×1+16×1=56=32×1+16×3=80
(3)磷酸(H3PO4)的相对分子质量=1×3+31×1+16×4=98(4)五氧化二磷(P2O5)的相对分子质量=31×2+16×5=142(5)尿素CO(NH2)2的相对分子质量=12×1+16×1+(14×1+1×2)×2
=60(6)硫酸铜晶体(CuSO4.5H2O)的相对分子质量=64×1+32×1+16×4+5(1×2+16)
=250已知:C—12 O—16 H—1 N—14 Ca—40 S—32 Mg—24
求出下列相对分子质量:
CH4_____ H2O_____ Ca(OH)2_____
(NH4)2SO4______3H2O_____ 4CO2_____ 5Mg(OH)2_____
16187413254176290强化练,谁快谁正确思考:什么物质的相对分子质量最小?H2练一练“9.11事件”发生不久,在美国又出现了炭疽病。此病是一种有炭疽热杆菌引发的急性传染病,致死率高达25%至60%。其化学式为C17H18N3O3;它由____种元素组成,每各分子中含有___个原子,其相对分子质量是______。441312我看图,我说话CO2CO2二氧化碳这种物质一个二氧化碳分子二氧化碳由碳元素和氧元素组成(1个)二氧化碳分子由(2个)氧原子和(1个)碳原子构成(1)(5)(2)(4)二氧化碳的相对分子质量为44(6)二氧化碳由二氧
化碳分子构成(3)(1)表示一种物质名称(二氧化碳气体)
(2)表示这种物质的元素组成(二氧化碳由碳元素和氧元素组成)
(3)表示这种物质的微粒(分子、原子、离子)构成(二氧化碳由二氧化碳分子构成)
(4)表示该物质的一个分子的构成(一个二氧化碳分子由1个碳原子和2个氧原子构成或二氧化碳分子由碳原子和氧原子构成)
(5)表示该物质的一个分子(一个二氧化碳分子)
(6)表示该物质的相对分子质量(二氧化碳的相对分子质量是44)
以CO2为例请你说一说H2O表示的含义?三、化学式的意义第7节 元素符号表示的量 (第2课时)课前复习想一想:1.相对原子质量是以什么为标准的?以一个C-12原子的质量的1/12作为标准2.相对分子质量是指什么?相对分子质量是指一个分子中各原子的
相对原子质量的总和3.化学式的意义?四、元素质量分数和质量比的确定 例题1:求水中氢元素和氧元素的质量比解:水的化学式:H2O1、根据化学式计算组成物质的各元素的质量比(最简整数比)H:O=(1 × 2):(16 × 1)=1:8练一练:(1)求SO2中硫元素和氧元素的质量比解:(32 ×1):(16 × 2)(2)求化肥碳酸氢氨(NH4HCO3)
的相对分子质量及各元素的质量比
解:NH4HCO3的相对分子质量=14 × 1+1 × 5+12 × 1+16 × 3
=79N:H:C:O=(14 × 1):(1 × 5):(12 × 1):(16 × 3)=14:5:12:48(3)计算二氧化碳中各元素的质量比。
(4)计算硫酸(H2SO4)中各元素的质量比。
(5)计算碳酸氢铵(NH4HCO3)中各元素的质量比。C:O=1×12 :16×2=12 :32=3 :8H:S:O=2 :32 :64=1 :16 :32N:H:C:O=14 :5 :12 :482、根据化学式,计算物质中某一元素的质量分数。 例题2:计算水中氢元素的质量分数解:水中氢元素质量分数
=氢元素的相对原子质量(总和)水的相对分子质量×100%H%例题3:求化肥碳酸氢氨(NH4HCO3)
中氮元素的质量分数?解:NH4HCO3的相对分子质量=79 N%=NNH4HCO3=1479=17.72%结论:元素的质量分数=分子中该元素的原子个数× 相对原子质量相对分子质量×100%(1)计算硝酸铵(NH4NO3)中氮元素的质量分数(NH4NO3)中氮元素的质量分数=
2NNH4NO3=2 × 1414 × 2+1 × 4+16 × 3=2880=35%练一练:(2)求二氧化碳中碳元素、氧元素的质量分数?练一练:C%=1244O%==27.27%CCO2==72.73%2OCO2=2×1644O%=或1-27.27%
=72.73%3、根据化学式可以计算出一定质量的某物质中某元素的质量。例题4:计算36克水中氢元素和氧元素的质量?解:氢元素的质量=36克× 2HH2O=36克×218=4克氧元素的质量=36克×H2OO=36克×1618=32克某元素的质量=物质的质量 ×该元素的质量分数所以氮肥是含氮元素的物质,如碳酸氢铵
(NH4HCO3),尿素 [CO(NH2)2]
硫酸铵[( NH4 )2SO4],硝酸铵( NH4NO3 ),
求尿素 CO(NH2)2,硫酸铵(NH4)2SO4中的氮元素的质量分数。CO(NH2)2中氮元素的质量分数=
2NCO(NH2)2=2 × 1412+16+(14+1×2)× 2=2860=47%(NH4)2SO4中氮元素的质量分数=
2N(NH4)2SO4=2 × 14(14+1×4)×2+32+16 × 4=28132=21%某市场中硫酸铵和尿素两种化肥,每千克的售价分别为3.6元和5元,根据它们含氮的比例买哪种化肥更经济?讨论解:每千克硫酸铵中含氮元素的质量=1千克2N(NH4 )2SO4×=1千克×28132=0.212千克每千克尿素中含氮元素的质量=1千克×2NCO(NH2)2=1千克×2860=0.467千克例:为满足生产需要,要使每公顷土地增加
2kg氮元素,问在50公顷的土地上应施加硝酸
铵(NH4NO3)肥料多少千克?解:设需施加NH4NO3的质量为Xx= 50×2kgx=285.7kg答:需施加NH4NO3285.7kg。 1、化合物A3BC4中,A元素的质量分数为 。若A为氢元素,C为氧元素,则B元素的化合价为 ;若H3BO4的式量为98,则B的相对原子质量为 。若B元素的原子中有16个中子,则该物质的化学式为 。 3AA3BC4+531H3PO42、 X元素与Y元素组成的化合物中,X元素与Y元素的质量比1:16,已知X与Y的相对原子质量比为1:32,则X与Y的原子个数比为( )
A.2:1 B.1:2
C.1:4 D.4:1
A3、元素A的氧化物化学式为AO2,其中A元素的质量分数是50%,则A元素的相对原子质量为( )
A. 16克 B. 16
C. 32克 D. 32 D4、金属元素R为+2价元素,其氧化物中,R与氧元素的质量比为3∶2,则R元素的相对原子质量为( )
A.6 B.6克
C.24 D.24克 C5、在一种碳和氢组成的化合物A中,碳和氢的原子个数比为1∶2,式量为28,则A的化学式为( )
A.CH2 B.C2H4
C.C3H6 D.C4H8B6、X、Y两元素的原子量分别为M和N,化合价分别为+a和-b,则由此两元素组成的化合物中X元素和Y元素的质量比为( )
A.aM∶bN B.aN∶Bm
C.bM∶aN D.M∶NC7、氮元素能组成下列氧化物:①N2O5 ②NO ③N2O3 ④NO2,其中氮元素的质量分数最大的是( )
A.① B.②
C.③ D.④ B8、有一含SiO2杂质的石灰石样品,如测得其中钙元素的质量分数为35%,则此样品中含 CaCO3的质量分数为( )
A.35% B.65%
C.87.5% D.12.5% C9、某元素R,其含氧酸化学式为H2RO3,式量为62。该元素R在氢化物中氢元素的质量分数为25%,则该氢化物的化学式为 ( ) A.H2R B.HR
C.RH3 D.RH4
D10、某金属氧化物的相对分子质量为M,若该金属与氯元素结合,氯化物的相对分子质量为N,已知金属在两种化合物中的化合价相同,则金属元素的化合价可能是( ) A11、有一硫化钠、亚硫酸钠和硫酸钠的混合物,经测定硫元素的质量分数为32%,则此混合物中氧元素的质量分数为 。22%12、常温下,乙烷(C2H6)气体和酒精(C2H5OH)蒸气的混合物中,氧元素的质量分数为a%,则该混合物中碳元素的质量分数为 。451、某种氮的氧化物,其中氮元素与氧元素的质量比为7︰20,则该氮的氧化物中氮原子与氧原子个数之比是多少?
4、120克尿素[ CO(NH2)2 ]与多少克碳酸氢铵所含的氮元素质量相当?
2、某元素R的+4价氧化物的相对分子质量为M。则R的相对原子质量是多少?
3、已知X、Y两元素的相对原子质量之比为7︰2,在它们所形成的一种化合物中,X、Y两元素的质量比为21︰8,求这种化合物的化学式?
一个氧原子的质量:2.657×10-26 千克 一个二氧化碳分子的质量是多少?
问题:谈一谈计算过程中有什么体会?
你有什么方法来简化吗?
1、看到 “C”能想到什么?看到 “ C”又想到什么?126我学,我知道2、相对原子质量是如何求得的? 3、你能求出氢原子的相对原子质量吗? 国际上规定:采用相对原子质量来表示原子的质量关系。 一、相对原子质量1、定义:国际上规定以含有6个质子和6个中子的碳原子质量的1/12作为标准,其他原子的质量跟它相比较所得的数值,就是该种原子的相对原子质量。
2、相对原子质量只是一个比值,它的国际单位制单位是1( 一般不写出)。如何求相对原子质量?1、标准:把一个C—12原子的质量分为12等份,即一份为1.661×10-27千克。2、把其他原子的质量与这个标准进行比较,所得比值就是相对原子质量。我听,我领悟3、相对原子质量与原子实际质量的换算式为:某原子的相对原子质量=某原子的实际质量1/12作为标准的碳原子的实际质量相对原子质量= 2.325×10-26千克1.661×10-27千克= 141、已知一个碳-12原子的质量为1.993×10-26千克,则一个质量为2.325×10-26千克的相对原子质量是多少? *2、已知碳-12原子的实际质量为m千克,则实际质量为P千克的A原子的相对原子质量是多少?
2、相对原子质量是一个比值。
它的国际单位是一,符号是1(1一般不写出)。 1、相对原子质量不是原子的真实质量,而是相对质量。 3、原子质量大的,相对原子质量也大。提个醒,我注意1、从元素周期表(附录4)中查出下列元素的相对原子质量:
Ca_________ Al_________
Cl_________ Ag__________
2、从相对原子质量表(附录3)查出下列元素的相对原子质量:
H_________ C_________
O________ Cl__________
我查,我知道402735.51081121635.5我研究,我发现相对原子质量 ≈ 质子数 + 中子数思考: 1、相对原子质量最小的是什么原子?
H 2、相对原子质量不是原子的实际质量,它能否体现原子的实际质量大小?
能,相对原子质量越大,原子的实际质量越大。 3、相对原子质量与原子的实际质量相比,有什么优点?数值比较简单,便于书写、运算、记忆。
我练,我巩固碘的相对原子质量是127,已知碘原子的核电荷数是53,则它的中子数是 ,质子数是 ,核外电子数是 。
我再学,知更多1、什么是相对分子质量?2、求相对分子质量应注意什么步骤?3、你知道什么物质的相对分子质量最小?4、相对分子质量有没有单位? 二、相对分子质量(或式量)原子质量可以用相对质量表示,分子质量也可以用相对分子质量表示。相对分子质量总和:相对分子质量与分子 个数的乘积。
相对分子质量:一个分子中各原子的 相对原子质量总和。
计算二氧化碳、硫酸的相对分子质量步骤:
1、写出正确的化学式
2、查出各元素的相对原子质量
3、相对分子质量=各原子的相对原子质量总和
试一试:计算二氧化碳、硫酸的相对分子质量:试一试:CO2(二氧化碳分子)的相对分子质量:
12 + 16×2 = 44
H2SO4(硫酸分子)的相对分子质量:
1×2 + 32 + 16×4 = 98
求下列物质的相对分子质量:(1)三氧化硫(SO3)的相对分子质量
(2)氧化钙(CaO)的相对分子质量
=40×1+16×1=56=32×1+16×3=80
(3)磷酸(H3PO4)的相对分子质量=1×3+31×1+16×4=98(4)五氧化二磷(P2O5)的相对分子质量=31×2+16×5=142(5)尿素CO(NH2)2的相对分子质量=12×1+16×1+(14×1+1×2)×2
=60(6)硫酸铜晶体(CuSO4.5H2O)的相对分子质量=64×1+32×1+16×4+5(1×2+16)
=250已知:C—12 O—16 H—1 N—14 Ca—40 S—32 Mg—24
求出下列相对分子质量:
CH4_____ H2O_____ Ca(OH)2_____
(NH4)2SO4______3H2O_____ 4CO2_____ 5Mg(OH)2_____
16187413254176290强化练,谁快谁正确思考:什么物质的相对分子质量最小?H2练一练“9.11事件”发生不久,在美国又出现了炭疽病。此病是一种有炭疽热杆菌引发的急性传染病,致死率高达25%至60%。其化学式为C17H18N3O3;它由____种元素组成,每各分子中含有___个原子,其相对分子质量是______。441312我看图,我说话CO2CO2二氧化碳这种物质一个二氧化碳分子二氧化碳由碳元素和氧元素组成(1个)二氧化碳分子由(2个)氧原子和(1个)碳原子构成(1)(5)(2)(4)二氧化碳的相对分子质量为44(6)二氧化碳由二氧
化碳分子构成(3)(1)表示一种物质名称(二氧化碳气体)
(2)表示这种物质的元素组成(二氧化碳由碳元素和氧元素组成)
(3)表示这种物质的微粒(分子、原子、离子)构成(二氧化碳由二氧化碳分子构成)
(4)表示该物质的一个分子的构成(一个二氧化碳分子由1个碳原子和2个氧原子构成或二氧化碳分子由碳原子和氧原子构成)
(5)表示该物质的一个分子(一个二氧化碳分子)
(6)表示该物质的相对分子质量(二氧化碳的相对分子质量是44)
以CO2为例请你说一说H2O表示的含义?三、化学式的意义第7节 元素符号表示的量 (第2课时)课前复习想一想:1.相对原子质量是以什么为标准的?以一个C-12原子的质量的1/12作为标准2.相对分子质量是指什么?相对分子质量是指一个分子中各原子的
相对原子质量的总和3.化学式的意义?四、元素质量分数和质量比的确定 例题1:求水中氢元素和氧元素的质量比解:水的化学式:H2O1、根据化学式计算组成物质的各元素的质量比(最简整数比)H:O=(1 × 2):(16 × 1)=1:8练一练:(1)求SO2中硫元素和氧元素的质量比解:(32 ×1):(16 × 2)(2)求化肥碳酸氢氨(NH4HCO3)
的相对分子质量及各元素的质量比
解:NH4HCO3的相对分子质量=14 × 1+1 × 5+12 × 1+16 × 3
=79N:H:C:O=(14 × 1):(1 × 5):(12 × 1):(16 × 3)=14:5:12:48(3)计算二氧化碳中各元素的质量比。
(4)计算硫酸(H2SO4)中各元素的质量比。
(5)计算碳酸氢铵(NH4HCO3)中各元素的质量比。C:O=1×12 :16×2=12 :32=3 :8H:S:O=2 :32 :64=1 :16 :32N:H:C:O=14 :5 :12 :482、根据化学式,计算物质中某一元素的质量分数。 例题2:计算水中氢元素的质量分数解:水中氢元素质量分数
=氢元素的相对原子质量(总和)水的相对分子质量×100%H%例题3:求化肥碳酸氢氨(NH4HCO3)
中氮元素的质量分数?解:NH4HCO3的相对分子质量=79 N%=NNH4HCO3=1479=17.72%结论:元素的质量分数=分子中该元素的原子个数× 相对原子质量相对分子质量×100%(1)计算硝酸铵(NH4NO3)中氮元素的质量分数(NH4NO3)中氮元素的质量分数=
2NNH4NO3=2 × 1414 × 2+1 × 4+16 × 3=2880=35%练一练:(2)求二氧化碳中碳元素、氧元素的质量分数?练一练:C%=1244O%==27.27%CCO2==72.73%2OCO2=2×1644O%=或1-27.27%
=72.73%3、根据化学式可以计算出一定质量的某物质中某元素的质量。例题4:计算36克水中氢元素和氧元素的质量?解:氢元素的质量=36克× 2HH2O=36克×218=4克氧元素的质量=36克×H2OO=36克×1618=32克某元素的质量=物质的质量 ×该元素的质量分数所以氮肥是含氮元素的物质,如碳酸氢铵
(NH4HCO3),尿素 [CO(NH2)2]
硫酸铵[( NH4 )2SO4],硝酸铵( NH4NO3 ),
求尿素 CO(NH2)2,硫酸铵(NH4)2SO4中的氮元素的质量分数。CO(NH2)2中氮元素的质量分数=
2NCO(NH2)2=2 × 1412+16+(14+1×2)× 2=2860=47%(NH4)2SO4中氮元素的质量分数=
2N(NH4)2SO4=2 × 14(14+1×4)×2+32+16 × 4=28132=21%某市场中硫酸铵和尿素两种化肥,每千克的售价分别为3.6元和5元,根据它们含氮的比例买哪种化肥更经济?讨论解:每千克硫酸铵中含氮元素的质量=1千克2N(NH4 )2SO4×=1千克×28132=0.212千克每千克尿素中含氮元素的质量=1千克×2NCO(NH2)2=1千克×2860=0.467千克例:为满足生产需要,要使每公顷土地增加
2kg氮元素,问在50公顷的土地上应施加硝酸
铵(NH4NO3)肥料多少千克?解:设需施加NH4NO3的质量为Xx= 50×2kgx=285.7kg答:需施加NH4NO3285.7kg。 1、化合物A3BC4中,A元素的质量分数为 。若A为氢元素,C为氧元素,则B元素的化合价为 ;若H3BO4的式量为98,则B的相对原子质量为 。若B元素的原子中有16个中子,则该物质的化学式为 。 3AA3BC4+531H3PO42、 X元素与Y元素组成的化合物中,X元素与Y元素的质量比1:16,已知X与Y的相对原子质量比为1:32,则X与Y的原子个数比为( )
A.2:1 B.1:2
C.1:4 D.4:1
A3、元素A的氧化物化学式为AO2,其中A元素的质量分数是50%,则A元素的相对原子质量为( )
A. 16克 B. 16
C. 32克 D. 32 D4、金属元素R为+2价元素,其氧化物中,R与氧元素的质量比为3∶2,则R元素的相对原子质量为( )
A.6 B.6克
C.24 D.24克 C5、在一种碳和氢组成的化合物A中,碳和氢的原子个数比为1∶2,式量为28,则A的化学式为( )
A.CH2 B.C2H4
C.C3H6 D.C4H8B6、X、Y两元素的原子量分别为M和N,化合价分别为+a和-b,则由此两元素组成的化合物中X元素和Y元素的质量比为( )
A.aM∶bN B.aN∶Bm
C.bM∶aN D.M∶NC7、氮元素能组成下列氧化物:①N2O5 ②NO ③N2O3 ④NO2,其中氮元素的质量分数最大的是( )
A.① B.②
C.③ D.④ B8、有一含SiO2杂质的石灰石样品,如测得其中钙元素的质量分数为35%,则此样品中含 CaCO3的质量分数为( )
A.35% B.65%
C.87.5% D.12.5% C9、某元素R,其含氧酸化学式为H2RO3,式量为62。该元素R在氢化物中氢元素的质量分数为25%,则该氢化物的化学式为 ( ) A.H2R B.HR
C.RH3 D.RH4
D10、某金属氧化物的相对分子质量为M,若该金属与氯元素结合,氯化物的相对分子质量为N,已知金属在两种化合物中的化合价相同,则金属元素的化合价可能是( ) A11、有一硫化钠、亚硫酸钠和硫酸钠的混合物,经测定硫元素的质量分数为32%,则此混合物中氧元素的质量分数为 。22%12、常温下,乙烷(C2H6)气体和酒精(C2H5OH)蒸气的混合物中,氧元素的质量分数为a%,则该混合物中碳元素的质量分数为 。451、某种氮的氧化物,其中氮元素与氧元素的质量比为7︰20,则该氮的氧化物中氮原子与氧原子个数之比是多少?
4、120克尿素[ CO(NH2)2 ]与多少克碳酸氢铵所含的氮元素质量相当?
2、某元素R的+4价氧化物的相对分子质量为M。则R的相对原子质量是多少?
3、已知X、Y两元素的相对原子质量之比为7︰2,在它们所形成的一种化合物中,X、Y两元素的质量比为21︰8,求这种化合物的化学式?
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
