第3节 化学方程式(第1课时)(课件 18张ppt)
文档属性
| 名称 | 第3节 化学方程式(第1课时)(课件 18张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2019-04-14 23:27:25 | ||
图片预览




文档简介
取一支蜡烛粘在一小块玻璃片上,将玻璃片和蜡烛一起放在托盘天平上称量。点燃蜡烛,天平会发生什么变化?分析产生这种现象的原因。
天平会向右盘倾斜。因为蜡烛燃烧生成的水蒸气和二氧化碳都释放到空气中了,质量变小。
实验一
实验二与实验一有什么不同?实验二有什么优势?
不同:实验二构成了一个独立的密闭系统,生成的气体不会逸出到空气当中,没有与外界进行物质交换。
优势:密封后,不会由于气体生成逸散而影响总质量的测定。
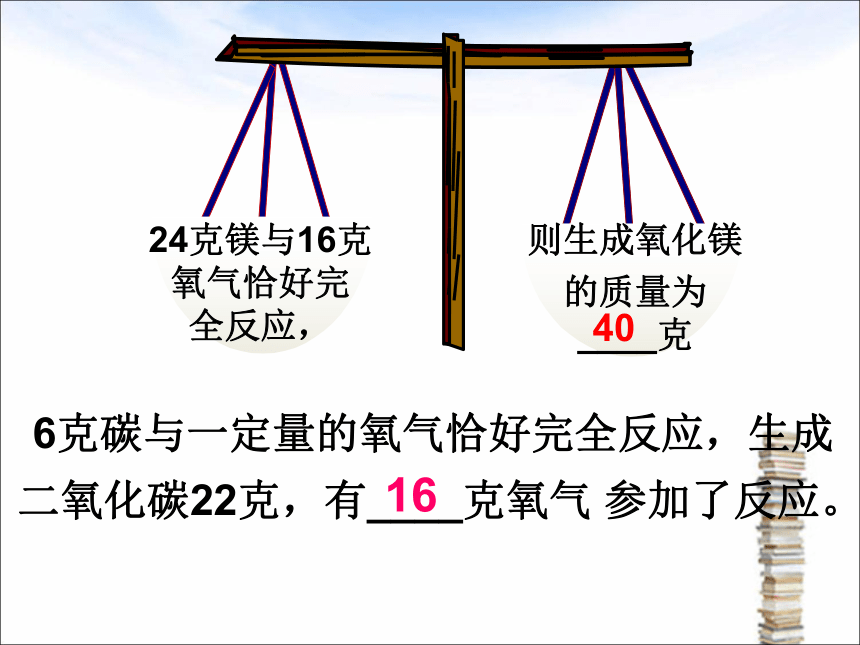
在化学反应中,参与化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
40
6克碳与一定量的氧气恰好完全反应,生成二氧化碳22克,有____克氧气 参加了反应。
16
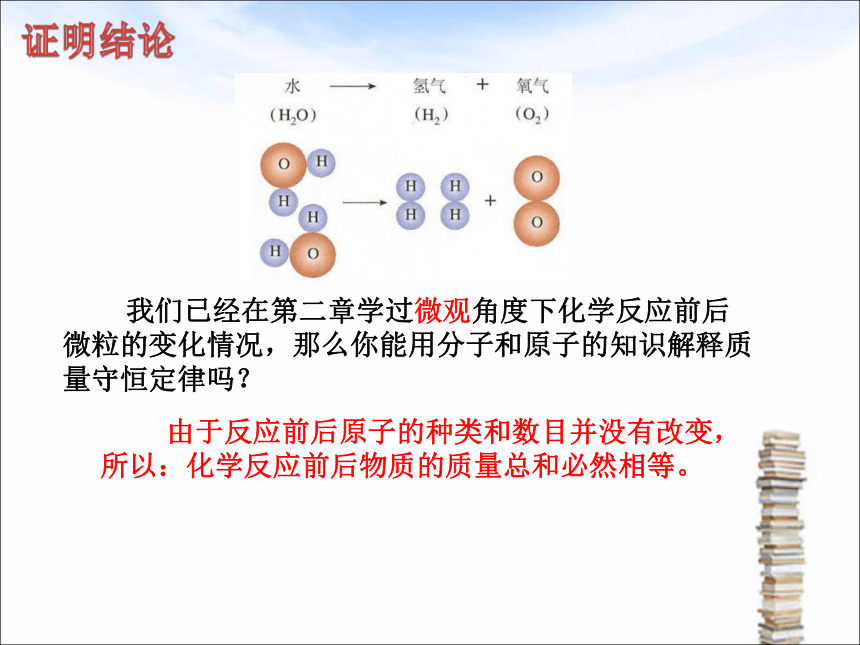
我们已经在第二章学过微观角度下化学反应前后微粒的变化情况,那么你能用分子和原子的知识解释质量守恒定律吗?
由于反应前后原子的种类和数目并没有改变,所以:化学反应前后物质的质量总和必然相等。
?
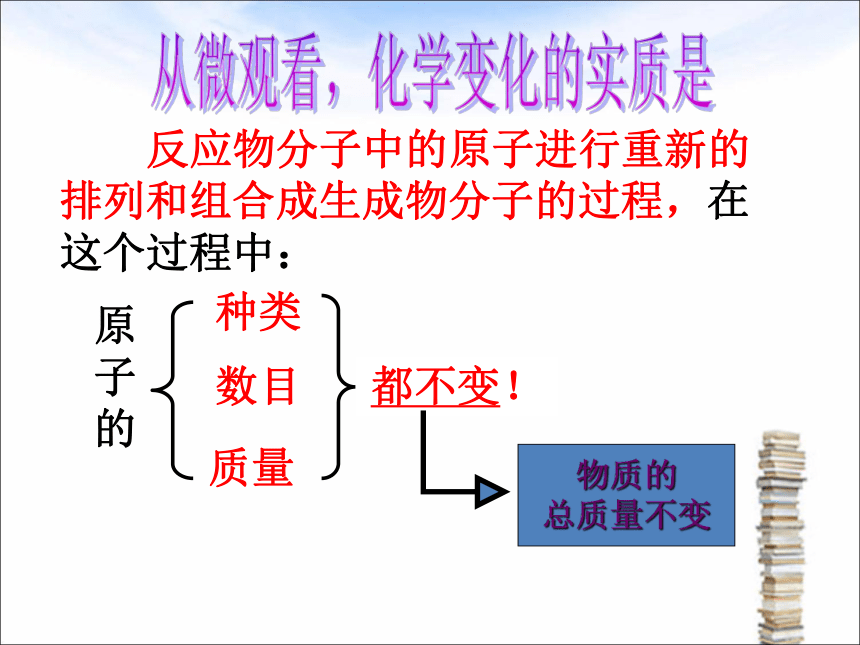
反应物分子中的原子进行重新的排列和组合成生成物分子的过程,在这个过程中:
都不变!
讨论:在化学反应前后,下列选项中:
一定会改变的有_________________;一定不会变的有_________________;可能会改变的有_________________。
A.物质种类 B.物质总质量 C.分子种类 D.分子数目 E.原子种类 F.原子数目
G.元素种类
A.
B.
C.
D.
E.
F.
G.
24.5克氯酸钾与5克二氧化锰混合后共热,完全反应后,冷却,称得生成氯化钾为14.9克,求生成的氧气多少克 ? ( )
氯酸钾 氯化钾+氧气
二氧化锰
加热
表达式:
KClO3 KCl + O2
MnO2
△
24.5g 14.9g + ?g
9.6g
1、以上实验数据遵循质量守恒定律吗?
2、但以上实验的表达式遵循质量守恒定律的微观解释吗?
3、为了分析清楚化学变化中各物质间的关系,我们应怎样用化学式反映出化学反应中的质量守恒定律?
用化学式来表示化学反应的方程式叫做化学方程式。
定义:
氯酸钾 氯化钾+氧气
二氧化锰
加热
2KClO3 2KCl + 3O2↑
MnO2
△
KClO3 KCl + O2
MnO2
△
表达式:
化学方程式:
1.列式:
2.配平:
3.等号:
写出反应物和生成物的化学式并用短线相连
配平(体现质量守恒定律)
配平后先检查前后是否遵循质量守恒定律,再将短线改为等号
KClO3 KCl + O2
2KClO3 2KCl + 3O2
2KClO3 2KCl + 3O2
配平下列化学方程式
C + O2 —— CO
H2 + O2 —— H2O
Na + Cl2 —— NaCl
Fe + O2 —— Fe3O4
KMnO4 —— K2MnO4 + MnO2 + O2
高温
点燃
点燃
点燃
△
2
2
2
2
2
2
3
2
2
4.条件:
注明反应条件,如点燃,加热(加热可用△表示)等
5.状态:
注明生成物状态(若反应物中没有气体,生成物中有气体,在化学式右边用“↑”表示,固体同理用“↓”表示。若反应物中有气体和固体,则不用标。)
2KClO3 2KCl + 3O2
MnO2
△
2KClO3 2KCl + 3O2↑
MnO2
△
H2O H2 +O2
通电
S+O2 SO2
点燃
2
2
1、硫在氧气中燃烧
2、细铁丝在纯氧中燃烧
3、水在通电条件下,生成氢气和氧气
Fe+ O2 Fe3O4
点燃
2
3
H2O2 H2O +O2
KClO3 KCl+ O2
△
2
2
2
4、实验室用过氧化氢制取氧气(MnO2为催化剂)
5、加热分解氯酸钾(MnO2为催化剂)
6、加热分解高锰酸钾
2
3
MnO2
MnO2
KMnO4 K2MnO4+MnO2+O2
△
2
指出下列化学方程式的错误
1. P2+O5==P2O5
2. Fe+O2 === Fe3O4
3. C+O2↑===CO2
4. S+O2===SO2↑
5. 2KMnO4↓=====K2MnO4+MnO2↓+O2↑
点燃
点燃
点燃
点燃
△
4P+5O2==2P2O5
点燃
3Fe+2O2 === Fe3O4
点燃
C+O2 ===CO2
点燃
S + O2 ===SO2
点燃
2KMnO4 =====K2MnO4+MnO2+O2↑
△
一.质量守恒定律:
反应物总质量=生成物总质量
二.化学方程式的书写
1.列式
2.配平
3.等号
4.条件
5.状态
天平会向右盘倾斜。因为蜡烛燃烧生成的水蒸气和二氧化碳都释放到空气中了,质量变小。
实验一
实验二与实验一有什么不同?实验二有什么优势?
不同:实验二构成了一个独立的密闭系统,生成的气体不会逸出到空气当中,没有与外界进行物质交换。
优势:密封后,不会由于气体生成逸散而影响总质量的测定。
在化学反应中,参与化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
40
6克碳与一定量的氧气恰好完全反应,生成二氧化碳22克,有____克氧气 参加了反应。
16
我们已经在第二章学过微观角度下化学反应前后微粒的变化情况,那么你能用分子和原子的知识解释质量守恒定律吗?
由于反应前后原子的种类和数目并没有改变,所以:化学反应前后物质的质量总和必然相等。
?
反应物分子中的原子进行重新的排列和组合成生成物分子的过程,在这个过程中:
都不变!
讨论:在化学反应前后,下列选项中:
一定会改变的有_________________;一定不会变的有_________________;可能会改变的有_________________。
A.物质种类 B.物质总质量 C.分子种类 D.分子数目 E.原子种类 F.原子数目
G.元素种类
A.
B.
C.
D.
E.
F.
G.
24.5克氯酸钾与5克二氧化锰混合后共热,完全反应后,冷却,称得生成氯化钾为14.9克,求生成的氧气多少克 ? ( )
氯酸钾 氯化钾+氧气
二氧化锰
加热
表达式:
KClO3 KCl + O2
MnO2
△
24.5g 14.9g + ?g
9.6g
1、以上实验数据遵循质量守恒定律吗?
2、但以上实验的表达式遵循质量守恒定律的微观解释吗?
3、为了分析清楚化学变化中各物质间的关系,我们应怎样用化学式反映出化学反应中的质量守恒定律?
用化学式来表示化学反应的方程式叫做化学方程式。
定义:
氯酸钾 氯化钾+氧气
二氧化锰
加热
2KClO3 2KCl + 3O2↑
MnO2
△
KClO3 KCl + O2
MnO2
△
表达式:
化学方程式:
1.列式:
2.配平:
3.等号:
写出反应物和生成物的化学式并用短线相连
配平(体现质量守恒定律)
配平后先检查前后是否遵循质量守恒定律,再将短线改为等号
KClO3 KCl + O2
2KClO3 2KCl + 3O2
2KClO3 2KCl + 3O2
配平下列化学方程式
C + O2 —— CO
H2 + O2 —— H2O
Na + Cl2 —— NaCl
Fe + O2 —— Fe3O4
KMnO4 —— K2MnO4 + MnO2 + O2
高温
点燃
点燃
点燃
△
2
2
2
2
2
2
3
2
2
4.条件:
注明反应条件,如点燃,加热(加热可用△表示)等
5.状态:
注明生成物状态(若反应物中没有气体,生成物中有气体,在化学式右边用“↑”表示,固体同理用“↓”表示。若反应物中有气体和固体,则不用标。)
2KClO3 2KCl + 3O2
MnO2
△
2KClO3 2KCl + 3O2↑
MnO2
△
H2O H2 +O2
通电
S+O2 SO2
点燃
2
2
1、硫在氧气中燃烧
2、细铁丝在纯氧中燃烧
3、水在通电条件下,生成氢气和氧气
Fe+ O2 Fe3O4
点燃
2
3
H2O2 H2O +O2
KClO3 KCl+ O2
△
2
2
2
4、实验室用过氧化氢制取氧气(MnO2为催化剂)
5、加热分解氯酸钾(MnO2为催化剂)
6、加热分解高锰酸钾
2
3
MnO2
MnO2
KMnO4 K2MnO4+MnO2+O2
△
2
指出下列化学方程式的错误
1. P2+O5==P2O5
2. Fe+O2 === Fe3O4
3. C+O2↑===CO2
4. S+O2===SO2↑
5. 2KMnO4↓=====K2MnO4+MnO2↓+O2↑
点燃
点燃
点燃
点燃
△
4P+5O2==2P2O5
点燃
3Fe+2O2 === Fe3O4
点燃
C+O2 ===CO2
点燃
S + O2 ===SO2
点燃
2KMnO4 =====K2MnO4+MnO2+O2↑
△
一.质量守恒定律:
反应物总质量=生成物总质量
二.化学方程式的书写
1.列式
2.配平
3.等号
4.条件
5.状态
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
