沪教2011课标版九年级化学下册第七章第2节 常见的酸和碱第一课时常见的酸(共28张ppt)
文档属性
| 名称 | 沪教2011课标版九年级化学下册第七章第2节 常见的酸和碱第一课时常见的酸(共28张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-04-27 10:57:51 | ||
图片预览








文档简介
第二章 常见的酸和碱
第一课时常见的酸
生活中发现的酸
“酸”一词从有酸味的酒而来。最早,在制酒的时候,有时把比较珍贵的酒放在窖中保存,在微生物的作用下,产生了酸。
谁知道有关“酸”的成语或故事多?
你已经知道了哪些酸?了解它们的性质吗?它们在生产、生活中有哪些应用?
讨论:
1、人的胃液里含有
2、汽车电瓶里含有
3、食醋里含有
4、酸雨里含有
盐酸
硫酸
醋酸
硫酸,也可能有硝酸
探究一:
浓硫酸和浓盐酸的物理性质
H2SO4
HCl
无色
无色
粘稠油状液体
液体
无气味
有刺激性气味
密度比水大
密度比水大
无
瓶口出现白雾
吸水性
挥发性
浓硫酸 浓盐酸
溶质的化学式
颜色
状态
气味
密度(与水比较)
打开瓶口的现象
其它
浓硫酸的特性:
吸水性(作为干燥剂)
浓硫酸的特性
脱水性
强氧化性
强腐蚀性
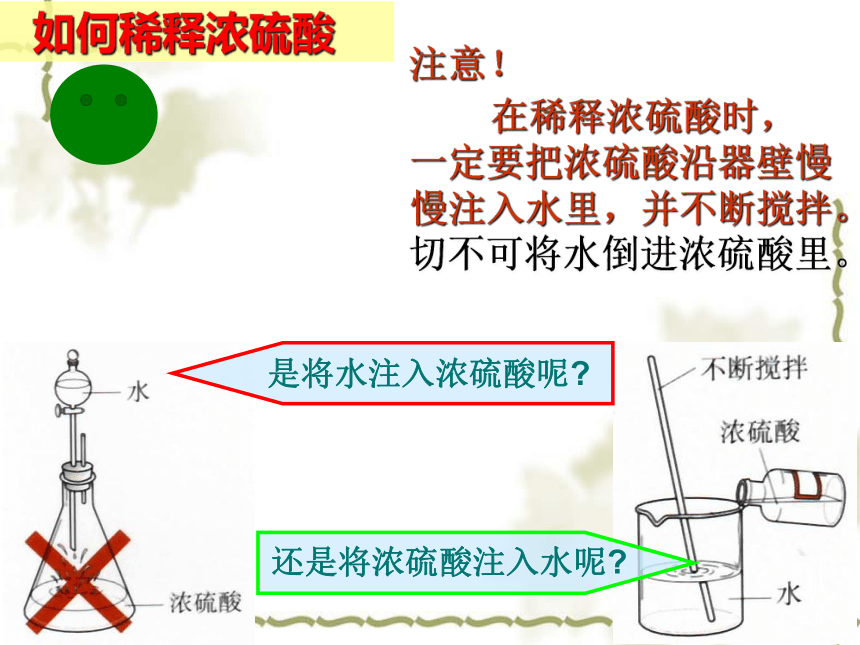
如何稀释浓硫酸
是将水注入浓硫酸呢?
还是将浓硫酸注入水呢?
注意!
在稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水里,并不断搅拌。切不可将水倒进浓硫酸里。
如果不慎将浓硫酸沾到皮肤或衣服上,应如何处理?
如果将稀硫酸沾到皮肤或衣服上,是否也要进行这样的处理?
1、你已经知道了哪些酸?能举出几个例子吗?
2、你了解它们的化学性质吗?
请让我们一起进入酸的王国探寻
探究活动二:
探究稀盐酸和稀硫酸的化学性质
“慧眼识酸”
实验:如图10-7所示,在白色点滴板上进行实验,观察现象,并把现象填在下表中:
酸溶液能使紫色石蕊变成红色
酸溶液不能使无色酚酞溶液变色
紫色石蕊变成溶液红色
紫色石蕊变成溶液红色
无色酚酞溶液不变色
无色酚酞溶液不变色
加紫色石蕊溶液 加无色酚酞溶液
稀盐酸
稀硫酸
规 律
“金属擂台赛”
在相同条件下,金属与酸发生置换反应越剧烈,金属单质的活动性越强.镁、锌、铜三种金属单质的活动性由强到弱的顺序是___________ 。
Mg+ 2HCl = MgCl2+H2↑
反应非常剧烈,产生气泡
Mg+ H2SO4=MgSO4+H2↑
反应非常剧烈,产生气泡
Zn + 2HCl = ZnCl2 + H2↑
反应速度适中,产生气泡
Zn+H2SO4=ZnSO4+H2↑
反应速度适中,产生气泡
镁、锌、铜
与稀盐酸反应 与稀硫酸反应
镁 现象
反应
原理
锌 现象
反应
原理
铜 现象
猜猜它们是谁
有四种金属分别是镁、铜、铁、锌,现把它们置于稀盐酸中,反应现象如图,请说出A、B、C、D各代表的是哪种金属。
Mg
Zn
Fe
Cu
结论:镁、铝、锌、铁等活动性较强的金属都能与稀硫酸、盐酸发生置换反应,放出氢气,同时生成一种称为盐的化合物。
活动性较强的金属+稀硫酸(盐酸)→盐+氢气
例: Zn+H2SO4== ZnSO4 + H2↑
Fe+2HCl == FeCl2 + H2↑
金属活动性顺序由强逐渐减弱
A.在金属活动性顺序表中,排在氢前面的金属能
置换出酸中的氢,排在氢后面的金属则不能;
C.强氧化性酸与金属反应后,不能生成氢气,而
是生成水;
B.排在金属活动性顺序表越前面的金属,反应现
象越剧烈,速度越快;
D.该类反应属于置换反应。
注意:
“除锈专家”
厨房里的菜刀、铁锅很容易生锈,用什么方法除去铁锈呢?
开始时观察到铁锈逐渐消失,溶液由无色慢慢变成黄色
Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
讨论:
利用上面的反应可以清除金属制品表面的锈,除锈时能否将金属制品长时间浸在酸中? 为什么?
现象 化学方程式
铁锈+盐酸
铁锈+硫酸
小明看见爸爸常常用稀盐酸给铁制器皿除锈,他自己想亲自试一试。于是,他找出一颗生锈铁钉出来,放入足量稀盐酸中,然后,美滋滋地去睡觉了……
可是,当他醒来之后,发现铁钉 不见了,你知道为什么吗?用两 个化学方程式表示出来。
生锈铁钉消失的原因
1、 Fe2O3+6HCl == 2FeCl3+ 3H2O
2、 Fe + 2HCl ==FeCl2 + H2↑
铁锈溶解 铁溶解 溶解完全
提醒:除锈时趋利避害,防止铁生“气”
CaCO3 + 2HCl == CaCl2+ CO2↑+ H2O
小组讨论:
1、盐酸、硫酸、硝酸在组成和性质上有许多共同之处。请你尽可能多地归纳出它们的共同点,并与同学们交流。
2、请你回忆第六章有关溶液导电性实验,通过讨论,对“酸的水溶液有共同的化学性质”做出解释。
电离时产生的阳离子全部都是氢离子(H+)的化合物。
HCl=H++Cl-
HNO3=H++NO3-
H2SO4=2H++SO42-
试归纳
(1)酸溶液与酸碱指示剂的反应
(2)酸溶液与某些金属反应
酸 + 活动性较强的金属 → 盐 + 氢气
(3)酸溶液与某些金属氧化物反应
酸溶液 + 金属氧化物 → 盐溶液 + 水
(4)酸溶液与某些盐反应
酸溶液 + 盐 → 新酸 + 新盐
或
酸 + 碳酸盐 → 新盐 + 水 + 二氧化碳
酸
腐蚀性
特 性
浓硫酸
浓盐酸
物 理
性 质
指示剂
活 泼
金 属
金属氧
化 物
某些盐
吸 水 性
脱
性
1.盐酸是 的水溶液,具有挥发性。打开盛浓盐酸的瓶盖时,在瓶口常看到 ,这是浓盐酸中挥发出来的 气体与空气中水蒸气形成盐酸小液滴的缘故实验室制取二氧化碳的化学方程式
。
2.(广东)对某无色溶液进行下列实验,根据实验现象得出的结论中,不正确的是 ( )
A.滴入紫色石蕊溶液,颜色变红,则该溶液显酸性
B.滴入酚酞溶液,溶液保持无色,则该溶液显酸性
C.加入Mg粉,有气泡产生,则该溶液显酸性
D.加入CaCO3固体,有气泡产生,则该溶液显酸性
B
试一试,相信你能行!
HCl
酸雾
CaCO3 + 2HCl =CaCl2+ CO2↑+ H2O
HCl
3.(金华)小韩知道蛋壳的主要成分是碳酸钙,决定送妈妈一个“无壳鸡蛋” 他从厨房中取来一个鸡蛋及一杯物质,将蛋泡在其中,则见蛋的表面冒出大量气泡,两天后就得到一个没有壳的蛋。他应取下列哪一种物质呢? ( )
A、高梁酒 B、醋 C、酱油 D、食盐水
4.(浙江)日常生活中遇到的下列污垢,不宜用盐酸清洗的是 ( )。
A、保温瓶内的水垢
B、玻璃水槽内的黄色铁锈斑
C、不锈钢茶杯内的茶垢
D、盛石灰水的试剂内壁的白色固体
C
B
加油吧,成功属于你!
5.(温州)下列实验操作规范的是 ( )
B
6.欲制备干燥的二氧化碳,所需要的试剂是( )
A.大理石、稀硫酸、浓硫酸
B.大理石、稀盐酸、浓硫酸
C.大理石、稀盐酸、稀硫酸
D.大理石、浓硫酸、浓盐酸
B
7.将下列溶液置于敞口容器中,一段时间后,其
溶质质量分数会减少的是( )
A.食盐水 B.浓硫酸 C.浓盐酸 D.硝酸钾溶液
B C
第一课时常见的酸
生活中发现的酸
“酸”一词从有酸味的酒而来。最早,在制酒的时候,有时把比较珍贵的酒放在窖中保存,在微生物的作用下,产生了酸。
谁知道有关“酸”的成语或故事多?
你已经知道了哪些酸?了解它们的性质吗?它们在生产、生活中有哪些应用?
讨论:
1、人的胃液里含有
2、汽车电瓶里含有
3、食醋里含有
4、酸雨里含有
盐酸
硫酸
醋酸
硫酸,也可能有硝酸
探究一:
浓硫酸和浓盐酸的物理性质
H2SO4
HCl
无色
无色
粘稠油状液体
液体
无气味
有刺激性气味
密度比水大
密度比水大
无
瓶口出现白雾
吸水性
挥发性
浓硫酸 浓盐酸
溶质的化学式
颜色
状态
气味
密度(与水比较)
打开瓶口的现象
其它
浓硫酸的特性:
吸水性(作为干燥剂)
浓硫酸的特性
脱水性
强氧化性
强腐蚀性
如何稀释浓硫酸
是将水注入浓硫酸呢?
还是将浓硫酸注入水呢?
注意!
在稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水里,并不断搅拌。切不可将水倒进浓硫酸里。
如果不慎将浓硫酸沾到皮肤或衣服上,应如何处理?
如果将稀硫酸沾到皮肤或衣服上,是否也要进行这样的处理?
1、你已经知道了哪些酸?能举出几个例子吗?
2、你了解它们的化学性质吗?
请让我们一起进入酸的王国探寻
探究活动二:
探究稀盐酸和稀硫酸的化学性质
“慧眼识酸”
实验:如图10-7所示,在白色点滴板上进行实验,观察现象,并把现象填在下表中:
酸溶液能使紫色石蕊变成红色
酸溶液不能使无色酚酞溶液变色
紫色石蕊变成溶液红色
紫色石蕊变成溶液红色
无色酚酞溶液不变色
无色酚酞溶液不变色
加紫色石蕊溶液 加无色酚酞溶液
稀盐酸
稀硫酸
规 律
“金属擂台赛”
在相同条件下,金属与酸发生置换反应越剧烈,金属单质的活动性越强.镁、锌、铜三种金属单质的活动性由强到弱的顺序是___________ 。
Mg+ 2HCl = MgCl2+H2↑
反应非常剧烈,产生气泡
Mg+ H2SO4=MgSO4+H2↑
反应非常剧烈,产生气泡
Zn + 2HCl = ZnCl2 + H2↑
反应速度适中,产生气泡
Zn+H2SO4=ZnSO4+H2↑
反应速度适中,产生气泡
镁、锌、铜
与稀盐酸反应 与稀硫酸反应
镁 现象
反应
原理
锌 现象
反应
原理
铜 现象
猜猜它们是谁
有四种金属分别是镁、铜、铁、锌,现把它们置于稀盐酸中,反应现象如图,请说出A、B、C、D各代表的是哪种金属。
Mg
Zn
Fe
Cu
结论:镁、铝、锌、铁等活动性较强的金属都能与稀硫酸、盐酸发生置换反应,放出氢气,同时生成一种称为盐的化合物。
活动性较强的金属+稀硫酸(盐酸)→盐+氢气
例: Zn+H2SO4== ZnSO4 + H2↑
Fe+2HCl == FeCl2 + H2↑
金属活动性顺序由强逐渐减弱
A.在金属活动性顺序表中,排在氢前面的金属能
置换出酸中的氢,排在氢后面的金属则不能;
C.强氧化性酸与金属反应后,不能生成氢气,而
是生成水;
B.排在金属活动性顺序表越前面的金属,反应现
象越剧烈,速度越快;
D.该类反应属于置换反应。
注意:
“除锈专家”
厨房里的菜刀、铁锅很容易生锈,用什么方法除去铁锈呢?
开始时观察到铁锈逐渐消失,溶液由无色慢慢变成黄色
Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
讨论:
利用上面的反应可以清除金属制品表面的锈,除锈时能否将金属制品长时间浸在酸中? 为什么?
现象 化学方程式
铁锈+盐酸
铁锈+硫酸
小明看见爸爸常常用稀盐酸给铁制器皿除锈,他自己想亲自试一试。于是,他找出一颗生锈铁钉出来,放入足量稀盐酸中,然后,美滋滋地去睡觉了……
可是,当他醒来之后,发现铁钉 不见了,你知道为什么吗?用两 个化学方程式表示出来。
生锈铁钉消失的原因
1、 Fe2O3+6HCl == 2FeCl3+ 3H2O
2、 Fe + 2HCl ==FeCl2 + H2↑
铁锈溶解 铁溶解 溶解完全
提醒:除锈时趋利避害,防止铁生“气”
CaCO3 + 2HCl == CaCl2+ CO2↑+ H2O
小组讨论:
1、盐酸、硫酸、硝酸在组成和性质上有许多共同之处。请你尽可能多地归纳出它们的共同点,并与同学们交流。
2、请你回忆第六章有关溶液导电性实验,通过讨论,对“酸的水溶液有共同的化学性质”做出解释。
电离时产生的阳离子全部都是氢离子(H+)的化合物。
HCl=H++Cl-
HNO3=H++NO3-
H2SO4=2H++SO42-
试归纳
(1)酸溶液与酸碱指示剂的反应
(2)酸溶液与某些金属反应
酸 + 活动性较强的金属 → 盐 + 氢气
(3)酸溶液与某些金属氧化物反应
酸溶液 + 金属氧化物 → 盐溶液 + 水
(4)酸溶液与某些盐反应
酸溶液 + 盐 → 新酸 + 新盐
或
酸 + 碳酸盐 → 新盐 + 水 + 二氧化碳
酸
腐蚀性
特 性
浓硫酸
浓盐酸
物 理
性 质
指示剂
活 泼
金 属
金属氧
化 物
某些盐
吸 水 性
脱
性
1.盐酸是 的水溶液,具有挥发性。打开盛浓盐酸的瓶盖时,在瓶口常看到 ,这是浓盐酸中挥发出来的 气体与空气中水蒸气形成盐酸小液滴的缘故实验室制取二氧化碳的化学方程式
。
2.(广东)对某无色溶液进行下列实验,根据实验现象得出的结论中,不正确的是 ( )
A.滴入紫色石蕊溶液,颜色变红,则该溶液显酸性
B.滴入酚酞溶液,溶液保持无色,则该溶液显酸性
C.加入Mg粉,有气泡产生,则该溶液显酸性
D.加入CaCO3固体,有气泡产生,则该溶液显酸性
B
试一试,相信你能行!
HCl
酸雾
CaCO3 + 2HCl =CaCl2+ CO2↑+ H2O
HCl
3.(金华)小韩知道蛋壳的主要成分是碳酸钙,决定送妈妈一个“无壳鸡蛋” 他从厨房中取来一个鸡蛋及一杯物质,将蛋泡在其中,则见蛋的表面冒出大量气泡,两天后就得到一个没有壳的蛋。他应取下列哪一种物质呢? ( )
A、高梁酒 B、醋 C、酱油 D、食盐水
4.(浙江)日常生活中遇到的下列污垢,不宜用盐酸清洗的是 ( )。
A、保温瓶内的水垢
B、玻璃水槽内的黄色铁锈斑
C、不锈钢茶杯内的茶垢
D、盛石灰水的试剂内壁的白色固体
C
B
加油吧,成功属于你!
5.(温州)下列实验操作规范的是 ( )
B
6.欲制备干燥的二氧化碳,所需要的试剂是( )
A.大理石、稀硫酸、浓硫酸
B.大理石、稀盐酸、浓硫酸
C.大理石、稀盐酸、稀硫酸
D.大理石、浓硫酸、浓盐酸
B
7.将下列溶液置于敞口容器中,一段时间后,其
溶质质量分数会减少的是( )
A.食盐水 B.浓硫酸 C.浓盐酸 D.硝酸钾溶液
B C
