沪教版九年级化学 6.1物质在水中的分散(25张PPT)
文档属性
| 名称 | 沪教版九年级化学 6.1物质在水中的分散(25张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 4.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-04-28 15:00:47 | ||
图片预览



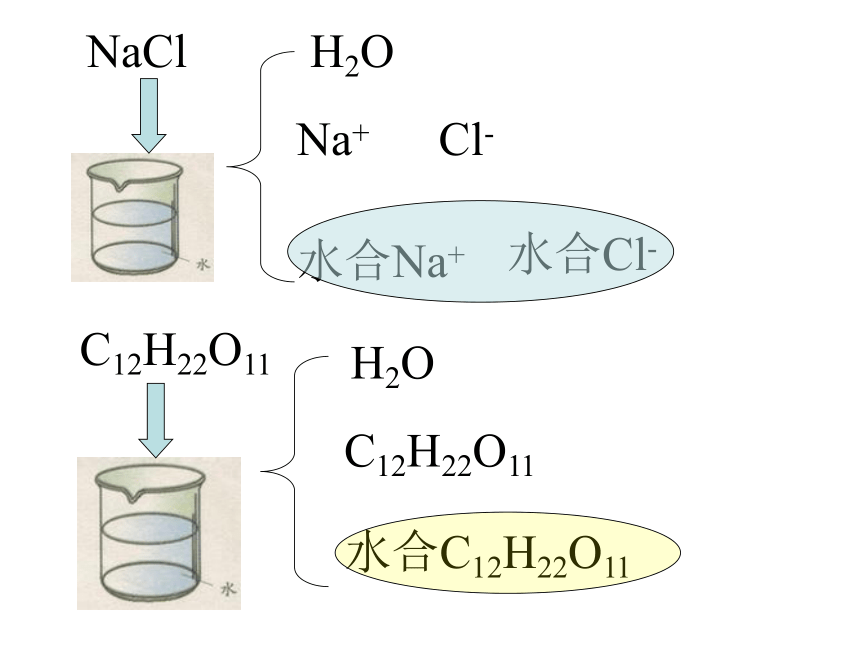


文档简介
第1节 物质在水中的分散
第6章 溶解现象
一、溶解与乳化
几种物质在水中的分散现象
固体在水中逐渐消失
水变浑浊,静置后泥土沉淀
水变浑浊,静置后油浮于水面
实 验 实验现象
高锰酸钾加入水中
泥土加入水中
食用油加入水中
2.哪些物质以固体小颗粒分散在水中?
3.哪些物质以小液滴分散在水中?
1.以上实验中,哪些物质能分散在水中形成均匀、稳定的体系?
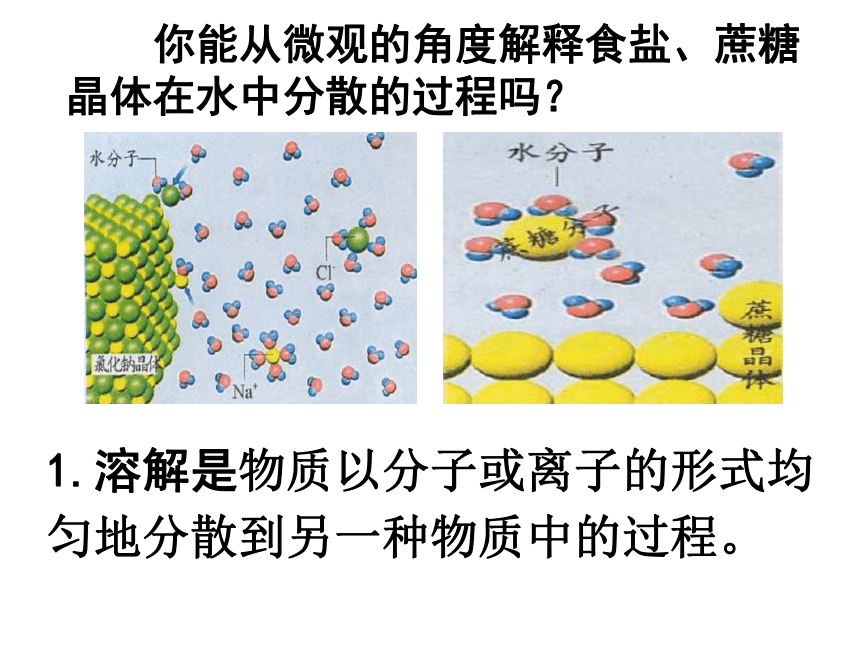
你能从微观的角度解释食盐、蔗糖晶体在水中分散的过程吗?
1.溶解是物质以分子或离子的形式均匀地分散到另一种物质中的过程。
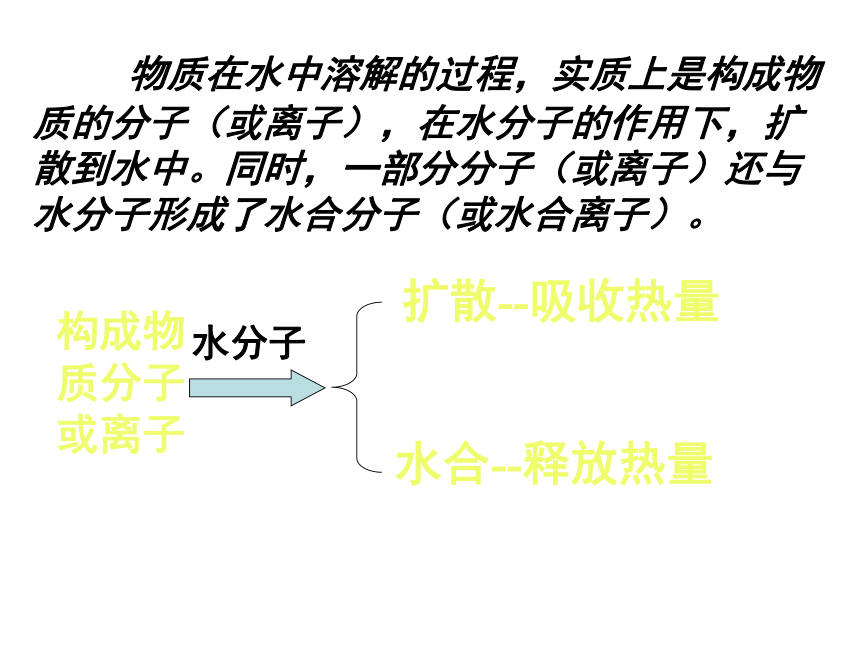
构成物质分子或离子
水分子
扩散--吸收热量
水合--释放热量
物质在水中溶解的过程,实质上是构成物质的分子(或离子),在水分子的作用下,扩散到水中。同时,一部分分子(或离子)还与水分子形成了水合分子(或水合离子)。
NaCl
Na+
Cl-
H2O
水合Na+
水合Cl-
C12H22O11
H2O
C12H22O11
水合C12H22O11
(1)物质溶解后形成均一、 稳定的混合物叫做溶液,如:食盐等。
(3)物质以小液滴分散到液体里形成的混合物叫做乳浊液,如:食用油等。
(2)物质以固体小颗粒悬浮于液体中形成的混合物叫做悬浊液,如:泥土等。
2.几个概念
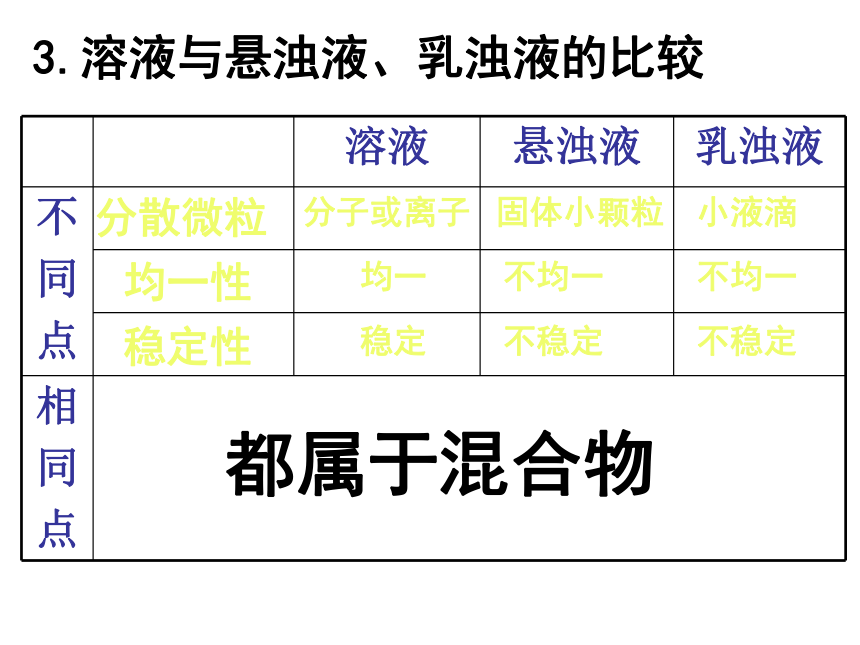
3.溶液与悬浊液、乳浊液的比较
分子或离子
均一
不均一
不均一
稳定
不稳定
不稳定
固体小颗粒
小液滴
都属于混合物
分散微粒
均一性
稳定性
溶液 悬浊液 乳浊液
不
同
点
相
同
点
如:CuSO4溶液是蓝色的,FeCl2溶液、FeSO4溶液是浅绿色的, KMnO4溶液是紫红色的,NaCl溶液等则呈无色。
有些物质溶解后,溶液会呈现颜色。
取一支试管,加入少量的水和数滴植物油,再加入数滴洗洁精,用橡皮塞塞紧试管,充分振荡,静置,观察实验现象。
再取一支试管,加入少量汽油,再滴入数滴植物油,用橡皮塞塞紧试管,充分振荡,静置,观察实验现象。
4.乳化现象
原本油与水互不相溶,加入某种试剂,使油形成小液滴悬浮在水中,形成乳浊液的现象。
5.乳化剂
能促使两种互不相溶的液体形成乳浊液的物质。具有亲水基和亲油基,既能溶解于水中,又能溶解于油中。
6.乳化作用的应用
主要是应用于洗涤剂,除此之外还有用于农药的合成、污水处理等。
(1)它们的洗涤原理
( 填 “相同” 或 “不相同” )
(2)汽油的洗涤原理是
洗洁精的洗涤原理是
汽油能洗去衣服上的油渍,洗洁精能洗去
餐具上的油污。
二、物质溶解过程中的能量变化
(1)某些物质溶解,使溶液温度升高
如:氢氧化钠
1.物质溶解中常伴有热量的变化
(2)某些物质溶解,使溶液温度降低
如:硝酸铵
(3)某些物质溶解,溶液温度没有变化
如:氯化钠
分别放入试管中,再加入等质量的水, 塞紧橡胶塞,振荡、静置,观察到的现象如上图所示。则试管中加入的固体是 ,理由是 。
将等质量的NaCl、 NH4NO3、 NaOH三种固体
A
B
C
D
冷 水
热 水
粉状固体
块状固体
①A、B烧杯中等质量的同种物质,它们在等量水中的溶解速率相同吗?
②C、D烧杯中等质量的同种物质,它们在等量水中的溶解速率相同吗?
在许多情况下,人们希望能够较快地溶解某些固体物质。怎样才能达到目的呢?
请你提出假设,并设计实验来验证你的假设。
我的假设 实验步骤 实验现象 实验结论
(1)搅拌(或振荡)
2.加快固体物质溶解的方法:
(3)改变固体颗粒的大小
(2)加热
1 . 在严寒的冬季,厨房里的水结冰了,
而盐水、食醋却不容易结冰;
2 . 煮沸的汤比煮沸的水的温度要高。
你知道其中的道理吗?
三、水溶液的某些性质
1.固体物质溶于水,使稀溶液的凝固点降低。
寒冷的冬季,一场大雪之后,公路上被积雪覆盖,为了使冰雪很快融化,可向积雪上撒些盐,你知道这是为什么吗?
3. 某些固体物质在水中溶解时生成自由移动的离子。
这些物质的水溶液能够导电
如:氯化钠、高锰酸钾等
蔗糖溶液、酒精溶液等不能导电
2. 固体物质溶于水 ,使稀溶液的沸点升高。
电离
物质溶于水,离解成自由移动离子的过程。
如:
NaCl = Na+ + Cl -
KMnO4 = K+ + MnO4 -
是不是在通电条件下才能电离呢?
是不是所有的物质都能电离呢?
为什么盛着水的水缸冬季在室外会被冻裂,
而正腌着咸菜的水缸在室外能安全过冬?
冬季建筑施工时,为何往砂浆中掺入
氯化钙可防冰冻?
在高山上,用普通的锅不容易将鸡蛋
煮熟,你有什么好办法将鸡蛋煮熟吗?
第6章 溶解现象
一、溶解与乳化
几种物质在水中的分散现象
固体在水中逐渐消失
水变浑浊,静置后泥土沉淀
水变浑浊,静置后油浮于水面
实 验 实验现象
高锰酸钾加入水中
泥土加入水中
食用油加入水中
2.哪些物质以固体小颗粒分散在水中?
3.哪些物质以小液滴分散在水中?
1.以上实验中,哪些物质能分散在水中形成均匀、稳定的体系?
你能从微观的角度解释食盐、蔗糖晶体在水中分散的过程吗?
1.溶解是物质以分子或离子的形式均匀地分散到另一种物质中的过程。
构成物质分子或离子
水分子
扩散--吸收热量
水合--释放热量
物质在水中溶解的过程,实质上是构成物质的分子(或离子),在水分子的作用下,扩散到水中。同时,一部分分子(或离子)还与水分子形成了水合分子(或水合离子)。
NaCl
Na+
Cl-
H2O
水合Na+
水合Cl-
C12H22O11
H2O
C12H22O11
水合C12H22O11
(1)物质溶解后形成均一、 稳定的混合物叫做溶液,如:食盐等。
(3)物质以小液滴分散到液体里形成的混合物叫做乳浊液,如:食用油等。
(2)物质以固体小颗粒悬浮于液体中形成的混合物叫做悬浊液,如:泥土等。
2.几个概念
3.溶液与悬浊液、乳浊液的比较
分子或离子
均一
不均一
不均一
稳定
不稳定
不稳定
固体小颗粒
小液滴
都属于混合物
分散微粒
均一性
稳定性
溶液 悬浊液 乳浊液
不
同
点
相
同
点
如:CuSO4溶液是蓝色的,FeCl2溶液、FeSO4溶液是浅绿色的, KMnO4溶液是紫红色的,NaCl溶液等则呈无色。
有些物质溶解后,溶液会呈现颜色。
取一支试管,加入少量的水和数滴植物油,再加入数滴洗洁精,用橡皮塞塞紧试管,充分振荡,静置,观察实验现象。
再取一支试管,加入少量汽油,再滴入数滴植物油,用橡皮塞塞紧试管,充分振荡,静置,观察实验现象。
4.乳化现象
原本油与水互不相溶,加入某种试剂,使油形成小液滴悬浮在水中,形成乳浊液的现象。
5.乳化剂
能促使两种互不相溶的液体形成乳浊液的物质。具有亲水基和亲油基,既能溶解于水中,又能溶解于油中。
6.乳化作用的应用
主要是应用于洗涤剂,除此之外还有用于农药的合成、污水处理等。
(1)它们的洗涤原理
( 填 “相同” 或 “不相同” )
(2)汽油的洗涤原理是
洗洁精的洗涤原理是
汽油能洗去衣服上的油渍,洗洁精能洗去
餐具上的油污。
二、物质溶解过程中的能量变化
(1)某些物质溶解,使溶液温度升高
如:氢氧化钠
1.物质溶解中常伴有热量的变化
(2)某些物质溶解,使溶液温度降低
如:硝酸铵
(3)某些物质溶解,溶液温度没有变化
如:氯化钠
分别放入试管中,再加入等质量的水, 塞紧橡胶塞,振荡、静置,观察到的现象如上图所示。则试管中加入的固体是 ,理由是 。
将等质量的NaCl、 NH4NO3、 NaOH三种固体
A
B
C
D
冷 水
热 水
粉状固体
块状固体
①A、B烧杯中等质量的同种物质,它们在等量水中的溶解速率相同吗?
②C、D烧杯中等质量的同种物质,它们在等量水中的溶解速率相同吗?
在许多情况下,人们希望能够较快地溶解某些固体物质。怎样才能达到目的呢?
请你提出假设,并设计实验来验证你的假设。
我的假设 实验步骤 实验现象 实验结论
(1)搅拌(或振荡)
2.加快固体物质溶解的方法:
(3)改变固体颗粒的大小
(2)加热
1 . 在严寒的冬季,厨房里的水结冰了,
而盐水、食醋却不容易结冰;
2 . 煮沸的汤比煮沸的水的温度要高。
你知道其中的道理吗?
三、水溶液的某些性质
1.固体物质溶于水,使稀溶液的凝固点降低。
寒冷的冬季,一场大雪之后,公路上被积雪覆盖,为了使冰雪很快融化,可向积雪上撒些盐,你知道这是为什么吗?
3. 某些固体物质在水中溶解时生成自由移动的离子。
这些物质的水溶液能够导电
如:氯化钠、高锰酸钾等
蔗糖溶液、酒精溶液等不能导电
2. 固体物质溶于水 ,使稀溶液的沸点升高。
电离
物质溶于水,离解成自由移动离子的过程。
如:
NaCl = Na+ + Cl -
KMnO4 = K+ + MnO4 -
是不是在通电条件下才能电离呢?
是不是所有的物质都能电离呢?
为什么盛着水的水缸冬季在室外会被冻裂,
而正腌着咸菜的水缸在室外能安全过冬?
冬季建筑施工时,为何往砂浆中掺入
氯化钙可防冰冻?
在高山上,用普通的锅不容易将鸡蛋
煮熟,你有什么好办法将鸡蛋煮熟吗?
