沪教版九下化学 6.3物质的溶解性 课件(15张PPT)
文档属性
| 名称 | 沪教版九下化学 6.3物质的溶解性 课件(15张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 4.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-05-28 00:00:00 | ||
图片预览




文档简介
课件15张PPT。1、什么是结晶?
2、结晶的方法有哪些?
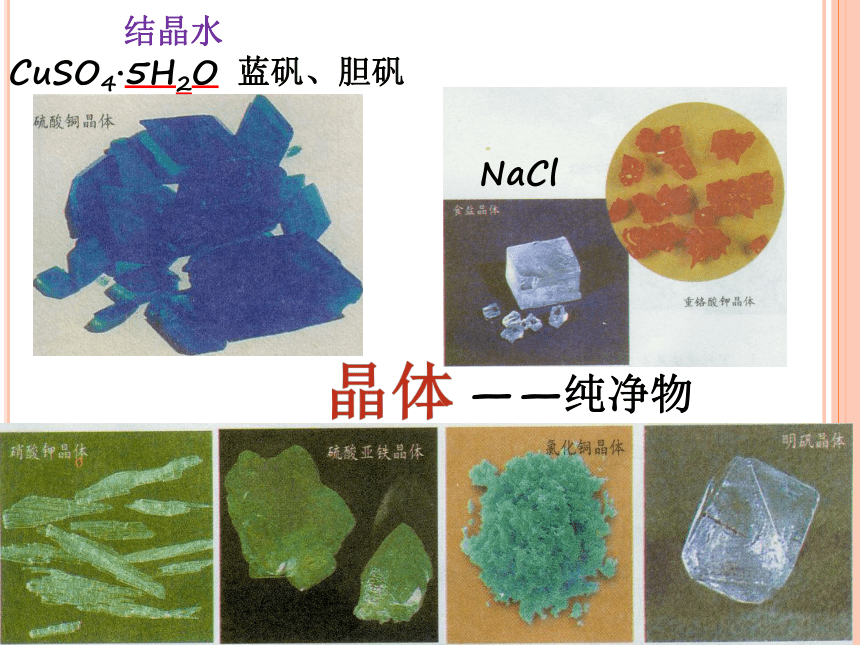
3、蒸发的注意事项有哪些?CuSO4·5H2O蓝矾、胆矾NaCl结晶水晶体——纯净物第六章 溶解现象 第三节 物质的溶解性三、结晶什么是结晶?活动1:用冷水冷却两支分别装有热的氯化钠浓溶液和硝酸钾浓溶液的试管。
实验现象:
讨论:为什么硝酸钾溶液中有晶体析出,而氯化钠溶液中却没有晶体析出?
硝酸钾溶液中有晶体出现,
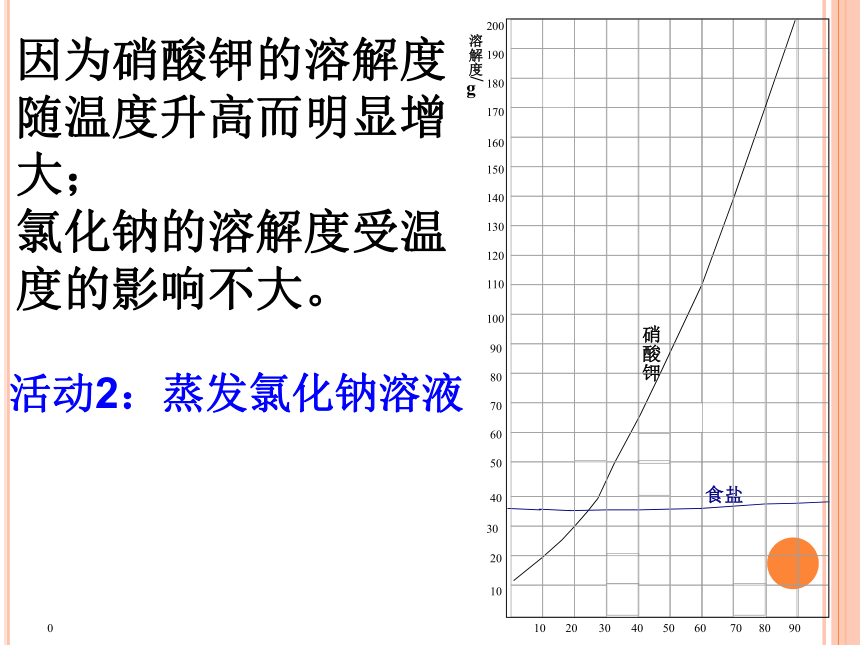
但氯化钠溶液中没有晶体出现。0因为硝酸钾的溶解度随温度升高而明显增大;
氯化钠的溶解度受温度的影响不大。活动2:蒸发氯化钠溶液蒸发结晶
方法降温结晶
(冷却热饱和溶液法)
蒸发结晶
(蒸发溶剂法)蒸发注意事项:
蒸发皿中的液体不宜超过蒸发皿容积的2/3
玻璃棒的作用:使液体受热均匀,防止液体飞溅。
蒸发到出现大量固体时,停止加热。
热的蒸发皿应用坩埚钳夹持放在石棉网上冷却。结晶
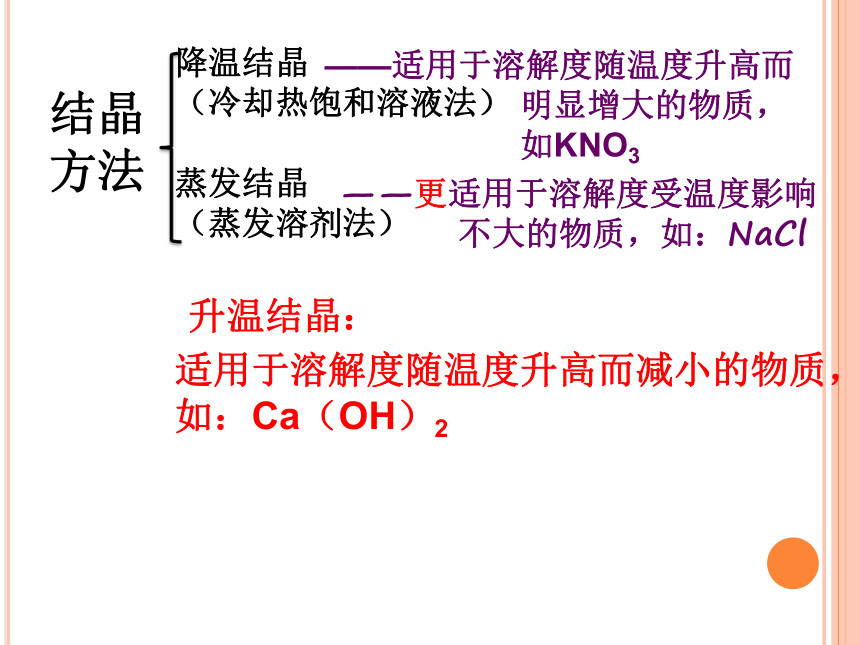
方法降温结晶
(冷却热饱和溶液法)
蒸发结晶
(蒸发溶剂法)
——更适用于溶解度受温度影响
不大的物质,如:NaCl——适用于溶解度随温度升高而
明显增大的物质,
如KNO3升温结晶:适用于溶解度随温度升高而减小的物质,
如:Ca(OH)2降温结晶的原理:不饱和溶液降温饱和溶液降温结晶(饱和溶液)蒸发结晶的原理:不饱和溶液蒸发饱和溶液蒸发结晶(饱和溶液)总结2:不饱和溶液变成饱和溶液时,溶质的质量分数有可能不变。(蒸发时,变大;降温时,不变)总结1:1、溶液必须达到饱和后才能析出晶体。2、析出晶体后的溶液一定是饱和溶液。降温、蒸发操作中,溶液中的各种量都发生了什么变化?(1)不饱和溶液 饱和溶液(2)饱和溶液 结晶不变不变不变不变减小不变减小减小不变减小减小增大减小减小减小不变结晶在工农业或生活中有何应用呢?应用一:制得晶体“晒盐”“产硝”应用二 :提纯KNO3和
NaCl(少量)
的混合物溶解热饱和溶液降温KNO3结晶过滤KNO3晶体溶液(KNO3饱和溶液,
含少量NaCl)如何从KNO3和NaCl(少量)的混合物中分离出KNO3?
取样,溶解,降温。如何从NaCl和KNO3(少量)的混合物中分离出NaCl?取样,溶解,蒸发。NaCl和CaCO3溶解NaCl溶解
CaCO3不溶过滤NaCl溶液
CaCO3固体蒸发NaCl固体烘干洗涤
纯净的
CaCO3
固体
如何分离NaCl和CaCO3的混合物?
粗盐的提纯:溶解过滤蒸发转移加快溶解速度引流使液体受热均匀,防止液滴飞溅
转移
玻璃棒的作用神奇的盐花 美丽壮观“硝凇”被誉为中国“死海”的山西运城盐湖,夏产盐,冬产硝(十水合硫酸钠)。夏天湖中会出现“盐花”,冬天会形成美丽的“硝凇”奇观.为什么同一个湖能夏产盐,冬产硝?现象解释:
2、结晶的方法有哪些?
3、蒸发的注意事项有哪些?CuSO4·5H2O蓝矾、胆矾NaCl结晶水晶体——纯净物第六章 溶解现象 第三节 物质的溶解性三、结晶什么是结晶?活动1:用冷水冷却两支分别装有热的氯化钠浓溶液和硝酸钾浓溶液的试管。
实验现象:
讨论:为什么硝酸钾溶液中有晶体析出,而氯化钠溶液中却没有晶体析出?
硝酸钾溶液中有晶体出现,
但氯化钠溶液中没有晶体出现。0因为硝酸钾的溶解度随温度升高而明显增大;
氯化钠的溶解度受温度的影响不大。活动2:蒸发氯化钠溶液蒸发结晶
方法降温结晶
(冷却热饱和溶液法)
蒸发结晶
(蒸发溶剂法)蒸发注意事项:
蒸发皿中的液体不宜超过蒸发皿容积的2/3
玻璃棒的作用:使液体受热均匀,防止液体飞溅。
蒸发到出现大量固体时,停止加热。
热的蒸发皿应用坩埚钳夹持放在石棉网上冷却。结晶
方法降温结晶
(冷却热饱和溶液法)
蒸发结晶
(蒸发溶剂法)
——更适用于溶解度受温度影响
不大的物质,如:NaCl——适用于溶解度随温度升高而
明显增大的物质,
如KNO3升温结晶:适用于溶解度随温度升高而减小的物质,
如:Ca(OH)2降温结晶的原理:不饱和溶液降温饱和溶液降温结晶(饱和溶液)蒸发结晶的原理:不饱和溶液蒸发饱和溶液蒸发结晶(饱和溶液)总结2:不饱和溶液变成饱和溶液时,溶质的质量分数有可能不变。(蒸发时,变大;降温时,不变)总结1:1、溶液必须达到饱和后才能析出晶体。2、析出晶体后的溶液一定是饱和溶液。降温、蒸发操作中,溶液中的各种量都发生了什么变化?(1)不饱和溶液 饱和溶液(2)饱和溶液 结晶不变不变不变不变减小不变减小减小不变减小减小增大减小减小减小不变结晶在工农业或生活中有何应用呢?应用一:制得晶体“晒盐”“产硝”应用二 :提纯KNO3和
NaCl(少量)
的混合物溶解热饱和溶液降温KNO3结晶过滤KNO3晶体溶液(KNO3饱和溶液,
含少量NaCl)如何从KNO3和NaCl(少量)的混合物中分离出KNO3?
取样,溶解,降温。如何从NaCl和KNO3(少量)的混合物中分离出NaCl?取样,溶解,蒸发。NaCl和CaCO3溶解NaCl溶解
CaCO3不溶过滤NaCl溶液
CaCO3固体蒸发NaCl固体烘干洗涤
纯净的
CaCO3
固体
如何分离NaCl和CaCO3的混合物?
粗盐的提纯:溶解过滤蒸发转移加快溶解速度引流使液体受热均匀,防止液滴飞溅
转移
玻璃棒的作用神奇的盐花 美丽壮观“硝凇”被誉为中国“死海”的山西运城盐湖,夏产盐,冬产硝(十水合硫酸钠)。夏天湖中会出现“盐花”,冬天会形成美丽的“硝凇”奇观.为什么同一个湖能夏产盐,冬产硝?现象解释:
