沪教版九年级化学第6章第2节溶液组成的表示 (共20张PPT)
文档属性
| 名称 | 沪教版九年级化学第6章第2节溶液组成的表示 (共20张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 490.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-11-22 09:40:57 | ||
图片预览







文档简介
(共20张PPT)
第二节 溶液组成的表示
你知道的更多:举几例溶液在工农业生产和生活中的应用
一、溶液的组成
基本概念
被溶解的 物质叫做溶质,
溶解溶质的 物质叫做溶剂。
溶液质量=溶质质量+溶剂质量
溶液的组成:
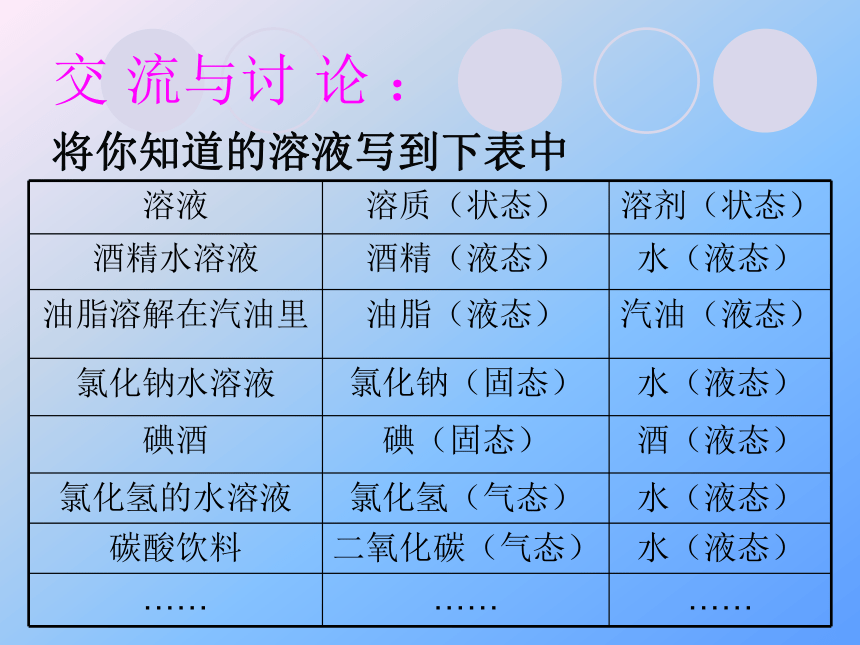
交 流与讨 论 :
将你知道的溶液写到下表中
溶液 溶质(状态) 溶剂(状态)
酒精水溶液 酒精(液态) 水(液态)
油脂溶解在汽油里 油脂(液态) 汽油(液态)
氯化钠水溶液 氯化钠(固态) 水(液态)
碘酒 碘(固态) 酒(液态)
氯化氢的水溶液 氯化氢(气态) 水(液态)
碳酸饮料 二氧化碳(气态) 水(液态)
…… …… ……
溶质可以是固体、液体,也可以
是气体。
水是最常用的溶剂。
除特别说明外,一般所说的溶
液都是指水溶液。
二、溶液组成的定量表示(溶液浓度表示):
[实验1]:
3g蔗糖+20ml水,搅拌使蔗糖完全溶解
[实验2]:
5g蔗糖+50ml水,搅拌使蔗糖完全溶解
比较哪个甜一点,如何进行比较?
定义:
溶质质量与溶液质量的比值叫做
溶质的质量分数。
溶质的质量分数
=
溶质质量
溶液质量
×
100%
正确读取量筒刻度:
视线与液面底部齐平。
例题:
在做电解水的实验时,为了增强水的导电性,可在水中加入少量强氧化钠溶液,将4克氢氧化钠固体溶解在46克水中,得到的氢氧化钠溶液的溶质质量分数是多少?
解:氢氧化钠的质量是4g,水的质量是46g
溶液的质量是4g+46g=50g
溶质的质量分数=
4g
50g
×
100%
=
8%
答:氢氧化钠溶液的溶质质量分数是8%。
课堂练习:
2、某溶液100g,溶质质量分数为20%
则溶质质量为多少?
1、将4g蔗糖加到46g水中,全部溶解
制成糖水,此时糖水溶液的溶质
质量分数是多少?
1、解:蔗糖的质量是4g,水的质量是46g
溶液的质量是4g+46g=50g
溶质的质量分数=
×
100%
=
4g
50g
8%
2、解:溶液的质量是100g
溶质的质量是100X20%=20g
答:糖水溶液的溶质质量分数是20%。
答:溶质的质量为20g。
本课知识小结
1、能区分溶液中的溶质和溶剂
2、理解向溶液中增加溶质或溶剂的质量后,溶质的质量分数的变化规律。
课后思考:
如何用37%,密度为1.18g·cm-3浓
盐酸配制50g溶质质量分数为5%的盐
酸溶液。
计 算:____________________
量取溶液:____________________
配制溶液:____________________
例:实验室需配制10%的稀硫酸200克,需要溶质质量分数为98%
、密度是1.84g·cm-3的浓硫酸多少毫升?还要再加多少毫升水?(水的密度是1g·cm-3 )
原理:稀释得到的溶液质量等于所用的浓溶液质量与稀释所有的水的质量之和,而稀释前后溶质的质量不变。
课堂练习:
用90%的浓食盐溶液配制90g10%
的稀食盐溶液,需要多少克90%的浓
食盐溶液?并说出如何配制。
计算:稀释得到的溶液质量等于所用的浓溶液质量与稀释所有的水的质量之和,而稀释前后溶质的质量不变。
设浓食盐水质量为X克
90X10%= 90%XX
浓溶液质量为:10g
需加入水的质量为:90g-10g=80g
水的质量:90-9-1=80g
配制方法:取90%的浓盐酸10g,在加
入 80g水。
拓展视野:
无土栽培
练 习 :
1、若要配制100Kg质量分数为15%的食盐溶液,需要食盐和水各多少Kg?
2、配制10%的H2SO4溶液500ml,需98%的浓H2SO4多少克?水多少ml?( 10%的H2SO4密度:1.03g/ml, 98%的浓H2SO4密度:1.84g/ml)
小结:
1、溶液的组成;
2、溶质质量分数的计算;
3、配制溶液的步骤。
第二节 溶液组成的表示
你知道的更多:举几例溶液在工农业生产和生活中的应用
一、溶液的组成
基本概念
被溶解的 物质叫做溶质,
溶解溶质的 物质叫做溶剂。
溶液质量=溶质质量+溶剂质量
溶液的组成:
交 流与讨 论 :
将你知道的溶液写到下表中
溶液 溶质(状态) 溶剂(状态)
酒精水溶液 酒精(液态) 水(液态)
油脂溶解在汽油里 油脂(液态) 汽油(液态)
氯化钠水溶液 氯化钠(固态) 水(液态)
碘酒 碘(固态) 酒(液态)
氯化氢的水溶液 氯化氢(气态) 水(液态)
碳酸饮料 二氧化碳(气态) 水(液态)
…… …… ……
溶质可以是固体、液体,也可以
是气体。
水是最常用的溶剂。
除特别说明外,一般所说的溶
液都是指水溶液。
二、溶液组成的定量表示(溶液浓度表示):
[实验1]:
3g蔗糖+20ml水,搅拌使蔗糖完全溶解
[实验2]:
5g蔗糖+50ml水,搅拌使蔗糖完全溶解
比较哪个甜一点,如何进行比较?
定义:
溶质质量与溶液质量的比值叫做
溶质的质量分数。
溶质的质量分数
=
溶质质量
溶液质量
×
100%
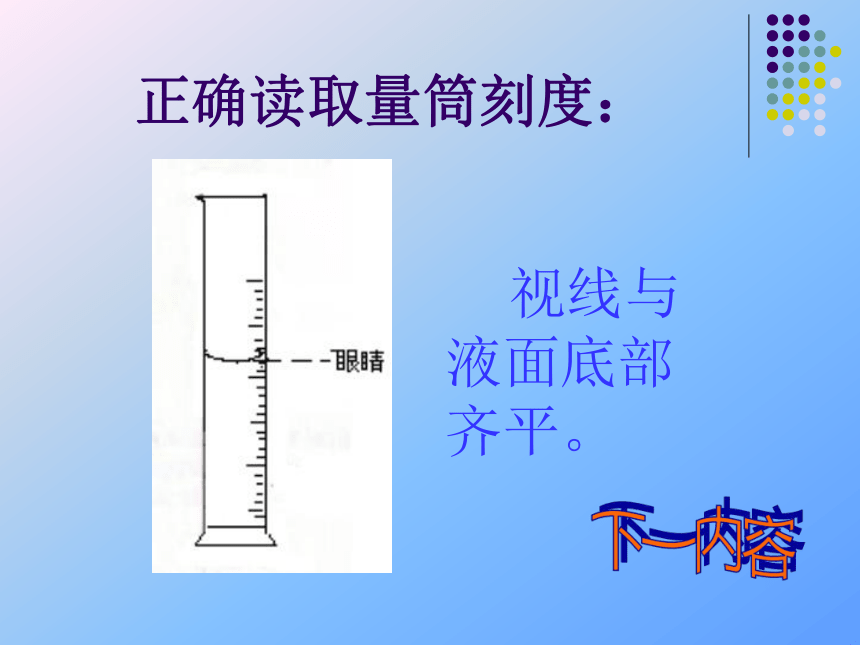
正确读取量筒刻度:
视线与液面底部齐平。
例题:
在做电解水的实验时,为了增强水的导电性,可在水中加入少量强氧化钠溶液,将4克氢氧化钠固体溶解在46克水中,得到的氢氧化钠溶液的溶质质量分数是多少?
解:氢氧化钠的质量是4g,水的质量是46g
溶液的质量是4g+46g=50g
溶质的质量分数=
4g
50g
×
100%
=
8%
答:氢氧化钠溶液的溶质质量分数是8%。
课堂练习:
2、某溶液100g,溶质质量分数为20%
则溶质质量为多少?
1、将4g蔗糖加到46g水中,全部溶解
制成糖水,此时糖水溶液的溶质
质量分数是多少?
1、解:蔗糖的质量是4g,水的质量是46g
溶液的质量是4g+46g=50g
溶质的质量分数=
×
100%
=
4g
50g
8%
2、解:溶液的质量是100g
溶质的质量是100X20%=20g
答:糖水溶液的溶质质量分数是20%。
答:溶质的质量为20g。
本课知识小结
1、能区分溶液中的溶质和溶剂
2、理解向溶液中增加溶质或溶剂的质量后,溶质的质量分数的变化规律。
课后思考:
如何用37%,密度为1.18g·cm-3浓
盐酸配制50g溶质质量分数为5%的盐
酸溶液。
计 算:____________________
量取溶液:____________________
配制溶液:____________________
例:实验室需配制10%的稀硫酸200克,需要溶质质量分数为98%
、密度是1.84g·cm-3的浓硫酸多少毫升?还要再加多少毫升水?(水的密度是1g·cm-3 )
原理:稀释得到的溶液质量等于所用的浓溶液质量与稀释所有的水的质量之和,而稀释前后溶质的质量不变。
课堂练习:
用90%的浓食盐溶液配制90g10%
的稀食盐溶液,需要多少克90%的浓
食盐溶液?并说出如何配制。
计算:稀释得到的溶液质量等于所用的浓溶液质量与稀释所有的水的质量之和,而稀释前后溶质的质量不变。
设浓食盐水质量为X克
90X10%= 90%XX
浓溶液质量为:10g
需加入水的质量为:90g-10g=80g
水的质量:90-9-1=80g
配制方法:取90%的浓盐酸10g,在加
入 80g水。
拓展视野:
无土栽培
练 习 :
1、若要配制100Kg质量分数为15%的食盐溶液,需要食盐和水各多少Kg?
2、配制10%的H2SO4溶液500ml,需98%的浓H2SO4多少克?水多少ml?( 10%的H2SO4密度:1.03g/ml, 98%的浓H2SO4密度:1.84g/ml)
小结:
1、溶液的组成;
2、溶质质量分数的计算;
3、配制溶液的步骤。
