沪教版化学九年级下册 7.3 几种重要的盐 课件 (共84张PPT)
文档属性
| 名称 | 沪教版化学九年级下册 7.3 几种重要的盐 课件 (共84张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 9.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-19 17:53:42 | ||
图片预览










文档简介
(共84张PPT)
第三节 几种重要的盐
第1课时 盐的性质
日常生活中我们接触过很多种盐。如调味用的食盐,建筑、雕塑用的大理石、汉白玉的主要成分(碳酸钙)是盐,用于净水的明矾(含硫酸铝)是盐,常用的小苏打(主要成分碳酸氢钠)是盐,消毒用的高锰酸钾是盐,大多数化肥(如硫酸铵、碳酸氢铵等)也是盐。。。
氯化钠(NaCl)、氯化钙(CaCl2)、碳酸钠(Na2CO3)、硫酸铜(CuSO4)、硝酸铵(NH4NO3)都是盐,根据酸碱中和反应生成盐和水的事实,它们在组成上的相同之处是什么?
1.盐:由金属离子(或铵根离子)和酸根离子组成的化合物。
如NaCl、CaCl2、Na2SO4等。
理解:
盐是一类化合物的总称,氯化钠是盐类中的一种,不能认为盐就是氯化钠。
2) 盐类物质不一定都含有金属元素,如NH4NO3、 (NH4)2CO3.
3)NaHCO3、 Cu2(OH)2CO3等物质中除含有金属离子和酸根离子外,还会有氢元素或氢氧根,也属于盐类物质。
一、盐
2.盐的分类及命名
1)依据组成盐的阳离子和酸根的种类对其进行分类:
按阳离子可以把盐分成钾盐、钠盐、钙盐等;
按阴离子也可以把盐分成盐酸盐、硫酸盐、硝酸盐、碳酸盐等。
2)依据盐的组成分:
正盐、酸式盐、碱式盐
3)依据盐的溶解性分:
可溶性盐、难溶性盐
2.盐的分类及命名
4)正盐:“某酸某”或“某化某”
酸式盐:在正盐前面加上“酸式”二字,或“某酸氢某”或“某氢化某”
碱式盐:在正盐前面加上“碱式”二字。
请查阅课本附录四,说明:①钾盐、钠盐、铵盐、硝酸盐的溶解性;②碳酸盐、磷酸盐的溶解性;③钙盐、钡盐、银盐的溶解性;④BaSO4(钡餐的主要成分)、CaSO4(石膏的主要成分)和硝酸钾的溶解性。
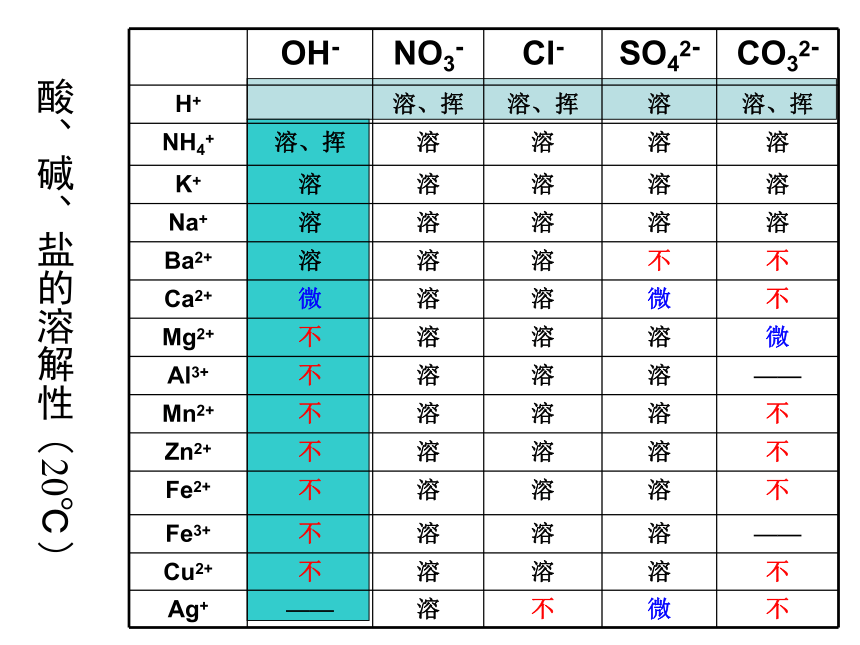
酸、碱、盐的溶解性(20℃)
OH- NO3- Cl- SO42- CO32-
H+ 溶、挥 溶、挥 溶 溶、挥
NH4+ 溶、挥 溶 溶 溶 溶
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 不 不
Ca2+ 微 溶 溶 微 不
Mg2+ 不 溶 溶 溶 微
Al3+ 不 溶 溶 溶 ——
Mn2+ 不 溶 溶 溶 不
Zn2+ 不 溶 溶 溶 不
Fe2+ 不 溶 溶 溶 不
Fe3+ 不 溶 溶 溶 ——
Cu2+ 不 溶 溶 溶 不
Ag+ —— 溶 不 微 不
盐的溶解性
a、钾盐、钠盐、铵盐、硝酸盐都易溶于水
b、盐酸盐中只有AgCl不溶于水
c、硫酸盐中只有BaSO4不溶于水
d、碳酸盐大部分不溶于水,除钾、钠、铵盐外
补充:酸可溶 (限于初中);
溶碱5种:KOH Ca(OH)2 NaOH
Ba(OH)2 NH3.H2O
大部分沉淀为白色
物质溶解性口诀
钾钠铵盐都可溶, 硝盐遇水影无踪,
硫酸盐不溶硫酸钡, 硫酸钙银是微溶,
碳酸盐只溶钾钠铵, 氯化物只有银不溶,
碱溶钾钠钡氨钙, 酸除硅酸全都溶。
注:AgCl、BaSO4不仅不溶于水,而且不溶于稀硝酸
判断下列物质是否溶于水:
Na2CO3 AgCl BaCO3 MgSO4 BaSO4 Cu(OH)2 (NH4)2SO4 Ba(OH)2 Mg(OH)2
AgNO3 Na3PO4 Fe(OH)3
白色↓
白色↓
白色↓
蓝色↓
白色↓
红褐色↓
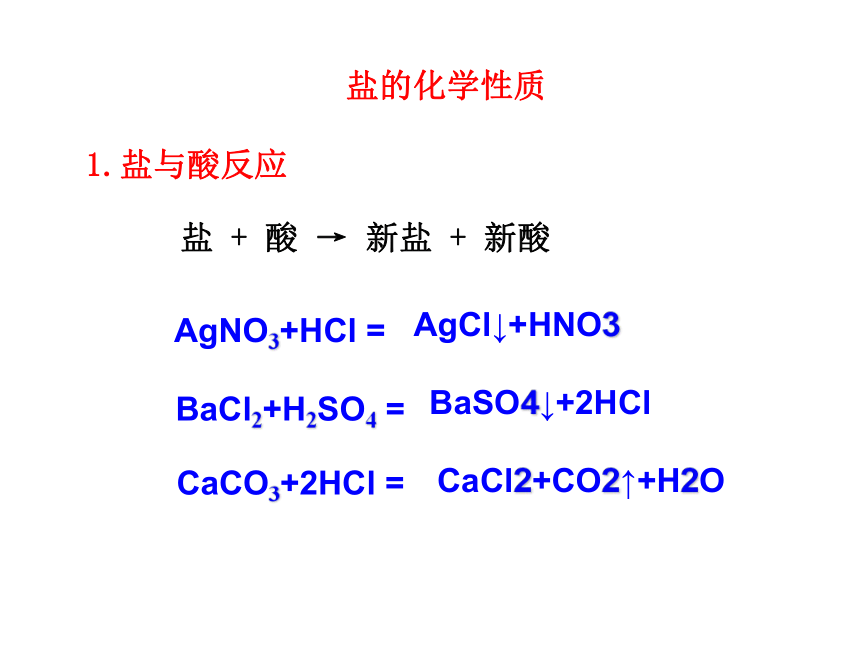
盐的化学性质
1.盐与酸反应
盐 + 酸 → 新盐 + 新酸
AgNO3+HCl =
BaCl2+H2SO4 =
CaCO3+2HCl =
AgCl↓+HNO3
BaSO4↓+2HCl
CaCl2+CO2↑+H2O
2.盐与碱反应
CuSO4 + Ca(OH)2 =
Cu(OH)2↓+ CaSO4
Ca(OH)2+Na2CO3 =
盐 + 碱 → 新盐 + 新碱
CuSO4+2NaOH =
FeCl3+3NaOH =
Cu(OH)2 ↓ +Na2SO4
Fe(OH)3↓+3NaCl
CaCO3 ↓ +2NaOH
铁钉表面有红色固体析出
铝片表面有红色固体析出
铜片表面有银白色固体析出
3.盐与某些金属反应
实验操作 现象
与金属的反应 Fe +CuSO4
Al+ CuSO4
Cu+AgNO3
Fe + CuSO4 = FeSO4 +Cu
2Al+3CuSO4 = Al2(SO4)3+3Cu
Cu+2AgNO3 = Cu(NO3)2+2Ag
能与金属反应,生成另一种盐和金属
盐 + 金属 → 新盐 + 新金属
实验操作 方程 结论
与金属的反应 Fe+CuSO4
Al+CuSO4
Cu+AgNO3
主要应用:
1.金属的位置越靠前,它的活动性就越强
2.位于氢前的金属能置换出盐酸、稀硫酸(不能用浓硫
酸、硝酸)中的氢
3.位于前面的金属能把位于后面的金属从它们的盐溶液
中置换出来(钾、钙、钠除外)
金属活动性由强逐渐减弱
金属活动性顺序:
在金属活动性顺序中
规律: 验证金属的活动性顺序,药品最少,步骤最省的是:
①所选物质必须含有要确定的金属元素;
②相邻两个物质类别不同。
思路1:中间金、两边盐
练习:选择适当的试剂确定Al、Cu、Fe的活动性顺序
思路2:中间盐、两边金
AlCl3 Fe CuCl2
Al FeCl2 Cu
有白色沉淀生成
有白色沉淀生成
4.盐与另一种盐的反应
实验操作 现象
与盐的作用
AgNO3+NaCl
Na2SO4+BaCl2
NaCl+AgNO3 = AgCl↓+NaNO3
Na2SO4+BaCl2
Na2SO4+BaCl2 = BaSO4↓+2NaCl
新盐
盐 + 盐 → 新盐 + 新盐
实验操作 方程 结论
与盐的作用 AgNO3+NaCl 与盐的作用生成两种______
盐的化学性质:
⑴盐 + 金属 → 新盐 + 新金属
在金属活动顺序中,只有排在前面的金属才能把排在它后面的金属从它的盐溶液中置换出来。
⑵ 盐 + 酸 → 新盐 + 新酸
碳酸盐都可以和酸(除CaCO3和稀硫酸外)反应,氯化银、硫酸钡不和酸反应。
小结
(3)盐 + 碱 → 新盐 + 新碱
(4)盐 + 盐 → 新盐 + 新盐
注意:(3)、(4)反应物必须可溶
酸的通性:
(1)酸溶液可以使紫色石蕊试液变红,不能使酚酞试
液变色。
(2)酸+活泼金属→盐+氢气(3)酸+金属氧化物→盐+水
(4)酸+碱→盐+水 (5)酸+盐→新酸+新盐
回顾
碱的通性:
(1)碱溶液能使紫色石蕊变蓝,使无色酚酞变红
(2)碱溶液 + 非金属氧化物 → 盐 + 水
(3)碱 + 酸 → 盐 + 水
(4)碱溶液 + 盐溶液 → 新盐 + 新碱
归纳:单质、氧化物、酸碱盐之间的相互转化
金属
非金属
金属 氧化物
非金属氧化物
碱
酸
盐
盐
O2
O2
H2O
H2O
↓
↓
↓
↓
盐
盐
盐
盐
盐
盐
盐
2、判断下列化合物属于盐的是( )
A、Na2O B、Mg(OH)2 C、H2SO4
D、NH4Cl E、Na2CO3
D E
1、用化学方程式表示出制取氯化镁的几种途径
4、下列四种金属中,有一种金属的盐溶液与其他三种金属都能发生置换反应,这种金属是( )
A.Fe B.Ag
C.Zn D.Cu
B
3、把金属X放入CuCl2溶液中有红色物质析出,放入MgCl2溶液中无现象。则X、Cu、Mg三种金属活动性由强到弱的顺序正确的是( )
A.Mg、X、Cu B.Cu、X、Mg
C.Mg、Cu、X D.X、Mg、Cu
A
5、有一包固体粉末,可能由CaCO3、Na2SO4、KNO3、
CuSO4、BaCl2中的一种或几种组成,通过实验得到以下结果:
(1)将此固体粉末加到水中,得到白色沉淀,上层清液为无色;
(2)该白色沉淀不溶于稀硝酸。
从实验中判断,该粉末中一定含有 ,一定不含 ,可能含有 。
Na2SO4和BaCl2
CuSO4 和CaCO3
KNO3
思考:我们现在所说的盐是不是就是我们平时吃的食盐呢?
不是,盐是一类物质,它包括的种类很多,食盐只是其中一种,自然界中很多盐是晶体
盐是酸跟碱中和的产物。酸中的酸根阴离子和碱中的金属
阳离子结合而成。
注意:有的晶体不是盐,有的晶体是盐;
那么大家对食盐又了解了多少?生活中常见的盐还有哪些呢,本节我们将带你了解几种常见的盐。
1.氯化钠是食盐的主要成分。
一.氯化钠
2.物理性质:无色晶体,,易溶于水(其溶解度随温度变化不大),不潮解(粗盐因含杂质MgCl2、CaCl2而容易潮解)。
注:工业用盐亚硝酸钠(NaNO2)外观与食盐相似,有毒,易致癌。
NaCl + AgNO3 = AgCl↓ + NaNO3
3.食盐的化学性质
2NaCl + 2H2O === 2NaOH + H2↑ + Cl2↑
通电
5.氯化钠有哪些主要用途?
①作调味品(日常每人每天约3---5g以
维持正常生理活动)
②做食品防腐剂
③医疗上制作生理盐水(0.9% NaCl溶液)
④农业选种(16% NaCl溶液)
⑤作工业原料,用于生产氯气、烧碱等;
⑥作除雪剂(降低雪的凝固点/冰点)
4.粗盐制取方法:一般采用蒸发溶剂法。
6.生活中的常用调味品——食盐的存在
食盐的化学名称叫氯化钠,它在地球上的储量很丰富,海洋中的氯化钠含量约占海水中各种盐类总量的20%,达10120万亿吨;它也占河水入海盐类的20%,可达54600万吨。氯化钠可从矿物(岩盐、卤水)直接开采。或从海水和盐湖中晒制出来,作为工农业原料与加工成食用盐。氯化钠有1万多种用途,其中95%是用于工农业,尤其是没有盐就没有化学工业。化工厂制取苛性钠、盐酸、氯气、纯碱、硫酸钠、杀虫剂和漂白扮等;染料厂制染科;印染厂与洗染店的助染剂;制高级玻璃与香皂的澄清剂;制药工业制抗生素、解热药和环胺剂等;制塑料、纸、油漆、合成橡胶、化妆品、电池、电石等;保存皮革、冰、腌制鱼、内、蔬菜以及农业选种等都需要盐。但是工业用盐的80%是在软化硬水中用于还原再生阳离子交换树脂和磺化媒。在消耗的食盐中,除一小部分换成别的物质外,绝大部分随工农业废水与生活污水渗入地下、排入河湖中,再注入海洋。
你知道吗?
在古罗马表示富有与贫穷,不看拥有黄金的多少,而是比藏有盐粒的数量,被历史上称为食盐货币时代。
我国的西藏过去也使用过盐巴货币。为了换取生活必需的一小块盐巴,需要付出昂贵的代价。贵州解放前只有少数人家吃得起吊盐(吃完饭以后,用舌头在吊挂着的盐块上舔一下)可见食盐的贵重。
日常生活中常用食盐水清洗伤口,你知道这是为什么吗?
因为浓的食盐溶液会使细胞内的水渗出,使蛋白质凝固,所以具有杀菌作用。
1、某10岁少年因食用非法私制的食盐而中毒殒命。
2、某女大学生一口气吃了十多根火腿肠,出现休克现象。经
医院抢救后脱险。
我们购买食盐一定要注意,不能买工业用的盐!
原因是NaNO2
新闻事件两则
亚硝酸钠
? 亚硝酸钠是工业用盐,它是一种白色不透明晶体,形状很像食盐,有咸味,其水溶液呈碱性。亚硝酸盐不仅是致癌物质,而且摄入0.2~0.5 g即可引起食物中毒,3 g可致死。而亚硝酸盐是食品添加剂的一种,起着色、防腐作用,广泛用于熟肉类、灌肠类和罐头等动物性食品。现在世界各国仍允许用它来腌制肉类,但用量严加限制。
俗称纯碱,又叫苏打。有天然的,也有化学方法生产的。
二.碳酸钠(Na2CO3)
1.物理性质:白色粉末状固体,易溶于水,溶解时放热。
制取方法:联合制碱法(侯德榜简介)
3.用途:重要的化工原料,广泛用于生产玻璃、造纸、纺织和日用化学工业。
2.化学性质:
1)水溶液能使无色酚酞变红色。(其水溶液呈碱性,故称纯碱)
2)Na2CO3+2HCl==2NaCl+H2O+CO2↑
3) Na2CO3+Ca(OH)2==CaCO3↓+2NaOH
我国著名的化学家侯德榜(1890-1974),在改进纯碱(Na2CO3)的生产方面曾作出了杰出的贡献。在二十世纪二十年代,他成功的改进了生产纯碱的方法,发明了联合制碱法(又称侯氏制碱法),打破了帝国主义对制碱技术的垄断,是我国制碱工业的先驱和奠基人。
侯德榜被称为“国宝”。 侯德榜一生在化工技术上有三大贡献。第一,揭开了苏尔维法的秘密。第二,创立了中国人自己的制碱工艺——侯氏制碱法。第三,就是他为发展小化肥工业所做的贡献。
附:候德榜联合制纯碱原理
① NH3+CO2+H2O=NH4HCO3
② NH4HCO3 +NaCl=NH4Cl+ NaHCO3↓
③ 2NaHCO3△Na2CO3? +CO2↑+H2O
三酸:硫酸、盐酸、硝酸
你知道“三酸两碱”指的是哪些物质吗?
两碱:烧碱、纯碱
注意:纯碱不是碱,而是盐
一个国家酸碱盐的产量,在一定程度上反映了
化学工业的发展水平。
三.碳酸氢钠(NaHCO3) 俗称小苏打
1.物理性质:白色粉末状固体。
3.用途:焙制糕点所用的发酵粉主要成分之一,也是治疗胃酸过多的药物。
2.化学性质:
1)NaHCO3 + HCl == NaCl + H2O + CO2↑(治疗胃酸过多)2) 2NaHCO3 == Na2CO3 + H2O + CO2↑
(此反应用于鉴别NaHCO3与Na2CO3 )
石灰石的主要成分。自然界中的大理石、方解石、白垩、蛋壳、贝壳和珍珠豆含有碳酸钙;锅炉和水壶的水垢主要成分也是碳酸钙。
4.碳酸钙(CaCO3)
物理性质:白色粉末状固体。
用途:重要的建筑材料,生产生石灰、水泥、玻璃以及炼铁,也是一种补钙剂。
化学性质:
CaCO3+2HCl====CaCO3+H2O+CO2↑
主要成分是
钟乳石
大理石
贝壳
珍珠
鸡蛋壳
锅炉里的水垢
水壶里的水垢
水垢
我们是石灰岩地区
到处都有石灰石
石灰石经过长期的地质作用,可以变成大理石(因盛产于云南大理而得名)
一般为白色,有得带有美丽的花纹
质地坚硬、颜色洁白的细粒大理石俗称汉白石,上等建筑材料
北京天安门前的华表
圆明园
人民英雄纪念碑浮雕群
让我们做一个简单的实验:P56
1、取一小块片状石灰石(或贝壳、蛋壳)仔细观察,看看是否容易捏碎、敲碎。
2、用坩埚钳夹持石灰石,放在酒精灯或煤气灯的外焰灼烧几分钟,放在石棉网冷看看是否容易捏碎、敲碎。
3、将另一片石灰石灼烧几分钟,却然后把它投入盛有冷水的小烧杯内,可以看到什么现象?
静置后,取出少量上层澄清的液体置于两支试管中,向一支试管中加入2滴酚酞试液,向另一支试管中的液体吹气,观察现象。
4、将你观察到的结果记录下来,尝试用化学、物理知识作解释,并与同学们进行交流
不易捏碎、敲碎。
易捏碎、敲碎。
跟冷水反应放出热
滴有酚酞的变红色;吹气澄清液体变浑浊
圆明园全景
圆明园大水法遗址
都说坚如磐石,为什么那些美丽的汉白玉经过大火的焚烧就粉碎坍塌了呢?
明代的《天工开物》
烧石灰图
石灰石、大理石经过高温灼烧,其中的碳酸钙会转变成疏松的氧化钙和二氧化碳。
人们习惯上把氧化钙称为生石灰。上述过程可以简要地表示如下:
CaCO3===CaO+CO2↑
高温
除石灰石以外,用白垩等含碳酸钙的矿物、贝壳等也可以制取生石灰。
氧化钙:俗称生石灰
1.性质:白色固体;与水反应
2.用途:①做食品干燥剂:强烈的吸水性(但不可用于干燥酸性气体)
②加热食品(一拉热):与水反应放热
③建筑材料
CaO +H2O===Ca(OH)2 放热
生石灰 熟石灰
氢氧化钙:俗称熟石灰,消石灰
1.性质:白色固体,微溶于水,形成的溶液
即澄清石灰水.形成的浆即石灰浆.
2.用途:建筑材料(原理用化学方程式表示),
改良酸性土壤,配制农药波尔多液。
Ca(OH)2+CO2==CaCO3↓+H2O
千锤万凿出深山,
烈火焚烧若等闲。
粉身碎骨浑不怕,
要留清白在人间。
赏古诗
《石灰吟》
于谦
石灰吟
于谦
千锤万凿出深山,
烈火焚烧若等闲。
粉身碎骨浑不怕,
要留清白在人间。
思考、你能用化学知识解释《石灰吟》这首诗吗?
1、石灰石、生石灰、熟石灰之间可以相互转化,请用化学方程式表示下图中的3个化学反应。
石灰石
(碳酸钙)
生石灰
熟石灰
(1)
(2)
(3)
(2) CaO+H2O = Ca(OH)2
(氧化钙)
(氢氧化钙)
(3)Ca(OH)2+CO2=CaCO3↓+H2O
2、存放石灰水的试剂瓶壁经常会有一种白色固体,它是怎样形成的?如何将它除去?在家中,水瓶内壁出现水垢怎样清洗?
白色固体是空气中的二氧化碳和氢氧化钙反应生成的碳酸钙,可以先用稀盐酸溶解,再用水清洗。在家中,可用醋来清洗水瓶内壁的水垢。
下面我们进行如下的实验,并把实验现象记录,再分析一下这些物质的组成。看看可以得到什么结论?
常用的纯碱是碳酸钠
Na2CO3
草木灰中含有碳酸钾
K2CO3
农业上使用的化肥碳铵
NH4HCO3
都有气泡产生,还可以使澄清石灰水变浑浊
都有二氧化碳生成
物质的名称
与化学式 加入盐酸
后的现象 结论
都含有碳酸根
CO3
统 称
碳酸盐
碳 酸 钠:
碳 酸 钾:
碳 酸 钙:
碳酸氢铵:
Na2 CO3
K2 CO3
Ca CO3
NH4H CO3
碳酸盐的化学性质:能与酸(如稀盐酸)反应,产生二氧化碳。
它们都含有碳酸根,我们称之为碳酸盐
从化学式看它们的组成都有相同的什么?
检验碳酸盐的方法:
向样品中加入稀盐酸,有能使澄清石灰水变浑浊的气体生成。
5.硫酸铜(CuSO4)
白色固体,能溶于水,水溶液呈蓝色,常利用硫酸铜的这一特性,即遇水变蓝来检验水的存在。
硫酸铜有毒,常用它和熟石灰配制农药波尔多液。
CuSO4+Ca(OH)2====Cu(OH)2↓+CaSO4
“庄稼一枝花,全靠肥当家
三、化学肥料
农作物生长需要哪些营养元素呢?
一、化肥:即化学肥料,通过化学加工生产的(含有农作物生长所需营养元素)肥料。
氮(N)、 磷(P)、 钾(K)
生活链接
农业上常用的化肥
1.氮肥
尿素: CO(NH2)2
氨水: NH3·H2O
铵盐: NH4HCO3、NH4Cl 、 (NH4)2SO4
硝酸盐:NH4NO3、NaNO3
二、化学肥料的分类及作用
氮肥的分类
氨水
有机氮肥:尿素
铵态氮肥:碳酸氢铵
硝态氮肥 :硝酸钠
1.氮肥
氮肥的作用:
氮肥能促使植物的茎、叶生长茂盛,叶色浓绿。
常见的磷肥:
磷矿粉:Ca3(PO4)2
钙镁磷肥:钙和镁的磷酸盐
重过磷酸钙Ca(H2PO4)2
过磷酸钙:Ca(H2PO4)2+CaSO4
混合物
2.磷肥
2.磷肥
磷肥的作用:促进作物根系发达,促进作物提早成熟,使之穗粒增多,籽粒饱满,还可增强抗寒、抗旱能力。
作物缺磷的表现:生长迟缓、产量降低。
钾肥的作用:可促进作物生长健壮,茎秆粗壮、 增强抗病虫害和抗倒伏能力等功能。
3.钾肥
作物缺钾的症状:
茎秆软弱,抗病能力低,易倒伏,叶尖及叶缘发黄。
常见的钾肥:硫酸钾(K2SO4)、氯化钾(KCl)
K2CO3 ( 草木灰的主要成份 )
复合化肥:含两种或两种以上营养元素的化肥。
如:
磷酸二氢铵(NH4H2PO4)、
磷酸氢二铵 (NH4)2HPO4、硝酸钾(KNO3)
复合肥料
分类
钾肥(含K)
氮肥
(含N)
磷肥
(含P)
复合
肥料
能促进作物生长健壮,茎秆粗硬,增强对病虫害和
倒伏的抵抗能力,并能促进糖分和淀粉的生成 K2SO4
能促进作物根系发达,增强抗寒抗旱能力,还能促进作物提早成熟,穗粒增多,籽粒饱满 Ca3(PO4)2
能促使作物的茎、叶生长茂盛,叶色浓绿
氨气、NH4HCO3、 (NH4)2SO4、 CO(NH2)2
含有两种或两种以上营养元素的化肥
KNO3、 NH4H2PO4
化学肥料大部分属于酸、碱、盐中的哪一类呢?
空气中78%都是氮气,能不能直接被植物体利用吸收呢?
空气中各成分的百分比
氮气 78%
氧气 21%
稀有气体 0.94%
二氧化碳 0.03%
其它 0.03%
根瘤菌的固氮
延伸与拓展
因此,要化肥与农家肥配合使用,促进农作物增产。
化学肥料 农家肥料
所含营养元素种类少,但营养元素的含量大 常含多种营养元素,营养元素含量较少
一般易溶于水,易于被作物吸收,肥效较快 一般较难溶于水,经腐熟后逐步转化为可溶于水、能被作物吸收的物质,肥效较慢但较长
便于工业生产,成本较高 便于就地取材,成本低廉
有些品种化肥如长期大量施用能使土壤板结 能改良土壤结构
三、化肥的利与弊
三、化肥的利与弊[来源:Zxxk.Com]
四、常见化肥的鉴别
延伸与拓展
常见的方法:看色、闻味、溶水
氮肥(N) 磷肥(P) 钾肥(K)
碳酸氢铵 氯化铵 磷矿粉 过磷酸钙 硫酸钾 氯化钾
外观
气味
溶解性
在农业生产中经常使用铵态氮肥,在实验室里可以
用简单的方法检验铵态氮肥。
(实验一):把少量的硫酸铵放在研钵中,再加入一
些熟石灰,用研杵混合研磨,小心闻混合物的气味。
(实验二):把少量的硫酸铵放在试管中,加入3ml氢
氧化钠溶液,在酒精灯上微热,把湿润的红色石蕊试
纸放在试管口,观察试纸颜色变化。
在农业生产中经常使用铵态氮肥,在实验室里可以
用简单的方法检验铵态氮肥。
(实验一):把少量的硫酸铵放在研钵中,再加入一
些熟石灰,用研杵混合研磨,小心闻混合物的气味。
现象:有刺激性气味放出
化学方程式:
(NH4)2SO4+Ca(OH)2=CaSO4+2H2O+2NH3↑
在农业生产中经常使用铵态氮肥,在实验室里可以
用简单的方法检验铵态氮肥。
(实验二):把少量的硫酸铵放在试管中,加入3ml氢
氧化钠溶液,在酒精灯上微热,把湿润的红色石蕊试
纸放在试管口,观察试纸颜色变化。
现象:加热后,看到湿润的红色石蕊试纸变蓝
化学方程式:
(NH4)2SO4+2NaOH = Na2SO4+2H2O+2NH3↑
△
常见化肥的鉴别
小结——铵盐(NH4+)检验方法:
加碱研磨,闻是否有刺鼻的氨味
加熟石灰
请同学完成以下四种化肥的检验
2NH4CI+Ca(OH)2=CaCI2+2H2O+2NH3↑
放出有刺激性
气味的氨气
放出有刺激性
气味的氨气
无有刺激性
气味气体生成
无有刺激性
气味气体生成
加碱
氮肥(N) 钾肥(K)
硫酸铵 氯化铵 硫酸钾 氯化钾
加熟石灰
研磨(搅拌)
化肥的使用:
不能滥用,要根据土壤特点和作物生长需要合理利用化肥。
对同一块土地不能长期用一种化肥,否则会破坏土壤结构,要将化肥与农家肥交替使用。
使用铵态氮肥时,避免与草木灰(K2CO3)、熟石灰(Ca(OH)2)等碱性物质混用,否则会降低肥效。
(1)污染水体:使水中N、P含量升高,富营养化
(2)污染大气:有NH3等不良气体放出
(3)破坏土壤:使土壤酸化、板结
使用化肥与环境的关系
化肥是植物的粮食,是提高农业生产的物质基础,合理施用化肥对提高单位面积产量和不断提高土壤肥力均起着重要的作用。但不合理施用也会带来危害,对环境造成污染。化肥的不合理施用会造成:
【例2】 下列化肥属于复合肥料的是:( )
A. NH4Cl B. NH4NO3 C. K2SO4 D. KNO3
【例1】下列物质可以直接做肥料施用的是( )
A.氢氧化钙 B.硝酸铵 C.氢氧化钾 D.硝酸
B
D
【例3】下列化肥不能与熟石灰混合施用的是( )
A.氯化钾 B.碳酸氢铵 C.磷酸钙 D .硝酸钾
B
A
【例4】某同学家中种植的植物比正常的植株矮小瘦弱,叶片发黄,严重 时叶脉呈淡棕色,你认为应该施加下列哪一种化肥:( )
A. KNO3 B. KCl C. Ca(H2PO4)2 D. CO(NH2)2
为鉴别(NH4)2CO3、(NH4)2SO4、KCl、K2SO4四种化肥,
某同学设计了如下所示的实验方案,请你根据每步实验现象将
有关化肥的化学式填写在下图相应的空格中。
有气体产生
无气体产生
有白色沉淀
无白色沉淀
(NH4)2CO3、(NH4)2SO4
KCl、K2SO4
(NH4)2CO3
(NH4)2SO4
K2SO4
KCl
【例5】
今天你学到了什么?[来源:学_科_网]
看色、闻味、溶水、加碱
第三节 几种重要的盐
第1课时 盐的性质
日常生活中我们接触过很多种盐。如调味用的食盐,建筑、雕塑用的大理石、汉白玉的主要成分(碳酸钙)是盐,用于净水的明矾(含硫酸铝)是盐,常用的小苏打(主要成分碳酸氢钠)是盐,消毒用的高锰酸钾是盐,大多数化肥(如硫酸铵、碳酸氢铵等)也是盐。。。
氯化钠(NaCl)、氯化钙(CaCl2)、碳酸钠(Na2CO3)、硫酸铜(CuSO4)、硝酸铵(NH4NO3)都是盐,根据酸碱中和反应生成盐和水的事实,它们在组成上的相同之处是什么?
1.盐:由金属离子(或铵根离子)和酸根离子组成的化合物。
如NaCl、CaCl2、Na2SO4等。
理解:
盐是一类化合物的总称,氯化钠是盐类中的一种,不能认为盐就是氯化钠。
2) 盐类物质不一定都含有金属元素,如NH4NO3、 (NH4)2CO3.
3)NaHCO3、 Cu2(OH)2CO3等物质中除含有金属离子和酸根离子外,还会有氢元素或氢氧根,也属于盐类物质。
一、盐
2.盐的分类及命名
1)依据组成盐的阳离子和酸根的种类对其进行分类:
按阳离子可以把盐分成钾盐、钠盐、钙盐等;
按阴离子也可以把盐分成盐酸盐、硫酸盐、硝酸盐、碳酸盐等。
2)依据盐的组成分:
正盐、酸式盐、碱式盐
3)依据盐的溶解性分:
可溶性盐、难溶性盐
2.盐的分类及命名
4)正盐:“某酸某”或“某化某”
酸式盐:在正盐前面加上“酸式”二字,或“某酸氢某”或“某氢化某”
碱式盐:在正盐前面加上“碱式”二字。
请查阅课本附录四,说明:①钾盐、钠盐、铵盐、硝酸盐的溶解性;②碳酸盐、磷酸盐的溶解性;③钙盐、钡盐、银盐的溶解性;④BaSO4(钡餐的主要成分)、CaSO4(石膏的主要成分)和硝酸钾的溶解性。
酸、碱、盐的溶解性(20℃)
OH- NO3- Cl- SO42- CO32-
H+ 溶、挥 溶、挥 溶 溶、挥
NH4+ 溶、挥 溶 溶 溶 溶
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 不 不
Ca2+ 微 溶 溶 微 不
Mg2+ 不 溶 溶 溶 微
Al3+ 不 溶 溶 溶 ——
Mn2+ 不 溶 溶 溶 不
Zn2+ 不 溶 溶 溶 不
Fe2+ 不 溶 溶 溶 不
Fe3+ 不 溶 溶 溶 ——
Cu2+ 不 溶 溶 溶 不
Ag+ —— 溶 不 微 不
盐的溶解性
a、钾盐、钠盐、铵盐、硝酸盐都易溶于水
b、盐酸盐中只有AgCl不溶于水
c、硫酸盐中只有BaSO4不溶于水
d、碳酸盐大部分不溶于水,除钾、钠、铵盐外
补充:酸可溶 (限于初中);
溶碱5种:KOH Ca(OH)2 NaOH
Ba(OH)2 NH3.H2O
大部分沉淀为白色
物质溶解性口诀
钾钠铵盐都可溶, 硝盐遇水影无踪,
硫酸盐不溶硫酸钡, 硫酸钙银是微溶,
碳酸盐只溶钾钠铵, 氯化物只有银不溶,
碱溶钾钠钡氨钙, 酸除硅酸全都溶。
注:AgCl、BaSO4不仅不溶于水,而且不溶于稀硝酸
判断下列物质是否溶于水:
Na2CO3 AgCl BaCO3 MgSO4 BaSO4 Cu(OH)2 (NH4)2SO4 Ba(OH)2 Mg(OH)2
AgNO3 Na3PO4 Fe(OH)3
白色↓
白色↓
白色↓
蓝色↓
白色↓
红褐色↓
盐的化学性质
1.盐与酸反应
盐 + 酸 → 新盐 + 新酸
AgNO3+HCl =
BaCl2+H2SO4 =
CaCO3+2HCl =
AgCl↓+HNO3
BaSO4↓+2HCl
CaCl2+CO2↑+H2O
2.盐与碱反应
CuSO4 + Ca(OH)2 =
Cu(OH)2↓+ CaSO4
Ca(OH)2+Na2CO3 =
盐 + 碱 → 新盐 + 新碱
CuSO4+2NaOH =
FeCl3+3NaOH =
Cu(OH)2 ↓ +Na2SO4
Fe(OH)3↓+3NaCl
CaCO3 ↓ +2NaOH
铁钉表面有红色固体析出
铝片表面有红色固体析出
铜片表面有银白色固体析出
3.盐与某些金属反应
实验操作 现象
与金属的反应 Fe +CuSO4
Al+ CuSO4
Cu+AgNO3
Fe + CuSO4 = FeSO4 +Cu
2Al+3CuSO4 = Al2(SO4)3+3Cu
Cu+2AgNO3 = Cu(NO3)2+2Ag
能与金属反应,生成另一种盐和金属
盐 + 金属 → 新盐 + 新金属
实验操作 方程 结论
与金属的反应 Fe+CuSO4
Al+CuSO4
Cu+AgNO3
主要应用:
1.金属的位置越靠前,它的活动性就越强
2.位于氢前的金属能置换出盐酸、稀硫酸(不能用浓硫
酸、硝酸)中的氢
3.位于前面的金属能把位于后面的金属从它们的盐溶液
中置换出来(钾、钙、钠除外)
金属活动性由强逐渐减弱
金属活动性顺序:
在金属活动性顺序中
规律: 验证金属的活动性顺序,药品最少,步骤最省的是:
①所选物质必须含有要确定的金属元素;
②相邻两个物质类别不同。
思路1:中间金、两边盐
练习:选择适当的试剂确定Al、Cu、Fe的活动性顺序
思路2:中间盐、两边金
AlCl3 Fe CuCl2
Al FeCl2 Cu
有白色沉淀生成
有白色沉淀生成
4.盐与另一种盐的反应
实验操作 现象
与盐的作用
AgNO3+NaCl
Na2SO4+BaCl2
NaCl+AgNO3 = AgCl↓+NaNO3
Na2SO4+BaCl2
Na2SO4+BaCl2 = BaSO4↓+2NaCl
新盐
盐 + 盐 → 新盐 + 新盐
实验操作 方程 结论
与盐的作用 AgNO3+NaCl 与盐的作用生成两种______
盐的化学性质:
⑴盐 + 金属 → 新盐 + 新金属
在金属活动顺序中,只有排在前面的金属才能把排在它后面的金属从它的盐溶液中置换出来。
⑵ 盐 + 酸 → 新盐 + 新酸
碳酸盐都可以和酸(除CaCO3和稀硫酸外)反应,氯化银、硫酸钡不和酸反应。
小结
(3)盐 + 碱 → 新盐 + 新碱
(4)盐 + 盐 → 新盐 + 新盐
注意:(3)、(4)反应物必须可溶
酸的通性:
(1)酸溶液可以使紫色石蕊试液变红,不能使酚酞试
液变色。
(2)酸+活泼金属→盐+氢气(3)酸+金属氧化物→盐+水
(4)酸+碱→盐+水 (5)酸+盐→新酸+新盐
回顾
碱的通性:
(1)碱溶液能使紫色石蕊变蓝,使无色酚酞变红
(2)碱溶液 + 非金属氧化物 → 盐 + 水
(3)碱 + 酸 → 盐 + 水
(4)碱溶液 + 盐溶液 → 新盐 + 新碱
归纳:单质、氧化物、酸碱盐之间的相互转化
金属
非金属
金属 氧化物
非金属氧化物
碱
酸
盐
盐
O2
O2
H2O
H2O
↓
↓
↓
↓
盐
盐
盐
盐
盐
盐
盐
2、判断下列化合物属于盐的是( )
A、Na2O B、Mg(OH)2 C、H2SO4
D、NH4Cl E、Na2CO3
D E
1、用化学方程式表示出制取氯化镁的几种途径
4、下列四种金属中,有一种金属的盐溶液与其他三种金属都能发生置换反应,这种金属是( )
A.Fe B.Ag
C.Zn D.Cu
B
3、把金属X放入CuCl2溶液中有红色物质析出,放入MgCl2溶液中无现象。则X、Cu、Mg三种金属活动性由强到弱的顺序正确的是( )
A.Mg、X、Cu B.Cu、X、Mg
C.Mg、Cu、X D.X、Mg、Cu
A
5、有一包固体粉末,可能由CaCO3、Na2SO4、KNO3、
CuSO4、BaCl2中的一种或几种组成,通过实验得到以下结果:
(1)将此固体粉末加到水中,得到白色沉淀,上层清液为无色;
(2)该白色沉淀不溶于稀硝酸。
从实验中判断,该粉末中一定含有 ,一定不含 ,可能含有 。
Na2SO4和BaCl2
CuSO4 和CaCO3
KNO3
思考:我们现在所说的盐是不是就是我们平时吃的食盐呢?
不是,盐是一类物质,它包括的种类很多,食盐只是其中一种,自然界中很多盐是晶体
盐是酸跟碱中和的产物。酸中的酸根阴离子和碱中的金属
阳离子结合而成。
注意:有的晶体不是盐,有的晶体是盐;
那么大家对食盐又了解了多少?生活中常见的盐还有哪些呢,本节我们将带你了解几种常见的盐。
1.氯化钠是食盐的主要成分。
一.氯化钠
2.物理性质:无色晶体,,易溶于水(其溶解度随温度变化不大),不潮解(粗盐因含杂质MgCl2、CaCl2而容易潮解)。
注:工业用盐亚硝酸钠(NaNO2)外观与食盐相似,有毒,易致癌。
NaCl + AgNO3 = AgCl↓ + NaNO3
3.食盐的化学性质
2NaCl + 2H2O === 2NaOH + H2↑ + Cl2↑
通电
5.氯化钠有哪些主要用途?
①作调味品(日常每人每天约3---5g以
维持正常生理活动)
②做食品防腐剂
③医疗上制作生理盐水(0.9% NaCl溶液)
④农业选种(16% NaCl溶液)
⑤作工业原料,用于生产氯气、烧碱等;
⑥作除雪剂(降低雪的凝固点/冰点)
4.粗盐制取方法:一般采用蒸发溶剂法。
6.生活中的常用调味品——食盐的存在
食盐的化学名称叫氯化钠,它在地球上的储量很丰富,海洋中的氯化钠含量约占海水中各种盐类总量的20%,达10120万亿吨;它也占河水入海盐类的20%,可达54600万吨。氯化钠可从矿物(岩盐、卤水)直接开采。或从海水和盐湖中晒制出来,作为工农业原料与加工成食用盐。氯化钠有1万多种用途,其中95%是用于工农业,尤其是没有盐就没有化学工业。化工厂制取苛性钠、盐酸、氯气、纯碱、硫酸钠、杀虫剂和漂白扮等;染料厂制染科;印染厂与洗染店的助染剂;制高级玻璃与香皂的澄清剂;制药工业制抗生素、解热药和环胺剂等;制塑料、纸、油漆、合成橡胶、化妆品、电池、电石等;保存皮革、冰、腌制鱼、内、蔬菜以及农业选种等都需要盐。但是工业用盐的80%是在软化硬水中用于还原再生阳离子交换树脂和磺化媒。在消耗的食盐中,除一小部分换成别的物质外,绝大部分随工农业废水与生活污水渗入地下、排入河湖中,再注入海洋。
你知道吗?
在古罗马表示富有与贫穷,不看拥有黄金的多少,而是比藏有盐粒的数量,被历史上称为食盐货币时代。
我国的西藏过去也使用过盐巴货币。为了换取生活必需的一小块盐巴,需要付出昂贵的代价。贵州解放前只有少数人家吃得起吊盐(吃完饭以后,用舌头在吊挂着的盐块上舔一下)可见食盐的贵重。
日常生活中常用食盐水清洗伤口,你知道这是为什么吗?
因为浓的食盐溶液会使细胞内的水渗出,使蛋白质凝固,所以具有杀菌作用。
1、某10岁少年因食用非法私制的食盐而中毒殒命。
2、某女大学生一口气吃了十多根火腿肠,出现休克现象。经
医院抢救后脱险。
我们购买食盐一定要注意,不能买工业用的盐!
原因是NaNO2
新闻事件两则
亚硝酸钠
? 亚硝酸钠是工业用盐,它是一种白色不透明晶体,形状很像食盐,有咸味,其水溶液呈碱性。亚硝酸盐不仅是致癌物质,而且摄入0.2~0.5 g即可引起食物中毒,3 g可致死。而亚硝酸盐是食品添加剂的一种,起着色、防腐作用,广泛用于熟肉类、灌肠类和罐头等动物性食品。现在世界各国仍允许用它来腌制肉类,但用量严加限制。
俗称纯碱,又叫苏打。有天然的,也有化学方法生产的。
二.碳酸钠(Na2CO3)
1.物理性质:白色粉末状固体,易溶于水,溶解时放热。
制取方法:联合制碱法(侯德榜简介)
3.用途:重要的化工原料,广泛用于生产玻璃、造纸、纺织和日用化学工业。
2.化学性质:
1)水溶液能使无色酚酞变红色。(其水溶液呈碱性,故称纯碱)
2)Na2CO3+2HCl==2NaCl+H2O+CO2↑
3) Na2CO3+Ca(OH)2==CaCO3↓+2NaOH
我国著名的化学家侯德榜(1890-1974),在改进纯碱(Na2CO3)的生产方面曾作出了杰出的贡献。在二十世纪二十年代,他成功的改进了生产纯碱的方法,发明了联合制碱法(又称侯氏制碱法),打破了帝国主义对制碱技术的垄断,是我国制碱工业的先驱和奠基人。
侯德榜被称为“国宝”。 侯德榜一生在化工技术上有三大贡献。第一,揭开了苏尔维法的秘密。第二,创立了中国人自己的制碱工艺——侯氏制碱法。第三,就是他为发展小化肥工业所做的贡献。
附:候德榜联合制纯碱原理
① NH3+CO2+H2O=NH4HCO3
② NH4HCO3 +NaCl=NH4Cl+ NaHCO3↓
③ 2NaHCO3△Na2CO3? +CO2↑+H2O
三酸:硫酸、盐酸、硝酸
你知道“三酸两碱”指的是哪些物质吗?
两碱:烧碱、纯碱
注意:纯碱不是碱,而是盐
一个国家酸碱盐的产量,在一定程度上反映了
化学工业的发展水平。
三.碳酸氢钠(NaHCO3) 俗称小苏打
1.物理性质:白色粉末状固体。
3.用途:焙制糕点所用的发酵粉主要成分之一,也是治疗胃酸过多的药物。
2.化学性质:
1)NaHCO3 + HCl == NaCl + H2O + CO2↑(治疗胃酸过多)2) 2NaHCO3 == Na2CO3 + H2O + CO2↑
(此反应用于鉴别NaHCO3与Na2CO3 )
石灰石的主要成分。自然界中的大理石、方解石、白垩、蛋壳、贝壳和珍珠豆含有碳酸钙;锅炉和水壶的水垢主要成分也是碳酸钙。
4.碳酸钙(CaCO3)
物理性质:白色粉末状固体。
用途:重要的建筑材料,生产生石灰、水泥、玻璃以及炼铁,也是一种补钙剂。
化学性质:
CaCO3+2HCl====CaCO3+H2O+CO2↑
主要成分是
钟乳石
大理石
贝壳
珍珠
鸡蛋壳
锅炉里的水垢
水壶里的水垢
水垢
我们是石灰岩地区
到处都有石灰石
石灰石经过长期的地质作用,可以变成大理石(因盛产于云南大理而得名)
一般为白色,有得带有美丽的花纹
质地坚硬、颜色洁白的细粒大理石俗称汉白石,上等建筑材料
北京天安门前的华表
圆明园
人民英雄纪念碑浮雕群
让我们做一个简单的实验:P56
1、取一小块片状石灰石(或贝壳、蛋壳)仔细观察,看看是否容易捏碎、敲碎。
2、用坩埚钳夹持石灰石,放在酒精灯或煤气灯的外焰灼烧几分钟,放在石棉网冷看看是否容易捏碎、敲碎。
3、将另一片石灰石灼烧几分钟,却然后把它投入盛有冷水的小烧杯内,可以看到什么现象?
静置后,取出少量上层澄清的液体置于两支试管中,向一支试管中加入2滴酚酞试液,向另一支试管中的液体吹气,观察现象。
4、将你观察到的结果记录下来,尝试用化学、物理知识作解释,并与同学们进行交流
不易捏碎、敲碎。
易捏碎、敲碎。
跟冷水反应放出热
滴有酚酞的变红色;吹气澄清液体变浑浊
圆明园全景
圆明园大水法遗址
都说坚如磐石,为什么那些美丽的汉白玉经过大火的焚烧就粉碎坍塌了呢?
明代的《天工开物》
烧石灰图
石灰石、大理石经过高温灼烧,其中的碳酸钙会转变成疏松的氧化钙和二氧化碳。
人们习惯上把氧化钙称为生石灰。上述过程可以简要地表示如下:
CaCO3===CaO+CO2↑
高温
除石灰石以外,用白垩等含碳酸钙的矿物、贝壳等也可以制取生石灰。
氧化钙:俗称生石灰
1.性质:白色固体;与水反应
2.用途:①做食品干燥剂:强烈的吸水性(但不可用于干燥酸性气体)
②加热食品(一拉热):与水反应放热
③建筑材料
CaO +H2O===Ca(OH)2 放热
生石灰 熟石灰
氢氧化钙:俗称熟石灰,消石灰
1.性质:白色固体,微溶于水,形成的溶液
即澄清石灰水.形成的浆即石灰浆.
2.用途:建筑材料(原理用化学方程式表示),
改良酸性土壤,配制农药波尔多液。
Ca(OH)2+CO2==CaCO3↓+H2O
千锤万凿出深山,
烈火焚烧若等闲。
粉身碎骨浑不怕,
要留清白在人间。
赏古诗
《石灰吟》
于谦
石灰吟
于谦
千锤万凿出深山,
烈火焚烧若等闲。
粉身碎骨浑不怕,
要留清白在人间。
思考、你能用化学知识解释《石灰吟》这首诗吗?
1、石灰石、生石灰、熟石灰之间可以相互转化,请用化学方程式表示下图中的3个化学反应。
石灰石
(碳酸钙)
生石灰
熟石灰
(1)
(2)
(3)
(2) CaO+H2O = Ca(OH)2
(氧化钙)
(氢氧化钙)
(3)Ca(OH)2+CO2=CaCO3↓+H2O
2、存放石灰水的试剂瓶壁经常会有一种白色固体,它是怎样形成的?如何将它除去?在家中,水瓶内壁出现水垢怎样清洗?
白色固体是空气中的二氧化碳和氢氧化钙反应生成的碳酸钙,可以先用稀盐酸溶解,再用水清洗。在家中,可用醋来清洗水瓶内壁的水垢。
下面我们进行如下的实验,并把实验现象记录,再分析一下这些物质的组成。看看可以得到什么结论?
常用的纯碱是碳酸钠
Na2CO3
草木灰中含有碳酸钾
K2CO3
农业上使用的化肥碳铵
NH4HCO3
都有气泡产生,还可以使澄清石灰水变浑浊
都有二氧化碳生成
物质的名称
与化学式 加入盐酸
后的现象 结论
都含有碳酸根
CO3
统 称
碳酸盐
碳 酸 钠:
碳 酸 钾:
碳 酸 钙:
碳酸氢铵:
Na2 CO3
K2 CO3
Ca CO3
NH4H CO3
碳酸盐的化学性质:能与酸(如稀盐酸)反应,产生二氧化碳。
它们都含有碳酸根,我们称之为碳酸盐
从化学式看它们的组成都有相同的什么?
检验碳酸盐的方法:
向样品中加入稀盐酸,有能使澄清石灰水变浑浊的气体生成。
5.硫酸铜(CuSO4)
白色固体,能溶于水,水溶液呈蓝色,常利用硫酸铜的这一特性,即遇水变蓝来检验水的存在。
硫酸铜有毒,常用它和熟石灰配制农药波尔多液。
CuSO4+Ca(OH)2====Cu(OH)2↓+CaSO4
“庄稼一枝花,全靠肥当家
三、化学肥料
农作物生长需要哪些营养元素呢?
一、化肥:即化学肥料,通过化学加工生产的(含有农作物生长所需营养元素)肥料。
氮(N)、 磷(P)、 钾(K)
生活链接
农业上常用的化肥
1.氮肥
尿素: CO(NH2)2
氨水: NH3·H2O
铵盐: NH4HCO3、NH4Cl 、 (NH4)2SO4
硝酸盐:NH4NO3、NaNO3
二、化学肥料的分类及作用
氮肥的分类
氨水
有机氮肥:尿素
铵态氮肥:碳酸氢铵
硝态氮肥 :硝酸钠
1.氮肥
氮肥的作用:
氮肥能促使植物的茎、叶生长茂盛,叶色浓绿。
常见的磷肥:
磷矿粉:Ca3(PO4)2
钙镁磷肥:钙和镁的磷酸盐
重过磷酸钙Ca(H2PO4)2
过磷酸钙:Ca(H2PO4)2+CaSO4
混合物
2.磷肥
2.磷肥
磷肥的作用:促进作物根系发达,促进作物提早成熟,使之穗粒增多,籽粒饱满,还可增强抗寒、抗旱能力。
作物缺磷的表现:生长迟缓、产量降低。
钾肥的作用:可促进作物生长健壮,茎秆粗壮、 增强抗病虫害和抗倒伏能力等功能。
3.钾肥
作物缺钾的症状:
茎秆软弱,抗病能力低,易倒伏,叶尖及叶缘发黄。
常见的钾肥:硫酸钾(K2SO4)、氯化钾(KCl)
K2CO3 ( 草木灰的主要成份 )
复合化肥:含两种或两种以上营养元素的化肥。
如:
磷酸二氢铵(NH4H2PO4)、
磷酸氢二铵 (NH4)2HPO4、硝酸钾(KNO3)
复合肥料
分类
钾肥(含K)
氮肥
(含N)
磷肥
(含P)
复合
肥料
能促进作物生长健壮,茎秆粗硬,增强对病虫害和
倒伏的抵抗能力,并能促进糖分和淀粉的生成 K2SO4
能促进作物根系发达,增强抗寒抗旱能力,还能促进作物提早成熟,穗粒增多,籽粒饱满 Ca3(PO4)2
能促使作物的茎、叶生长茂盛,叶色浓绿
氨气、NH4HCO3、 (NH4)2SO4、 CO(NH2)2
含有两种或两种以上营养元素的化肥
KNO3、 NH4H2PO4
化学肥料大部分属于酸、碱、盐中的哪一类呢?
空气中78%都是氮气,能不能直接被植物体利用吸收呢?
空气中各成分的百分比
氮气 78%
氧气 21%
稀有气体 0.94%
二氧化碳 0.03%
其它 0.03%
根瘤菌的固氮
延伸与拓展
因此,要化肥与农家肥配合使用,促进农作物增产。
化学肥料 农家肥料
所含营养元素种类少,但营养元素的含量大 常含多种营养元素,营养元素含量较少
一般易溶于水,易于被作物吸收,肥效较快 一般较难溶于水,经腐熟后逐步转化为可溶于水、能被作物吸收的物质,肥效较慢但较长
便于工业生产,成本较高 便于就地取材,成本低廉
有些品种化肥如长期大量施用能使土壤板结 能改良土壤结构
三、化肥的利与弊
三、化肥的利与弊[来源:Zxxk.Com]
四、常见化肥的鉴别
延伸与拓展
常见的方法:看色、闻味、溶水
氮肥(N) 磷肥(P) 钾肥(K)
碳酸氢铵 氯化铵 磷矿粉 过磷酸钙 硫酸钾 氯化钾
外观
气味
溶解性
在农业生产中经常使用铵态氮肥,在实验室里可以
用简单的方法检验铵态氮肥。
(实验一):把少量的硫酸铵放在研钵中,再加入一
些熟石灰,用研杵混合研磨,小心闻混合物的气味。
(实验二):把少量的硫酸铵放在试管中,加入3ml氢
氧化钠溶液,在酒精灯上微热,把湿润的红色石蕊试
纸放在试管口,观察试纸颜色变化。
在农业生产中经常使用铵态氮肥,在实验室里可以
用简单的方法检验铵态氮肥。
(实验一):把少量的硫酸铵放在研钵中,再加入一
些熟石灰,用研杵混合研磨,小心闻混合物的气味。
现象:有刺激性气味放出
化学方程式:
(NH4)2SO4+Ca(OH)2=CaSO4+2H2O+2NH3↑
在农业生产中经常使用铵态氮肥,在实验室里可以
用简单的方法检验铵态氮肥。
(实验二):把少量的硫酸铵放在试管中,加入3ml氢
氧化钠溶液,在酒精灯上微热,把湿润的红色石蕊试
纸放在试管口,观察试纸颜色变化。
现象:加热后,看到湿润的红色石蕊试纸变蓝
化学方程式:
(NH4)2SO4+2NaOH = Na2SO4+2H2O+2NH3↑
△
常见化肥的鉴别
小结——铵盐(NH4+)检验方法:
加碱研磨,闻是否有刺鼻的氨味
加熟石灰
请同学完成以下四种化肥的检验
2NH4CI+Ca(OH)2=CaCI2+2H2O+2NH3↑
放出有刺激性
气味的氨气
放出有刺激性
气味的氨气
无有刺激性
气味气体生成
无有刺激性
气味气体生成
加碱
氮肥(N) 钾肥(K)
硫酸铵 氯化铵 硫酸钾 氯化钾
加熟石灰
研磨(搅拌)
化肥的使用:
不能滥用,要根据土壤特点和作物生长需要合理利用化肥。
对同一块土地不能长期用一种化肥,否则会破坏土壤结构,要将化肥与农家肥交替使用。
使用铵态氮肥时,避免与草木灰(K2CO3)、熟石灰(Ca(OH)2)等碱性物质混用,否则会降低肥效。
(1)污染水体:使水中N、P含量升高,富营养化
(2)污染大气:有NH3等不良气体放出
(3)破坏土壤:使土壤酸化、板结
使用化肥与环境的关系
化肥是植物的粮食,是提高农业生产的物质基础,合理施用化肥对提高单位面积产量和不断提高土壤肥力均起着重要的作用。但不合理施用也会带来危害,对环境造成污染。化肥的不合理施用会造成:
【例2】 下列化肥属于复合肥料的是:( )
A. NH4Cl B. NH4NO3 C. K2SO4 D. KNO3
【例1】下列物质可以直接做肥料施用的是( )
A.氢氧化钙 B.硝酸铵 C.氢氧化钾 D.硝酸
B
D
【例3】下列化肥不能与熟石灰混合施用的是( )
A.氯化钾 B.碳酸氢铵 C.磷酸钙 D .硝酸钾
B
A
【例4】某同学家中种植的植物比正常的植株矮小瘦弱,叶片发黄,严重 时叶脉呈淡棕色,你认为应该施加下列哪一种化肥:( )
A. KNO3 B. KCl C. Ca(H2PO4)2 D. CO(NH2)2
为鉴别(NH4)2CO3、(NH4)2SO4、KCl、K2SO4四种化肥,
某同学设计了如下所示的实验方案,请你根据每步实验现象将
有关化肥的化学式填写在下图相应的空格中。
有气体产生
无气体产生
有白色沉淀
无白色沉淀
(NH4)2CO3、(NH4)2SO4
KCl、K2SO4
(NH4)2CO3
(NH4)2SO4
K2SO4
KCl
【例5】
今天你学到了什么?[来源:学_科_网]
看色、闻味、溶水、加碱
