化工综合题解答方法
图片预览









文档简介
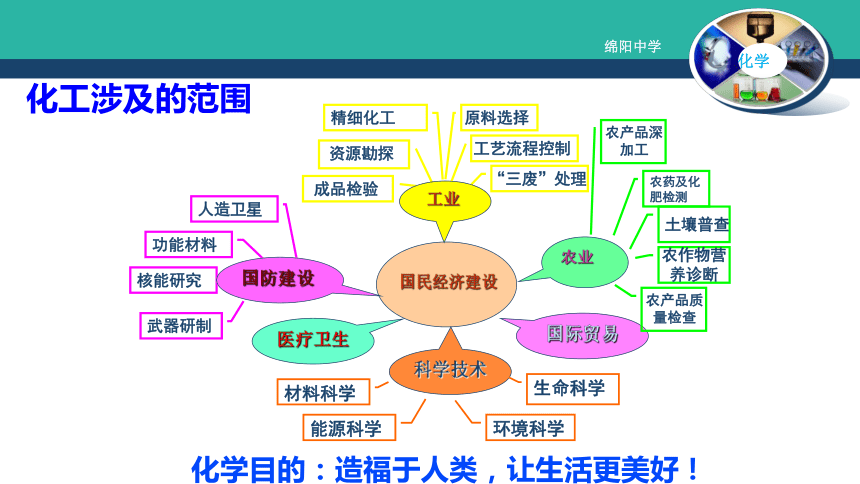
课件30张PPT。化工综合题解答方法农业国防建设科学技术国际贸易医疗卫生化工涉及的范围化学目的:造福于人类,让生活更美好!一、明确化工综合题的考点
原料预处理除杂、净化原料
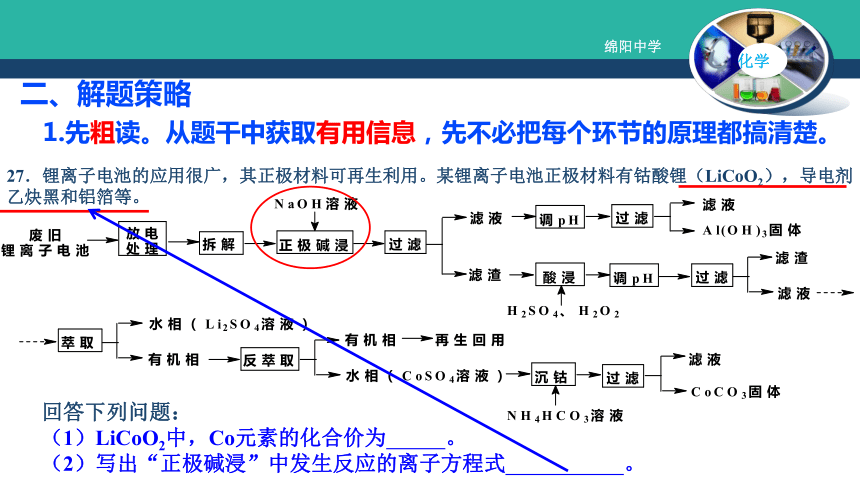
无机矿物 反应条件的控制化学核心反应所需产品产品的分离提纯陌生反应酸溶、碱溶、水溶氧化后调pH与Ksp 结合产率计算注重环保排放物的无害化处理母液的循环利用(生产效率)原料循环利用二、解题策略1.先粗读。从题干中获取有用信息,先不必把每个环节的原理都搞清楚。回答下列问题:
(1)LiCoO2中,Co元素的化合价为 。
(2)写出“正极碱浸”中发生反应的离子方程式 。27.锂离子电池的应用很广,其正极材料可再生利用。某锂离子电池正极材料有钴酸锂(LiCoO2),导电剂乙炔黑和铝箔等。27.锂离子电池的应用很广,其正极材料可再生利用。某锂离子电池正极材料有钴酸锂(LiCoO2),导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为6C+xLi++xe-=LixC6。现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出)。(5)充放电过程中,发生LiCoO2与Li1-xCoO2之间的转化,写出放电时电池反应方程式
(6)上述工艺中,“放电处理”有利于锂在正极的回收,其原因是 。2,针对问题再精读,分析细节,根据问题去研究某一步或某一种物质
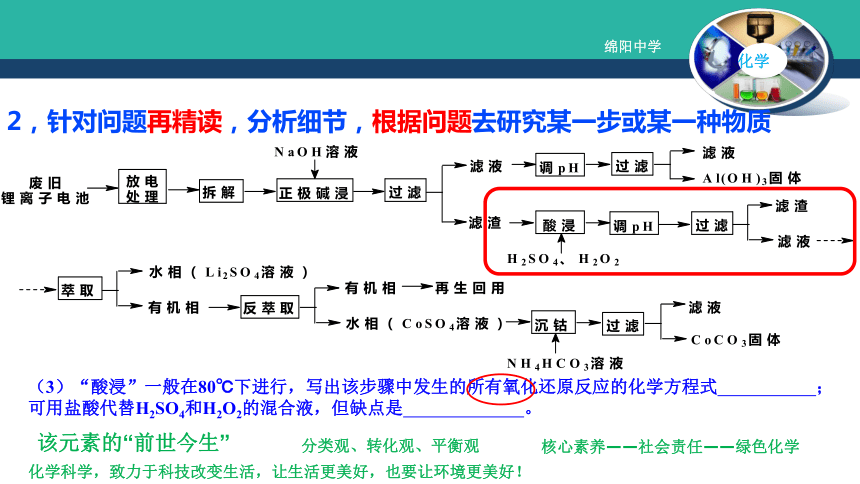
(3)“酸浸”一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式 ;
可用盐酸代替H2SO4和H2O2的混合液,但缺点是 。该元素的“前世今生”分类观、转化观、平衡观核心素养——社会责任——绿色化学化学科学,致力于科技改变生活,让生活更美好,也要让环境更美好! 3、看清问题,准确规范作答 (4)写出“沉钴”过程中发生反应的化学方程式 。
(6)上述工艺中,“放电处理”有利于锂在正极的回收,其原因是 。
在整个回收工艺中,可回收到的金属化合物有 (填化学式)。考纲研读
KAOGANGYANDU1.从试题提供的新信息中,准确地提取实质性内容,并经与已有知识块整合,重组为新知识块的能力。
2.将实际问题分解,通过运用相关知识,采用分析、综合的方法,解决简单化学问题的能力。
3.将分析和解决问题的过程及成果,用正确的化学术语及文字、图表、模型、图形等表达,并做出解释的能力。(2).情境 陌生的情境,高中的知识
流程、表格、图形图像等丰富的信息呈现形式(1).克服恐惧心理与畏难情绪战略上藐视——敢于面对
战术上重视——仔细分析、认真作答
(3).时间要求 二.解题策略(4).规范答题 直接看问题,带着问题回头找信息理清原理、熟记套路、结合题目情境作答 答题规范:理清原理、熟记套路、结合题目情境作答例:(2016江苏卷19)实验室以一种工业废渣(主要成分为MgCO3、MgSO4和少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下:(1)酸溶过程中主要反应的热化学方程式为
MgCO3(S)+2H+(aq)===2Mg2+(aq)+CO2(g)+H2O(l) ΔH= -50.4 kJ·mol-1
Mg2SiO4(s)+4H+(aq)===2Mg2+(aq)+H2SiO3(s)+H2O(l) ΔH= -225.4 kJ·mol-1
酸溶需加热的目的是 ; 改编一下设问:废渣粉碎的目的是: ;加快反应速率万金油式的答题,要纠正!如:尾气处理“增大接触面积,加快化学反应速率,提高原料转化率”————套路优化答案:增加接触面积,加快酸溶速率,提高镁的浸出率“加快酸溶速率”——优化答案根据流程图回答下列问题:
(1)“煅烧”的目的是__________________________。改变高岭土中氧化铝的结构,使其能溶于酸。 酸浸(酸洗)——除氧化膜;使可溶性金属离子进入溶液;水浸(水洗)——与水接触反应或溶解;除去水溶性杂质;(2)粉碎(研磨)——增大表面积,加快反应速率,提高原料的利用率、转化率;(3)煅烧(灼烧)——改变结构,使物质能溶解; 使杂质高温下氧化、分解。 碱浸(碱洗)——除去油污或氧化膜,溶解铝、氧化铝、二氧化硅等;1.原料的预处理(1)溶解:浸出率:固体溶解后,离子在溶液中的含量的多少(更多转化)三.熟记基本化工知识 2.反应条件的控制加热——加快反应速率,加速固体溶解,平衡向吸热方向移动 降温
(冰水中)——减少物质在高温时溶解;使化学反应速率下降;
使化学平衡向放热方向移动; 控温——温度过低,化学反应速率慢
温度过高,物质挥发或者反应或者分解;催化剂的活性 趁热过滤——防止某物质降温时会析出晶体; 冰水洗涤——洗去晶体表面的杂质离子,并减少晶体在洗涤过
程中的溶解损耗;酸性氛围——抑制水解; pH值的控制——控制溶液酸碱性使某些金属离子形成氢氧化物沉淀 酒精或无水乙醇洗涤——减少洗涤溶液损耗、防水解、易快速干燥控温一:反应条件分析思路化学热力学化学反应的方向化学反应的限度化学平衡的移动化学动力学化学反应速率温度对反应速率的影响,
特别关注:温度对催化剂活性的影响平衡转化率等副反应的发生反应物、生成物的挥发与分解控温一:反应条件
白云石的主要成份是CaCO3·MgCO3,在我国有大量的分布。以白云石为原料生产的钙镁系列产品有广泛的用途。白云石经煅烧、熔化后得到钙镁的氢氧化物,再经过碳化实现Ca2+、Mg2+的分离。碳化反应是放热反应,化学方程式如下:Ca(OH)2 + Mg(OH)2 + 3CO2 ? CaCO3 + Mg(HCO3)2 + H2O
完成下列填空
24.碳化温度保持在50~60℃。
温度偏高不利于碳化反应,原因是 、 。
温度偏低也不利于碳化反应,原因是 。平衡逆向移动 Mg(HCO3)2分解;反应速率慢。控温一:反应条件未平衡时转化率变化考虑速率因素平衡时转化率变化考虑平衡移动转化率非可逆反应可逆反应转化率变化考虑速率因素乙苯催化脱氢制苯乙烯反应:工业上,通常在乙苯蒸汽中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1︰9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:②控制反应温度为600℃的理由是________。温度过高,选择性下降。
高温还可能是催化剂失活;高温能耗大。600℃,乙苯的转化率和苯乙烯的选择性均较高。温度过低,反应速率慢,转化率低;3.物质的分离与提纯控温二:结晶条件蒸发浓缩、冷却结晶蒸发结晶、趁热过滤冰水洗涤、热水洗涤 、乙醇或乙醚洗涤结晶过滤洗涤干燥熟记典例,建立思维模型KNO3(NaCl)NaCl(KNO3)控温二:结晶条件控温二:结晶条件蒸发浓缩、冷却至10℃以下结晶控温二:结晶条件19.柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反应制备:FeSO4+Na2CO3=== FeCO3↓+Na2SO4 FeCO3+C6H8O7 === FeC6H6O7+CO2↑+H2O
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。(5)过滤,向反应液中加入足量的铁粉,充分搅拌后,滴加NaOH溶液调节反应液的pH约为5,过滤。
或过滤,向滤液中滴加过量的NaOH溶液,过滤,充分洗涤固体,向固体中加入足量稀硫酸至固体完全溶解,再加入足量的铁粉,充分搅拌后,过滤。
(滴加稀硫酸酸化)加热浓缩得到60℃饱和溶液 冷却至0℃结晶,过滤,少量冰水洗涤,低温干燥
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3 ) 出发,先制备绿矾,再合成柠檬酸亚铁。请结合右图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备FeSO4·7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应, ,得到FeSO4 溶液, ,得到FeSO4·7H2O 晶体。
提出新问题:利用海水制备MgCl2·6H2O晶体加入盐酸蒸发浓缩,冷却结晶、过滤、洗涤、干燥重基础海水提镁根据溶解度控温结晶,已多次考察,而结晶的过程中,抑制水解也是一个重要因素,考察较少。预处理循环利用浓缩与结晶提出新问题:利用海水制备MgCl2·6H2O晶体MgCl2溶液MgCl2·6H2O晶体原料:就地取材,来源广泛
3.核心反应——陌生方程式的书写
看清要求:化学反应、离子反应方程式
结合环境酸碱性等具体信息关注箭头的指向:箭头指入→反应物,箭头指出→生成物。
(1)氧化还原反应:熟练应用氧化还原规律,①判断产物,②配平。
(2)非氧化还原反应:结合物质性质和反应实际判断产物。近几年高考核心反应方程式的书写(重点、难点)4.基本化工理念——绿色化学绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对环境的污染。“原子经济”就是反应物的原子全部转化为期望的最终产物,原子利用率为100%。原子经济性反应
高选择性反应安全的生产工艺反应过程提高能源利用率反应物反应产物五毒、无害原料
可再生资源环境友好产品(安全、能降解、可再利用)应用无毒、无害的催化剂应用无毒、无害的溶剂5.基本化工理念——生产实际产率高、速率快
产品纯度高
成本低、循环利用
无污染多快好省侯德榜 光辉的成就永利制碱工厂定址天津塘沽,沿海而建在知乎上被提问:
《毛泽东时期,中国工业有没有成就能比肩民国时期联合制碱法为世界带来的贡献?》侯德榜 为什么侯德榜能取得如此光辉的成就?活泼可爱的孩子们小试身手例“分子筛”是一种具有多孔结构的铝硅酸盐(NaAlSiO4·nH2O),其中有许多笼状孔穴和通道能让直径比孔穴小的分子通过而将大的分子留在外面,故此得名。利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备“分子筛”的一种工艺如下:(1)分子筛的孔道直径为4A称为4A型分子筛;当Na+被Ca2+取代时就制得5A型分子筛,当Na+被K+取代时就制得3A型分子筛。要高效分离正丁烷(分子直径为4.65A)和异丁烷(分子直径为5.6A)应选用________型的分子筛。
(2)铝灰在90 ℃时水解的化学方程式为____________________;“水解”采用90 ℃而不在室温下进行的原因是__________________________。
(3)“酸溶”时,为降低生产成本,应选择的酸为__________,理由是_____________。
(4)“氧化”时,发生的主要反应的离子方程式为____________________________。
(5)该工艺中滤渣的成分是________。
(6)“胶体”调节pH后过滤所得“晶体”需洗涤,如何证明该晶体已经洗涤干净?_________________。
原料预处理除杂、净化原料
无机矿物 反应条件的控制化学核心反应所需产品产品的分离提纯陌生反应酸溶、碱溶、水溶氧化后调pH与Ksp 结合产率计算注重环保排放物的无害化处理母液的循环利用(生产效率)原料循环利用二、解题策略1.先粗读。从题干中获取有用信息,先不必把每个环节的原理都搞清楚。回答下列问题:
(1)LiCoO2中,Co元素的化合价为 。
(2)写出“正极碱浸”中发生反应的离子方程式 。27.锂离子电池的应用很广,其正极材料可再生利用。某锂离子电池正极材料有钴酸锂(LiCoO2),导电剂乙炔黑和铝箔等。27.锂离子电池的应用很广,其正极材料可再生利用。某锂离子电池正极材料有钴酸锂(LiCoO2),导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为6C+xLi++xe-=LixC6。现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出)。(5)充放电过程中,发生LiCoO2与Li1-xCoO2之间的转化,写出放电时电池反应方程式
(6)上述工艺中,“放电处理”有利于锂在正极的回收,其原因是 。2,针对问题再精读,分析细节,根据问题去研究某一步或某一种物质
(3)“酸浸”一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式 ;
可用盐酸代替H2SO4和H2O2的混合液,但缺点是 。该元素的“前世今生”分类观、转化观、平衡观核心素养——社会责任——绿色化学化学科学,致力于科技改变生活,让生活更美好,也要让环境更美好! 3、看清问题,准确规范作答 (4)写出“沉钴”过程中发生反应的化学方程式 。
(6)上述工艺中,“放电处理”有利于锂在正极的回收,其原因是 。
在整个回收工艺中,可回收到的金属化合物有 (填化学式)。考纲研读
KAOGANGYANDU1.从试题提供的新信息中,准确地提取实质性内容,并经与已有知识块整合,重组为新知识块的能力。
2.将实际问题分解,通过运用相关知识,采用分析、综合的方法,解决简单化学问题的能力。
3.将分析和解决问题的过程及成果,用正确的化学术语及文字、图表、模型、图形等表达,并做出解释的能力。(2).情境 陌生的情境,高中的知识
流程、表格、图形图像等丰富的信息呈现形式(1).克服恐惧心理与畏难情绪战略上藐视——敢于面对
战术上重视——仔细分析、认真作答
(3).时间要求 二.解题策略(4).规范答题 直接看问题,带着问题回头找信息理清原理、熟记套路、结合题目情境作答 答题规范:理清原理、熟记套路、结合题目情境作答例:(2016江苏卷19)实验室以一种工业废渣(主要成分为MgCO3、MgSO4和少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下:(1)酸溶过程中主要反应的热化学方程式为
MgCO3(S)+2H+(aq)===2Mg2+(aq)+CO2(g)+H2O(l) ΔH= -50.4 kJ·mol-1
Mg2SiO4(s)+4H+(aq)===2Mg2+(aq)+H2SiO3(s)+H2O(l) ΔH= -225.4 kJ·mol-1
酸溶需加热的目的是 ; 改编一下设问:废渣粉碎的目的是: ;加快反应速率万金油式的答题,要纠正!如:尾气处理“增大接触面积,加快化学反应速率,提高原料转化率”————套路优化答案:增加接触面积,加快酸溶速率,提高镁的浸出率“加快酸溶速率”——优化答案根据流程图回答下列问题:
(1)“煅烧”的目的是__________________________。改变高岭土中氧化铝的结构,使其能溶于酸。 酸浸(酸洗)——除氧化膜;使可溶性金属离子进入溶液;水浸(水洗)——与水接触反应或溶解;除去水溶性杂质;(2)粉碎(研磨)——增大表面积,加快反应速率,提高原料的利用率、转化率;(3)煅烧(灼烧)——改变结构,使物质能溶解; 使杂质高温下氧化、分解。 碱浸(碱洗)——除去油污或氧化膜,溶解铝、氧化铝、二氧化硅等;1.原料的预处理(1)溶解:浸出率:固体溶解后,离子在溶液中的含量的多少(更多转化)三.熟记基本化工知识 2.反应条件的控制加热——加快反应速率,加速固体溶解,平衡向吸热方向移动 降温
(冰水中)——减少物质在高温时溶解;使化学反应速率下降;
使化学平衡向放热方向移动; 控温——温度过低,化学反应速率慢
温度过高,物质挥发或者反应或者分解;催化剂的活性 趁热过滤——防止某物质降温时会析出晶体; 冰水洗涤——洗去晶体表面的杂质离子,并减少晶体在洗涤过
程中的溶解损耗;酸性氛围——抑制水解; pH值的控制——控制溶液酸碱性使某些金属离子形成氢氧化物沉淀 酒精或无水乙醇洗涤——减少洗涤溶液损耗、防水解、易快速干燥控温一:反应条件分析思路化学热力学化学反应的方向化学反应的限度化学平衡的移动化学动力学化学反应速率温度对反应速率的影响,
特别关注:温度对催化剂活性的影响平衡转化率等副反应的发生反应物、生成物的挥发与分解控温一:反应条件
白云石的主要成份是CaCO3·MgCO3,在我国有大量的分布。以白云石为原料生产的钙镁系列产品有广泛的用途。白云石经煅烧、熔化后得到钙镁的氢氧化物,再经过碳化实现Ca2+、Mg2+的分离。碳化反应是放热反应,化学方程式如下:Ca(OH)2 + Mg(OH)2 + 3CO2 ? CaCO3 + Mg(HCO3)2 + H2O
完成下列填空
24.碳化温度保持在50~60℃。
温度偏高不利于碳化反应,原因是 、 。
温度偏低也不利于碳化反应,原因是 。平衡逆向移动 Mg(HCO3)2分解;反应速率慢。控温一:反应条件未平衡时转化率变化考虑速率因素平衡时转化率变化考虑平衡移动转化率非可逆反应可逆反应转化率变化考虑速率因素乙苯催化脱氢制苯乙烯反应:工业上,通常在乙苯蒸汽中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1︰9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:②控制反应温度为600℃的理由是________。温度过高,选择性下降。
高温还可能是催化剂失活;高温能耗大。600℃,乙苯的转化率和苯乙烯的选择性均较高。温度过低,反应速率慢,转化率低;3.物质的分离与提纯控温二:结晶条件蒸发浓缩、冷却结晶蒸发结晶、趁热过滤冰水洗涤、热水洗涤 、乙醇或乙醚洗涤结晶过滤洗涤干燥熟记典例,建立思维模型KNO3(NaCl)NaCl(KNO3)控温二:结晶条件控温二:结晶条件蒸发浓缩、冷却至10℃以下结晶控温二:结晶条件19.柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反应制备:FeSO4+Na2CO3=== FeCO3↓+Na2SO4 FeCO3+C6H8O7 === FeC6H6O7+CO2↑+H2O
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。(5)过滤,向反应液中加入足量的铁粉,充分搅拌后,滴加NaOH溶液调节反应液的pH约为5,过滤。
或过滤,向滤液中滴加过量的NaOH溶液,过滤,充分洗涤固体,向固体中加入足量稀硫酸至固体完全溶解,再加入足量的铁粉,充分搅拌后,过滤。
(滴加稀硫酸酸化)加热浓缩得到60℃饱和溶液 冷却至0℃结晶,过滤,少量冰水洗涤,低温干燥
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3 ) 出发,先制备绿矾,再合成柠檬酸亚铁。请结合右图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备FeSO4·7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应, ,得到FeSO4 溶液, ,得到FeSO4·7H2O 晶体。
提出新问题:利用海水制备MgCl2·6H2O晶体加入盐酸蒸发浓缩,冷却结晶、过滤、洗涤、干燥重基础海水提镁根据溶解度控温结晶,已多次考察,而结晶的过程中,抑制水解也是一个重要因素,考察较少。预处理循环利用浓缩与结晶提出新问题:利用海水制备MgCl2·6H2O晶体MgCl2溶液MgCl2·6H2O晶体原料:就地取材,来源广泛
3.核心反应——陌生方程式的书写
看清要求:化学反应、离子反应方程式
结合环境酸碱性等具体信息关注箭头的指向:箭头指入→反应物,箭头指出→生成物。
(1)氧化还原反应:熟练应用氧化还原规律,①判断产物,②配平。
(2)非氧化还原反应:结合物质性质和反应实际判断产物。近几年高考核心反应方程式的书写(重点、难点)4.基本化工理念——绿色化学绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对环境的污染。“原子经济”就是反应物的原子全部转化为期望的最终产物,原子利用率为100%。原子经济性反应
高选择性反应安全的生产工艺反应过程提高能源利用率反应物反应产物五毒、无害原料
可再生资源环境友好产品(安全、能降解、可再利用)应用无毒、无害的催化剂应用无毒、无害的溶剂5.基本化工理念——生产实际产率高、速率快
产品纯度高
成本低、循环利用
无污染多快好省侯德榜 光辉的成就永利制碱工厂定址天津塘沽,沿海而建在知乎上被提问:
《毛泽东时期,中国工业有没有成就能比肩民国时期联合制碱法为世界带来的贡献?》侯德榜 为什么侯德榜能取得如此光辉的成就?活泼可爱的孩子们小试身手例“分子筛”是一种具有多孔结构的铝硅酸盐(NaAlSiO4·nH2O),其中有许多笼状孔穴和通道能让直径比孔穴小的分子通过而将大的分子留在外面,故此得名。利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备“分子筛”的一种工艺如下:(1)分子筛的孔道直径为4A称为4A型分子筛;当Na+被Ca2+取代时就制得5A型分子筛,当Na+被K+取代时就制得3A型分子筛。要高效分离正丁烷(分子直径为4.65A)和异丁烷(分子直径为5.6A)应选用________型的分子筛。
(2)铝灰在90 ℃时水解的化学方程式为____________________;“水解”采用90 ℃而不在室温下进行的原因是__________________________。
(3)“酸溶”时,为降低生产成本,应选择的酸为__________,理由是_____________。
(4)“氧化”时,发生的主要反应的离子方程式为____________________________。
(5)该工艺中滤渣的成分是________。
(6)“胶体”调节pH后过滤所得“晶体”需洗涤,如何证明该晶体已经洗涤干净?_________________。
