沪教化学下册第7章基础实验8 酸、碱的化学性质(共20张PPT)
文档属性
| 名称 | 沪教化学下册第7章基础实验8 酸、碱的化学性质(共20张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-01 00:00:00 | ||
图片预览








文档简介
课件20张PPT。酸、碱的化学性质1.加深对酸和碱的主要性质的认识
2.通过实验解释生活的一些现象。实验目的
试管、药匙、蒸发皿、玻璃棒、
稀盐酸、稀硫酸、稀氢氧化钠溶液、
氢氧化钙溶液、硫酸铜溶液、氢氧化钙粉末、石蕊溶液、酚酞溶液、pH试纸、生锈的铁钉实验用品
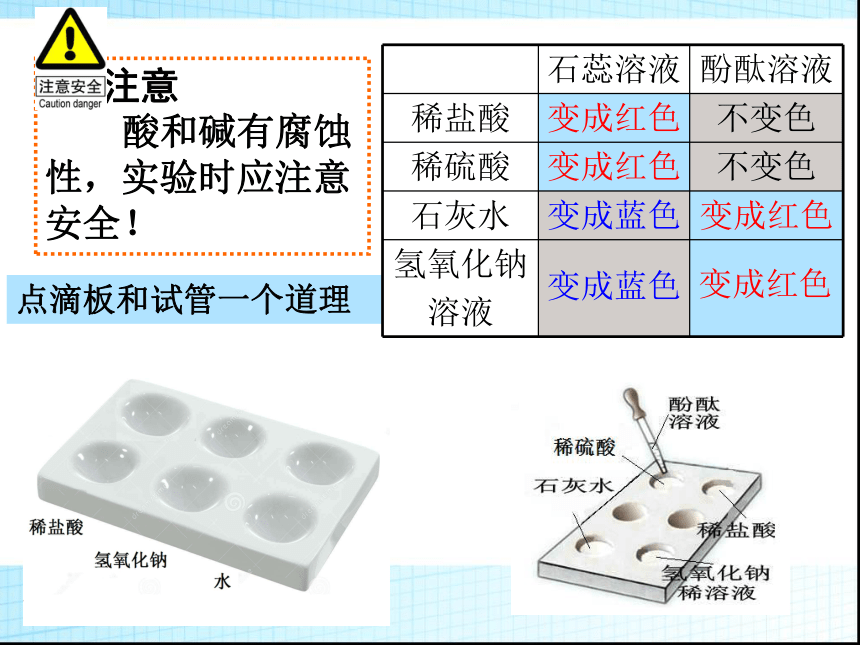
实验一: 酸和碱与指示剂的作用。实验步骤 注意
酸和碱有腐蚀
性,实验时应注意
安全!点滴板和试管一个道理变成蓝色变成红色
实验二: 酸和金属氧化物的反应。实验步骤2.取两支生锈的铁钉,大头朝下放入两支试管中,
然后加入2ml稀盐酸,使生锈的铁钉部分浸没在稀
盐酸里,观察现象。当铁钉表面变得光亮后,将
其中一支取出洗净。继续观察另一支,过一段时
间后,将铁钉取出,洗净。比较两支铁钉。①锈钉表面的铁锈逐渐消失变得
光亮,溶液变成黄色;
②当铁钉变得光亮后,可观察到
铁钉表面出现气泡。
Fe2O3+6HCl=2FeCl3+3H2O Fe+2HCl=FeCl2+H2↑ 实验步骤
实验三: 3.在试管中加
入约2mL硫酸铜溶
液,然后滴入几滴
氢氧化钠溶液,观
察现象。然后再向
试管中加入稀盐酸
观察现象。硫酸铜和氢氧化钠反应氢氧化钠和硫酸铜反应产生不溶于水的蓝色沉淀,氢氧化铜不溶于水,但可以溶于盐酸中
1中出现蓝色沉淀,溶液由蓝色变为无色
2中蓝色沉淀消失,溶液由无色变为蓝色2NaOH+CuSO4==Na2SO4+Cu(OH)2↓
Cu(OH)2+2HCl==CuCl2+2H2O填一填实验步骤
实验四: 4.在试管中加入约1ml氢氧化钠溶液,滴入几滴酚酞溶液。然后慢慢滴入稀盐酸,边不断振荡试管,至溶液颜色恰好变为无色为止。取该无色溶液约1ml,置于蒸发皿中加热,使液体蒸干,观察现象。实验步骤
实验四:①溶液呈红色;滴加稀盐酸,溶液变为无色。②蒸发皿出现白色固体。 HCl+NaOH=NaCl+H2O 5.向两支试管中各加入相同量的氢氧化钙
粉末(用药匙的柄把一端挑一点) ,然后各加入
1ml水,振荡;再各滴入1~2滴无色酚酞溶液,
观察现象。继续向其中一支试管中加入约1ml
水,振荡;向另一支试管中加入约1ml稀盐酸,
振荡;比较两支试管中的现象。实验步骤
实验五:通过实验五:
可以验证氢氧化钙的那些性质?①氢氧化钙不易溶于水,即微溶于水。②氢氧化钙溶液呈碱性,能使无色酚酞
溶液显示红色。③氢氧化钙粉末与稀盐酸反应,所得
溶液呈无色。小结实验一: 酸和碱与指示剂的作用。实验二: 酸和金属氧化物的反应。实验三:氢氧化钠与硫酸铜反应,
蓝色絮状沉淀与稀盐酸反应实验四:酸碱中和反应实验五:氢氧化钙的性质 2.小亮在做"盐酸中和氢氧化钠溶液“的实验时,滴加盐酸前忘了加入指示剂,导致无法判断该中和反应进行的程度。于是他对所得溶液的酸碱性进行探究:
〖探究目的〗探究所得溶液的酸碱性
〖提出猜想〗所得溶液可能呈碱性、也可能呈 性,还可能呈 性。
〖实验验证〗巩固练习〖 分析与思考〗:
若无色酚酞溶液不变色,为了进一步确定溶液的酸碱性,你能提出了哪些方案?满
载
而
归这节课你收获了什么?谢谢
2.通过实验解释生活的一些现象。实验目的
试管、药匙、蒸发皿、玻璃棒、
稀盐酸、稀硫酸、稀氢氧化钠溶液、
氢氧化钙溶液、硫酸铜溶液、氢氧化钙粉末、石蕊溶液、酚酞溶液、pH试纸、生锈的铁钉实验用品
实验一: 酸和碱与指示剂的作用。实验步骤 注意
酸和碱有腐蚀
性,实验时应注意
安全!点滴板和试管一个道理变成蓝色变成红色
实验二: 酸和金属氧化物的反应。实验步骤2.取两支生锈的铁钉,大头朝下放入两支试管中,
然后加入2ml稀盐酸,使生锈的铁钉部分浸没在稀
盐酸里,观察现象。当铁钉表面变得光亮后,将
其中一支取出洗净。继续观察另一支,过一段时
间后,将铁钉取出,洗净。比较两支铁钉。①锈钉表面的铁锈逐渐消失变得
光亮,溶液变成黄色;
②当铁钉变得光亮后,可观察到
铁钉表面出现气泡。
Fe2O3+6HCl=2FeCl3+3H2O Fe+2HCl=FeCl2+H2↑ 实验步骤
实验三: 3.在试管中加
入约2mL硫酸铜溶
液,然后滴入几滴
氢氧化钠溶液,观
察现象。然后再向
试管中加入稀盐酸
观察现象。硫酸铜和氢氧化钠反应氢氧化钠和硫酸铜反应产生不溶于水的蓝色沉淀,氢氧化铜不溶于水,但可以溶于盐酸中
1中出现蓝色沉淀,溶液由蓝色变为无色
2中蓝色沉淀消失,溶液由无色变为蓝色2NaOH+CuSO4==Na2SO4+Cu(OH)2↓
Cu(OH)2+2HCl==CuCl2+2H2O填一填实验步骤
实验四: 4.在试管中加入约1ml氢氧化钠溶液,滴入几滴酚酞溶液。然后慢慢滴入稀盐酸,边不断振荡试管,至溶液颜色恰好变为无色为止。取该无色溶液约1ml,置于蒸发皿中加热,使液体蒸干,观察现象。实验步骤
实验四:①溶液呈红色;滴加稀盐酸,溶液变为无色。②蒸发皿出现白色固体。 HCl+NaOH=NaCl+H2O 5.向两支试管中各加入相同量的氢氧化钙
粉末(用药匙的柄把一端挑一点) ,然后各加入
1ml水,振荡;再各滴入1~2滴无色酚酞溶液,
观察现象。继续向其中一支试管中加入约1ml
水,振荡;向另一支试管中加入约1ml稀盐酸,
振荡;比较两支试管中的现象。实验步骤
实验五:通过实验五:
可以验证氢氧化钙的那些性质?①氢氧化钙不易溶于水,即微溶于水。②氢氧化钙溶液呈碱性,能使无色酚酞
溶液显示红色。③氢氧化钙粉末与稀盐酸反应,所得
溶液呈无色。小结实验一: 酸和碱与指示剂的作用。实验二: 酸和金属氧化物的反应。实验三:氢氧化钠与硫酸铜反应,
蓝色絮状沉淀与稀盐酸反应实验四:酸碱中和反应实验五:氢氧化钙的性质 2.小亮在做"盐酸中和氢氧化钠溶液“的实验时,滴加盐酸前忘了加入指示剂,导致无法判断该中和反应进行的程度。于是他对所得溶液的酸碱性进行探究:
〖探究目的〗探究所得溶液的酸碱性
〖提出猜想〗所得溶液可能呈碱性、也可能呈 性,还可能呈 性。
〖实验验证〗巩固练习〖 分析与思考〗:
若无色酚酞溶液不变色,为了进一步确定溶液的酸碱性,你能提出了哪些方案?满
载
而
归这节课你收获了什么?谢谢
