沪教化学下册第7章2常见的酸和碱(共46张PPT)
文档属性
| 名称 | 沪教化学下册第7章2常见的酸和碱(共46张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-01 00:00:00 | ||
图片预览







文档简介
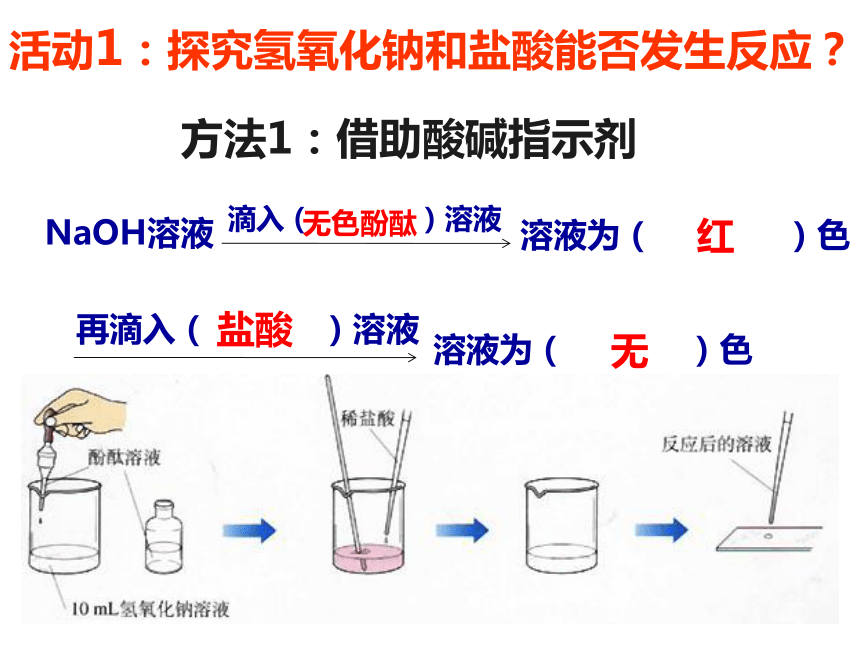
课件46张PPT。常见的酸和碱吃碱面时,放点醋,味道会更美。 胃酸的主要成分是盐酸【关注生活】通常需要服用含有氢氧化镁等抗酸剂的药物来缓解疼痛 活动1:探究氢氧化钠和盐酸能否发生反应?无色酚酞红盐酸无方法1:借助酸碱指示剂答:防止稀盐酸滴加过量。答:起指示作用。
因为NaOH与HCl反应无明显的现象发生,根据酚酞溶液由红色变为无色来判断NaOH和HCl是否反应完全。 2. 为什么在操作中必须逐滴滴入稀盐酸? 1. 酚酞在实验中起什么作用?注意:滴加盐酸至红色恰好变成无色时即止。
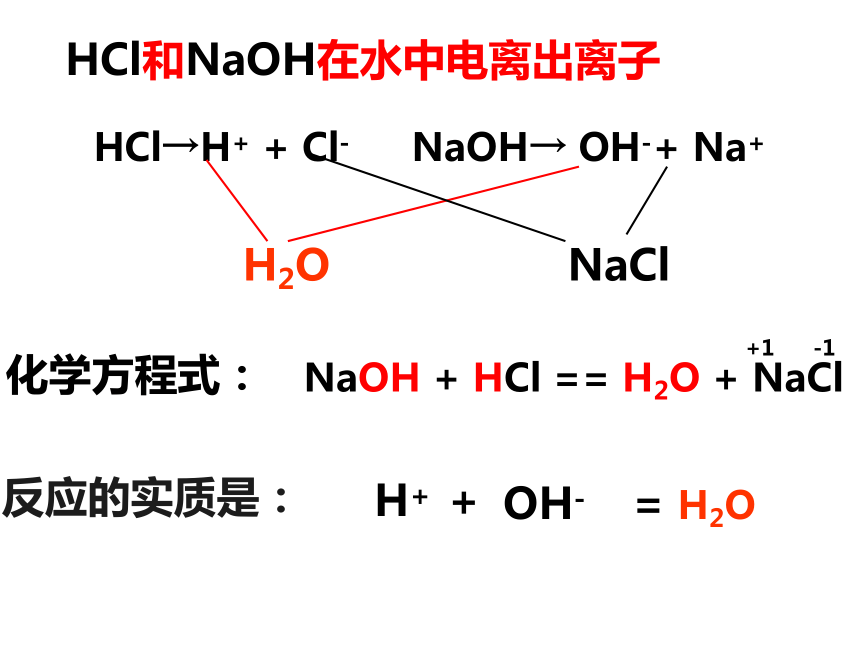
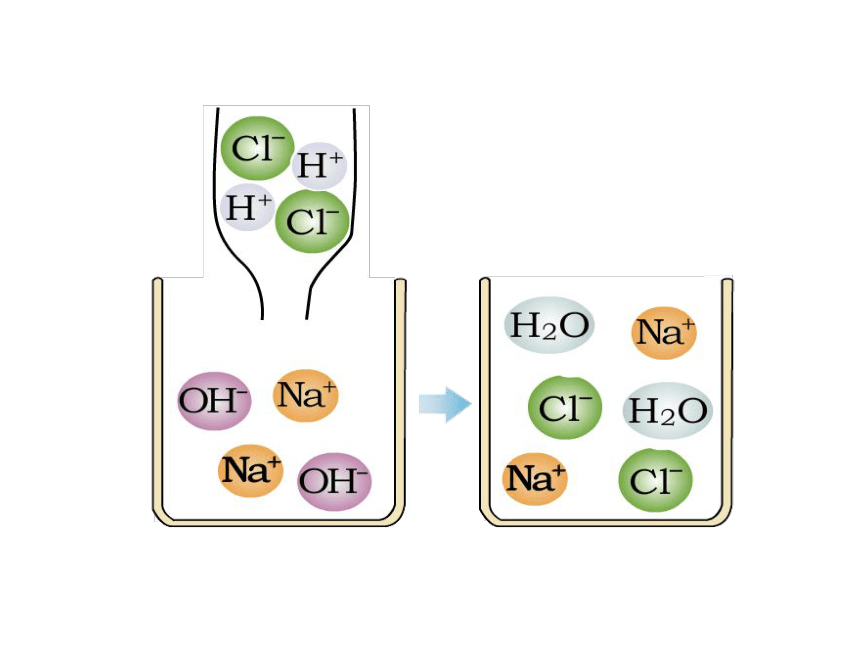
否则盐酸过量。讨论3. 为什么用玻璃棒不断搅拌?答:加快反应和使反应充分氢氧化钠与盐酸反应示意图HCl→H+ + Cl-NaOH→ OH-+ Na+ HCl和NaOH在水中电离出离子H2ONaCl+1 -1反应的实质是:结合刚才所学到的知识,
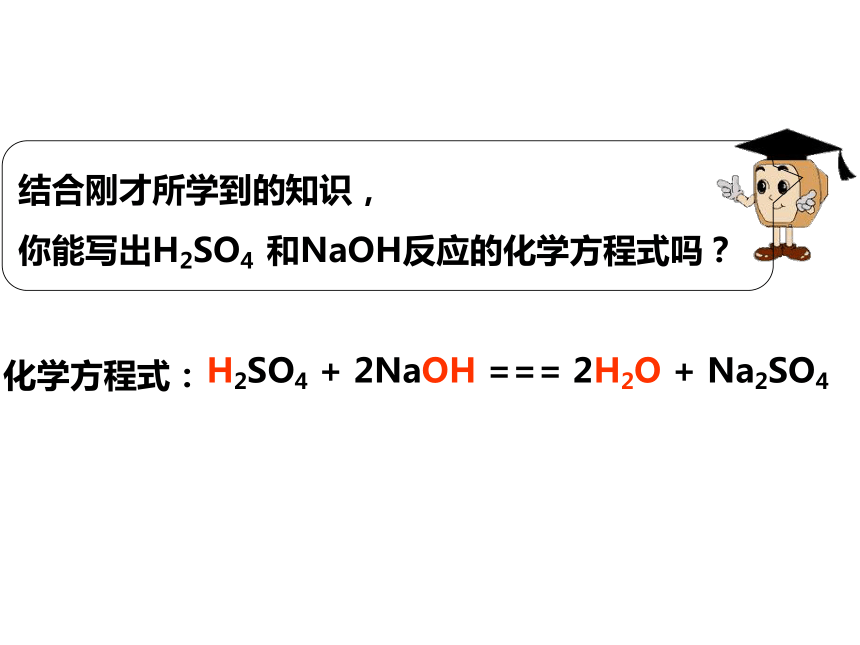
你能写出H2SO4 和NaOH反应的化学方程式吗?
氢氧化钠(碱)和稀盐酸(酸)反应,
生成了什么NaOH + HCl = NaCl + H2O碱酸水盐思考:NaCl = Na+ + Cl- 这个“盐”是指一类物质,和平时说的
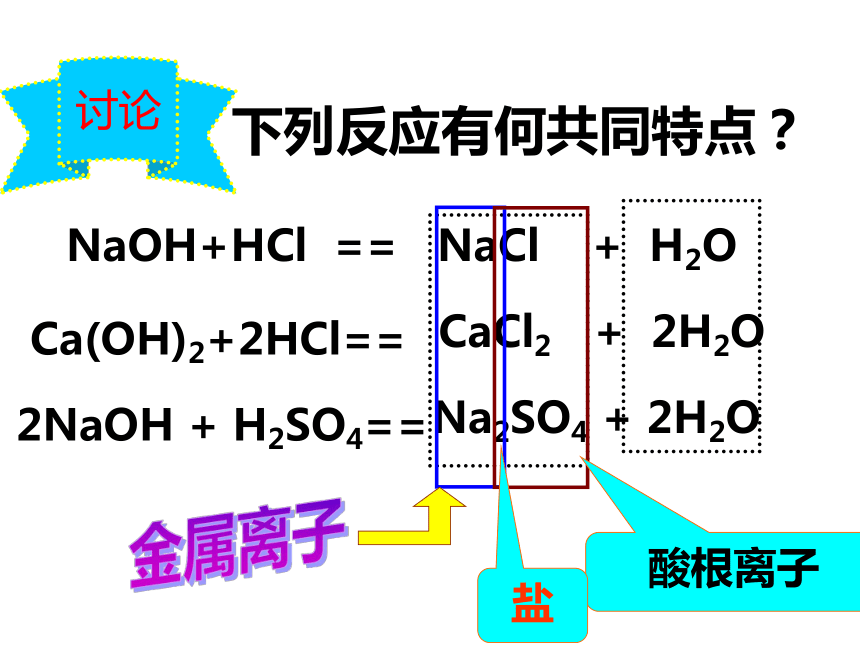
“食盐”可不同哦!讨论下列反应有何共同特点?NaOH+HCl == NaCl + H2OCa(OH)2+2HCl==CaCl2 + 2H2O2NaOH + H2SO4==Na2SO4 + 2H2O金属离子酸根离子盐盐:由金属离子(或者铵根离子)和酸根离子构成的化合物形成知识定义:酸 + 碱 = 盐 + 水实质:H+ + OH- = H2O基本反应类型:复分解反应能量变化:属于放热反应知识点二:中和反应的应用用于医药处理工业废水改良土壤的酸碱性调整溶液的酸碱性1.改良土壤的酸碱性加入酸 性物质中性土壤中性土壤酸性土壤熟石灰
Ca(OH)2中性土壤 ⑴ 为什么向酸性土壤中加入熟石灰,而不可以加
入氢氧化钠粉末?答:因为氢氧化钠的腐蚀性太强。答:是酸雨或化肥。 ⑵ 导致土壤显酸性的主要原因是什么?讨论: 2. 处理工厂的废水 ⑴ 如何处理硫酸厂生产中形成的含硫酸的污水? ⑵ 请写出有关反应的化学方程式: ⑶用CaO来中和污水行不行?H2SO4+?Ca(OH)2?=?CaSO4?+?2 H2OH2SO4+?Ca(OH)2?=?CaSO4?+?2 H2OCaO?+?H2O?=Ca(OH)2 3. 用于医药⑴ 中和胃酸过多用含有氢氧化铝的胃药中和胃酸中过多的盐酸。化学方程式:Al(OH)3 + 3HCl=AlCl3 + 3H2O服用某些含有碱性物质的药物以中和过多的胃酸。
例:Al(OH)3、CaCO3等。
若有胃溃疡患者,则不能用CaCO3 。
碳酸钙会与胃酸反应,生成二氧化碳,胃溃疡的人
可能会引起胃胀导致胃穿孔(急腹症)。 注意:药物自身无毒、无腐蚀性,
生成物无毒、无腐蚀性。
如:不能用NaOH、CaO、CuO等。下列哪些可用作胃药?哪个更好!
Al(OH)3
NaOH
NaHCO3
CaCO3
Mg(OH)2
CaO √√√√√⑵ 中和蚁酸思考:可不可以用NaOH来中和胃酸、蚁酸?为什么? 可涂抹一些含有碱性物质(如氨水NH3·H2O)的药水。答:不可以。因为NaOH的碱性太强,具有强的腐蚀性。蜜蜂与马蜂蜜蜂
被蜜蜂这蛰后,用肥皂水或氨水清洗 马蜂
被马蜂蛰后,用食醋止痛止痒 4.调配食物:添加食醋(CH3COOH) 松花蛋加工的主要原料:
食盐、生石灰、纯碱、水等。制作面条时,需加入碱
性的 Na2CO3 ,用来防
止面粉因发酵而产生酸味。调节溶液pH的方法1.若pH⑴加碱:pH增大至=或﹥ 7﹥7﹤72.若pH⑵加水:pH增大至≈7⑴加酸:pH减小到=或﹤ 7⑵加水:pH减小至≈7⑴使酸性溶液的pH升高应加水或碱性溶液⑵使碱性溶液的pH降低应加水或酸性溶液酸中加水酸中加碱碱中加酸碱中加水 将一定质量分数的酸性或碱性溶液加水稀释,则溶液的PH随所加水的体积(V)变化关系是A曲线表示的是酸性溶液还是碱性溶液?从哪里可以看出来A曲线表示的溶液加水后,其PH会不会等于7或小于7?A溶液随着水的不断加入,其PH是怎样变化的?B曲线表示的是酸性溶液还是碱性溶液?从哪里可以看出来B溶液随着水的不断加入,其PH是怎样变化的?B曲线表示的溶液加水后,其PH会不会等于7或小于7?判断酸碱反应能否发生的方法3:借助酸碱中和反应过程中溶液的酸碱度的变化步骤:先用pH试纸测NaOH溶液的 pH值,滴入稀盐酸后,再测溶液的PH值例:雨萌在做探究NaOH溶液和稀盐酸间能否
发生反应时,测NaOH溶液的pH值==10,逐渐
滴入稀盐酸后,再测溶液的pH值=4,她认为
两者间能发生反应,子涵认为不正确,因为
NaOH溶液被水稀释后, pH值也会减小,你
认为哪个同学的想法正确?雨萌同学的想法正确,因为NaOH溶液被水稀
释后, Ph值虽然会减小,,但不可能小于7小结:没有明显现象的酸碱之间的反应,有哪些方法判断他们之间是否发生反应?判断酸碱反应能否发生的方法3:借助酸碱中和反应过程中溶液的酸碱度的变化方法1:借助酸碱指示剂方法2:借助酸碱中和反应过程中温度的变化,中和反应是放热【题1】有一瓶无色溶液的PH是4.5,取少量注入试管中,再滴入几滴酚酞试液,溶液呈______色,如果要使试管中溶液的PH升为10,可以采取______________________的方法。无滴加碱溶液【课堂练习】【题2】有一瓶无色溶液的PH是9.5,取少量注入试管中,再滴入几滴酚酞试液,溶液呈______色,如果要使试管中溶液的PH降为5,可以采取______________________的方法。红滴加酸溶液3、某种消化药片的有效成分氢氧化镁,能减缓因胃酸过多引起的疼痛。在氢氧化镁与胃酸作用的过程中,胃液pH变化的情况是( )。B4.向氢氧化钠溶液中滴加稀盐酸至过量。下列各图中能表示溶液的pH与所加稀盐酸体积的关系的是( )A6中和反应中的图像变化1、酸加入碱中
当把酸加进碱的时候 ,碱的性质逐渐改变。当全部碱刚好被中和时,溶液的pH值很快地转变至pH=7,如果将更多的酸加入时,酸碱度便会降至pH=7以下。 ?(中和过程pH的变化)2、碱加入酸中 请思考碱加入酸中pH怎样变化?盐酸与氢氧化钠反应过程中溶液酸碱性变化的表示 【反思提升】:向盛有NaOH溶液的烧杯中滴入几滴酚酞试液,试液
变为______色,此时溶液的pH______________,向此溶
液中逐渐滴加稀盐酸,并不断振荡,直至试液刚好无色
时,溶液呈______________性,pH______________;继
续滴入稀HCl,溶液呈______________色,pH________,
在整个实验过程中,溶液发生了____________反应,
化学方程式为_____________________________。
红色>7中=7无<7中和反应HCl + NaOH === NaCl + H2O思考:在向氢氧化钠溶液中滴加稀盐酸时,溶液的pH是怎样变化的?你能说出曲线上坐标为(18,7)的点所表示的意义吗?pHNaOH溶液与盐酸恰好完全反应,溶液显中性pH=7氢氧化钠盐酸pH计7滴入的稀盐酸的量较少,溶液显碱性
【反思提升】:滴入的稀盐酸的量较多,溶液显酸性
用稀盐酸和氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图13示。 ?????????????????????
(1)该反应的化学方程式为:
? ??????????????????????????????????????。
(2)该实验操作是将 ?
????????????????滴加到另一种溶液中。
(3)当加入溶液的质量为a g时,所得溶液中的溶
质为(写化学式)?????????????????????????? 。
(4)当加入溶液的质量为b g时,向所得溶液中滴加酚酞溶液,溶液呈?? ?? 色。
(1)NaOH+HCl=NaCl+H2O氢氧化钠溶液HCl、NaCl红(5)将等质量、等质量分数的氢氧化钠溶液和盐酸混合,则反应后溶液的PH值 如果溶液的PH值为7时,消耗的氢氧化钠质量为c克,改成等质量的熟石灰,则反应后溶液的PH值为 ,溶质是1某学生测定的下列数据中,不合理的是
( )
A、用10ml量筒量取了7.5ml水
B、用pH试纸测得某地水的pH为5.2
C、用托盘天平称得某小苏打样品的质量为16.7g
D、测得某粗盐中氯化钠的质量分数为90.5%B综合练习2.将给出物质按指定要求用序号排列:
⑴a.食醋 b.蒸馏水 c.石灰水
pH由大到小_______________。
⑵a.氢气 b.二氧化碳 c.空气
标准状况下密度由大到小_____________。
⑶a.食盐 b.碳酸钙 c.氢氧化钙
室温时溶解度由大到小_______________。
⑷a.HNO3 b.NH3 c.N2
N元素的化合价由高到低_____________。 c>b>ab>c>aa>c>ba>c>b<7 =7 >7相对分子质量 2 44 29 易溶 难溶 微溶 +5 -3 03失去标签的三瓶无色液体,分别是稀HCl、蒸馏水、NaOH溶液,可用 加以区分。中性溶液(提示:HCl + NaOH=NaCl + H2O)稀HCl蒸馏水NaOH步骤:⑵分别滴加酚酞,振荡。变红的是NaOH溶液 ⑶取少量NaOH溶液再分别滴到另外两只试管中,振荡。⑴用三支试管,分别取少量三种无色液体。 变红的无色液体是蒸馏水,仍为无色的是稀盐酸。紫色石蕊溶液能否用酚酞试液将它们鉴别出来?4小松同学在进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液中滴加稀盐酸一会儿后,发现忘记了滴加指示剂。为了确定盐酸与氢氧化钠是否恰好完全反应,小松同学从烧杯中取少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色。于是他得出“两种物质已恰好完全中和”的结论。(1)你认为他得出的结论是否正确 ,
理由是 。
(2)请你另设计一个实验,探究上述烧杯中的溶液是否恰好完全反应,填写下表:稀盐酸氢氧化钠不正确 如果盐酸滴加过量,滴入酚酞试液也不变色 ①取样,滴加紫色石蕊试液 试液变红 盐酸过量 ②取样,滴加紫色石蕊试液 试液不变红 恰好中和 ③取样,滴加碳酸钠溶液 有气泡产生 盐酸过量 ④取样,滴加碳酸钠溶液 无气泡产生 恰好中和 ⑤取样,加入锌粒等活泼金属 有气泡产生 盐酸过量 ⑥取样,加入锌粒等活泼金属 无气泡产生 恰好中和 ⑦取样测pH值,pH值《7盐酸过量1.下列物质属于盐的是( )
A CuO B Cu(OH)2 C CuSO4 D HCl2.填写下表(类别按酸、碱、盐、氧化物填写)CNaOH碱硫酸铜盐H2SO4酸Fe2O3氧化物课堂练习3.下列反应,属于中和反应的是( )
A Zn +2HCl == ZnCl2 + H2
B CuO + 2HCl == CuCl2 + H2O
C Cu(OH)2 + H2SO4 == CuSO4 + 2H2O
D AgNO3 + HCl == AgCl + HNO3
C4、下列各组物质通常借助指示剂才能证明是否反应的是( )
A、氢氧化铜和稀盐酸
B、石灰石和稀盐酸
C、氢氧化钙与碳酸钠反应
D、烧碱和稀硫酸D5.用适量盐酸可以将热水瓶胆壁上的水垢[主要成分是Mg(OH)2和CaCO3]除去。说明去垢的原理,写出有关的化学方程式。
6.如果将实验室残留的盐酸直接倒入下水道,会造成什么危害?应如何处理废盐酸? Mg(OH)2+2HCl=MgCl2+2H2O CaCO3+2HCl=CaCl2+CO2↑+H2O 盐酸将不溶性的Mg(OH)2和CaCO3生成可溶性的氯化镁和氯化钙而便于洗去。 下水道若为金属管道,盐酸会使其腐蚀;并污染水。应将废盐酸倒入废液缸统一处理。
因为NaOH与HCl反应无明显的现象发生,根据酚酞溶液由红色变为无色来判断NaOH和HCl是否反应完全。 2. 为什么在操作中必须逐滴滴入稀盐酸? 1. 酚酞在实验中起什么作用?注意:滴加盐酸至红色恰好变成无色时即止。
否则盐酸过量。讨论3. 为什么用玻璃棒不断搅拌?答:加快反应和使反应充分氢氧化钠与盐酸反应示意图HCl→H+ + Cl-NaOH→ OH-+ Na+ HCl和NaOH在水中电离出离子H2ONaCl+1 -1反应的实质是:结合刚才所学到的知识,
你能写出H2SO4 和NaOH反应的化学方程式吗?
氢氧化钠(碱)和稀盐酸(酸)反应,
生成了什么NaOH + HCl = NaCl + H2O碱酸水盐思考:NaCl = Na+ + Cl- 这个“盐”是指一类物质,和平时说的
“食盐”可不同哦!讨论下列反应有何共同特点?NaOH+HCl == NaCl + H2OCa(OH)2+2HCl==CaCl2 + 2H2O2NaOH + H2SO4==Na2SO4 + 2H2O金属离子酸根离子盐盐:由金属离子(或者铵根离子)和酸根离子构成的化合物形成知识定义:酸 + 碱 = 盐 + 水实质:H+ + OH- = H2O基本反应类型:复分解反应能量变化:属于放热反应知识点二:中和反应的应用用于医药处理工业废水改良土壤的酸碱性调整溶液的酸碱性1.改良土壤的酸碱性加入酸 性物质中性土壤中性土壤酸性土壤熟石灰
Ca(OH)2中性土壤 ⑴ 为什么向酸性土壤中加入熟石灰,而不可以加
入氢氧化钠粉末?答:因为氢氧化钠的腐蚀性太强。答:是酸雨或化肥。 ⑵ 导致土壤显酸性的主要原因是什么?讨论: 2. 处理工厂的废水 ⑴ 如何处理硫酸厂生产中形成的含硫酸的污水? ⑵ 请写出有关反应的化学方程式: ⑶用CaO来中和污水行不行?H2SO4+?Ca(OH)2?=?CaSO4?+?2 H2OH2SO4+?Ca(OH)2?=?CaSO4?+?2 H2OCaO?+?H2O?=Ca(OH)2 3. 用于医药⑴ 中和胃酸过多用含有氢氧化铝的胃药中和胃酸中过多的盐酸。化学方程式:Al(OH)3 + 3HCl=AlCl3 + 3H2O服用某些含有碱性物质的药物以中和过多的胃酸。
例:Al(OH)3、CaCO3等。
若有胃溃疡患者,则不能用CaCO3 。
碳酸钙会与胃酸反应,生成二氧化碳,胃溃疡的人
可能会引起胃胀导致胃穿孔(急腹症)。 注意:药物自身无毒、无腐蚀性,
生成物无毒、无腐蚀性。
如:不能用NaOH、CaO、CuO等。下列哪些可用作胃药?哪个更好!
Al(OH)3
NaOH
NaHCO3
CaCO3
Mg(OH)2
CaO √√√√√⑵ 中和蚁酸思考:可不可以用NaOH来中和胃酸、蚁酸?为什么? 可涂抹一些含有碱性物质(如氨水NH3·H2O)的药水。答:不可以。因为NaOH的碱性太强,具有强的腐蚀性。蜜蜂与马蜂蜜蜂
被蜜蜂这蛰后,用肥皂水或氨水清洗 马蜂
被马蜂蛰后,用食醋止痛止痒 4.调配食物:添加食醋(CH3COOH) 松花蛋加工的主要原料:
食盐、生石灰、纯碱、水等。制作面条时,需加入碱
性的 Na2CO3 ,用来防
止面粉因发酵而产生酸味。调节溶液pH的方法1.若pH⑴加碱:pH增大至=或﹥ 7﹥7﹤72.若pH⑵加水:pH增大至≈7⑴加酸:pH减小到=或﹤ 7⑵加水:pH减小至≈7⑴使酸性溶液的pH升高应加水或碱性溶液⑵使碱性溶液的pH降低应加水或酸性溶液酸中加水酸中加碱碱中加酸碱中加水 将一定质量分数的酸性或碱性溶液加水稀释,则溶液的PH随所加水的体积(V)变化关系是A曲线表示的是酸性溶液还是碱性溶液?从哪里可以看出来A曲线表示的溶液加水后,其PH会不会等于7或小于7?A溶液随着水的不断加入,其PH是怎样变化的?B曲线表示的是酸性溶液还是碱性溶液?从哪里可以看出来B溶液随着水的不断加入,其PH是怎样变化的?B曲线表示的溶液加水后,其PH会不会等于7或小于7?判断酸碱反应能否发生的方法3:借助酸碱中和反应过程中溶液的酸碱度的变化步骤:先用pH试纸测NaOH溶液的 pH值,滴入稀盐酸后,再测溶液的PH值例:雨萌在做探究NaOH溶液和稀盐酸间能否
发生反应时,测NaOH溶液的pH值==10,逐渐
滴入稀盐酸后,再测溶液的pH值=4,她认为
两者间能发生反应,子涵认为不正确,因为
NaOH溶液被水稀释后, pH值也会减小,你
认为哪个同学的想法正确?雨萌同学的想法正确,因为NaOH溶液被水稀
释后, Ph值虽然会减小,,但不可能小于7小结:没有明显现象的酸碱之间的反应,有哪些方法判断他们之间是否发生反应?判断酸碱反应能否发生的方法3:借助酸碱中和反应过程中溶液的酸碱度的变化方法1:借助酸碱指示剂方法2:借助酸碱中和反应过程中温度的变化,中和反应是放热【题1】有一瓶无色溶液的PH是4.5,取少量注入试管中,再滴入几滴酚酞试液,溶液呈______色,如果要使试管中溶液的PH升为10,可以采取______________________的方法。无滴加碱溶液【课堂练习】【题2】有一瓶无色溶液的PH是9.5,取少量注入试管中,再滴入几滴酚酞试液,溶液呈______色,如果要使试管中溶液的PH降为5,可以采取______________________的方法。红滴加酸溶液3、某种消化药片的有效成分氢氧化镁,能减缓因胃酸过多引起的疼痛。在氢氧化镁与胃酸作用的过程中,胃液pH变化的情况是( )。B4.向氢氧化钠溶液中滴加稀盐酸至过量。下列各图中能表示溶液的pH与所加稀盐酸体积的关系的是( )A6中和反应中的图像变化1、酸加入碱中
当把酸加进碱的时候 ,碱的性质逐渐改变。当全部碱刚好被中和时,溶液的pH值很快地转变至pH=7,如果将更多的酸加入时,酸碱度便会降至pH=7以下。 ?(中和过程pH的变化)2、碱加入酸中 请思考碱加入酸中pH怎样变化?盐酸与氢氧化钠反应过程中溶液酸碱性变化的表示 【反思提升】:向盛有NaOH溶液的烧杯中滴入几滴酚酞试液,试液
变为______色,此时溶液的pH______________,向此溶
液中逐渐滴加稀盐酸,并不断振荡,直至试液刚好无色
时,溶液呈______________性,pH______________;继
续滴入稀HCl,溶液呈______________色,pH________,
在整个实验过程中,溶液发生了____________反应,
化学方程式为_____________________________。
红色>7中=7无<7中和反应HCl + NaOH === NaCl + H2O思考:在向氢氧化钠溶液中滴加稀盐酸时,溶液的pH是怎样变化的?你能说出曲线上坐标为(18,7)的点所表示的意义吗?pHNaOH溶液与盐酸恰好完全反应,溶液显中性pH=7氢氧化钠盐酸pH计7滴入的稀盐酸的量较少,溶液显碱性
【反思提升】:滴入的稀盐酸的量较多,溶液显酸性
用稀盐酸和氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图13示。 ?????????????????????
(1)该反应的化学方程式为:
? ??????????????????????????????????????。
(2)该实验操作是将 ?
????????????????滴加到另一种溶液中。
(3)当加入溶液的质量为a g时,所得溶液中的溶
质为(写化学式)?????????????????????????? 。
(4)当加入溶液的质量为b g时,向所得溶液中滴加酚酞溶液,溶液呈?? ?? 色。
(1)NaOH+HCl=NaCl+H2O氢氧化钠溶液HCl、NaCl红(5)将等质量、等质量分数的氢氧化钠溶液和盐酸混合,则反应后溶液的PH值 如果溶液的PH值为7时,消耗的氢氧化钠质量为c克,改成等质量的熟石灰,则反应后溶液的PH值为 ,溶质是1某学生测定的下列数据中,不合理的是
( )
A、用10ml量筒量取了7.5ml水
B、用pH试纸测得某地水的pH为5.2
C、用托盘天平称得某小苏打样品的质量为16.7g
D、测得某粗盐中氯化钠的质量分数为90.5%B综合练习2.将给出物质按指定要求用序号排列:
⑴a.食醋 b.蒸馏水 c.石灰水
pH由大到小_______________。
⑵a.氢气 b.二氧化碳 c.空气
标准状况下密度由大到小_____________。
⑶a.食盐 b.碳酸钙 c.氢氧化钙
室温时溶解度由大到小_______________。
⑷a.HNO3 b.NH3 c.N2
N元素的化合价由高到低_____________。 c>b>ab>c>aa>c>ba>c>b<7 =7 >7相对分子质量 2 44 29 易溶 难溶 微溶 +5 -3 03失去标签的三瓶无色液体,分别是稀HCl、蒸馏水、NaOH溶液,可用 加以区分。中性溶液(提示:HCl + NaOH=NaCl + H2O)稀HCl蒸馏水NaOH步骤:⑵分别滴加酚酞,振荡。变红的是NaOH溶液 ⑶取少量NaOH溶液再分别滴到另外两只试管中,振荡。⑴用三支试管,分别取少量三种无色液体。 变红的无色液体是蒸馏水,仍为无色的是稀盐酸。紫色石蕊溶液能否用酚酞试液将它们鉴别出来?4小松同学在进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液中滴加稀盐酸一会儿后,发现忘记了滴加指示剂。为了确定盐酸与氢氧化钠是否恰好完全反应,小松同学从烧杯中取少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色。于是他得出“两种物质已恰好完全中和”的结论。(1)你认为他得出的结论是否正确 ,
理由是 。
(2)请你另设计一个实验,探究上述烧杯中的溶液是否恰好完全反应,填写下表:稀盐酸氢氧化钠不正确 如果盐酸滴加过量,滴入酚酞试液也不变色 ①取样,滴加紫色石蕊试液 试液变红 盐酸过量 ②取样,滴加紫色石蕊试液 试液不变红 恰好中和 ③取样,滴加碳酸钠溶液 有气泡产生 盐酸过量 ④取样,滴加碳酸钠溶液 无气泡产生 恰好中和 ⑤取样,加入锌粒等活泼金属 有气泡产生 盐酸过量 ⑥取样,加入锌粒等活泼金属 无气泡产生 恰好中和 ⑦取样测pH值,pH值《7盐酸过量1.下列物质属于盐的是( )
A CuO B Cu(OH)2 C CuSO4 D HCl2.填写下表(类别按酸、碱、盐、氧化物填写)CNaOH碱硫酸铜盐H2SO4酸Fe2O3氧化物课堂练习3.下列反应,属于中和反应的是( )
A Zn +2HCl == ZnCl2 + H2
B CuO + 2HCl == CuCl2 + H2O
C Cu(OH)2 + H2SO4 == CuSO4 + 2H2O
D AgNO3 + HCl == AgCl + HNO3
C4、下列各组物质通常借助指示剂才能证明是否反应的是( )
A、氢氧化铜和稀盐酸
B、石灰石和稀盐酸
C、氢氧化钙与碳酸钠反应
D、烧碱和稀硫酸D5.用适量盐酸可以将热水瓶胆壁上的水垢[主要成分是Mg(OH)2和CaCO3]除去。说明去垢的原理,写出有关的化学方程式。
6.如果将实验室残留的盐酸直接倒入下水道,会造成什么危害?应如何处理废盐酸? Mg(OH)2+2HCl=MgCl2+2H2O CaCO3+2HCl=CaCl2+CO2↑+H2O 盐酸将不溶性的Mg(OH)2和CaCO3生成可溶性的氯化镁和氯化钙而便于洗去。 下水道若为金属管道,盐酸会使其腐蚀;并污染水。应将废盐酸倒入废液缸统一处理。
