沪教化学下册第6章基础实验5:配制一定溶质质量分数的氯化钠溶液 (共21张PPT)
文档属性
| 名称 | 沪教化学下册第6章基础实验5:配制一定溶质质量分数的氯化钠溶液 (共21张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 443.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-01 00:00:00 | ||
图片预览







文档简介
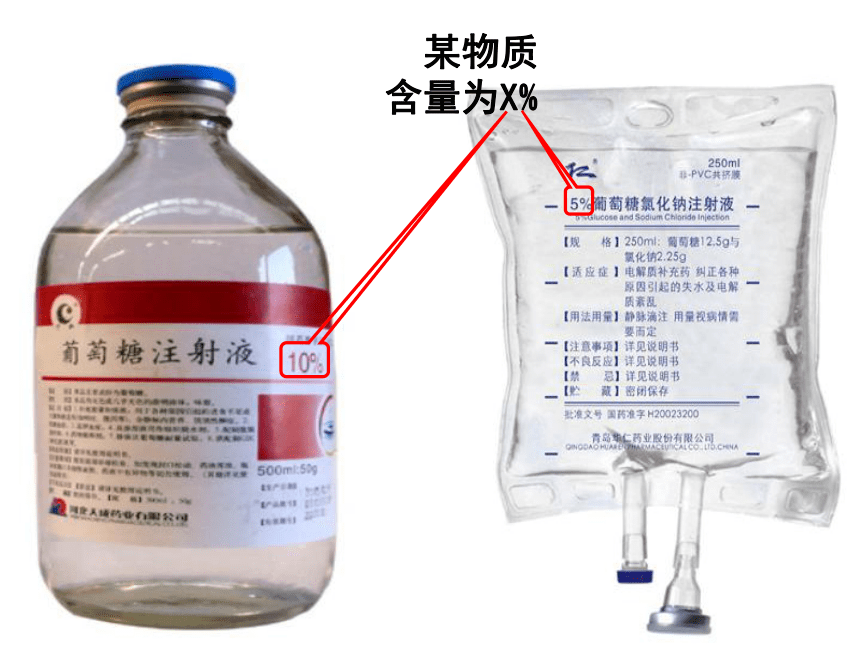
课件21张PPT。配制一定溶质质量分数的溶液 某物质 含量为X%学习目标1、掌握用固体配制一定质量分数的溶液。
2、掌握用浓溶液配制一定质量分数的稀溶液。
3、在探究过程中巩固并进一步理解溶质质量分
数的含义。
4、在自主探究、观察比较中,培养学生分析、
比较、抽象、概括的思维能力。
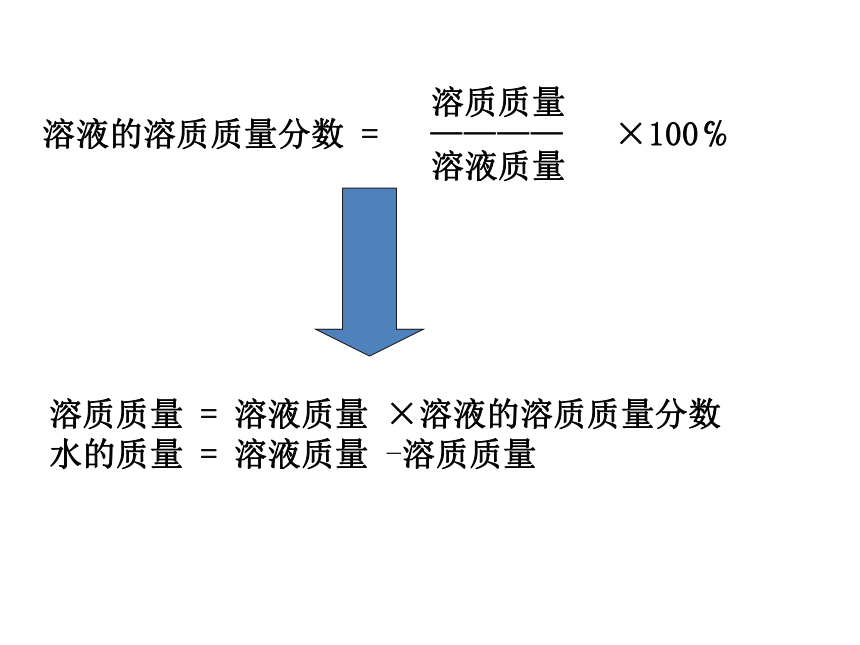
溶质质量
溶液的溶质质量分数 = ———— ×100℅
溶液质量
溶质质量 = 溶液质量 ×溶液的溶质质量分数
水的质量 = 溶液质量 -溶质质量 1.计算3.溶解4.转移2.547.547.5托盘天平量筒、胶头滴管47.52.5氯化钠细口瓶玻璃棒标签溶液名称质量分数托盘天平、药匙烧杯、玻璃棒 量筒、胶头滴管活动与探究一:配制50g溶质质量分数为5%的氯化钠溶液2.称量学生实验:
配制50g质量分数为5%的氯化钠溶液交流与讨论1:
在溶液配制过程中,使用玻璃棒的作用是什么?搅拌,加快溶解交流与讨论2:
下列情况,对所配制溶液的溶质质量分数分别会产生什么影响?填“偏大”、“偏小”、或“不变”(5)用量筒量取蒸馏水时偏小偏小 若仰视读数,则配制结果 .
若俯视读数,则配制结果 .(6)将量筒中的水倒入烧杯时,有水洒出,则配制结果 .
(7) 配制好的溶液倒入试剂瓶中时不慎溅出,
则配制结果 .偏小(3)若氯化钠固体没有全部溶解,则配制结果 . 不变(1)若氯化钠不纯, 则配制结果 .偏小(2)称取食盐时,砝码与食盐的位置颠倒,若使用了游码,
则配制结果 .若没有使用游码,则配制结果 .
偏小偏大(4)烧杯中原来有水,则配制结果 . 偏大不变不变交流与讨论3:
向所配溶液中加水,溶质质量 ,溶剂质量 ,溶液质量 。
变大变大活动与探究二:浓溶液稀释配制稀溶液
由浓溶液配制稀溶液的计算依据是什么?溶液稀释前后,溶质的质量不变。 m浓×a%=m稀×b%m加水= m稀- m浓
m =ρ ×Vρ浓V浓×a%= ρ稀V稀×b%m加水= ρ浓V浓- ρ稀V稀例题:配制500mL20%的硫酸需要98%的硫酸多少毫升?加多少毫升水? (20%的硫酸的密度为1.14g/cm3,98%的硫酸的密度为1.84g/cm3。)
解:设需98%的硫酸的体积为x。稀释前后溶质质量不变!1.84g/cm3 × x × 98% = 1.14g/cm3 × 500 cm3 × 20%稀释前溶液中所含溶质稀释后溶液中所含溶质x = 63.2 cm3m加水= m稀- m浓= 1.14g/cm3 × 500 cm3 - 1.84g/cm3
×63.2 cm3 =453.7g
V(水)= 453.7g ÷1g/mL = 453.7 mL
答:需要98%的硫酸63.2mL,需要加入453.7 mL的水。1、计算:交流与讨论4:
用浓溶液配制稀溶液的步骤是什么?2、量取:3、稀释:4、转移(装瓶贴标签)思考:稀释配制时需用到什么仪器?量筒、胶头滴管、烧杯、玻璃棒要配制100g 溶质质量分数为10%的氯化钠溶
液,下列操作中正确的是( )
A.将10g氯化钠固体直接放在天平的托盘上称量 B.量取90ml水时,俯视读数 C.为加快固体溶解,用温度计搅拌溶液 D.将配好的溶液倒入细口瓶中,盖紧瓶塞,并贴上标签D课堂练习要配制100g 溶质质量分数为10%的氯化钠溶
液,下列操作中正确的是( )
A.将10g氯化钠固体直接放在天平的托盘上称量 B.量取90ml水时,俯视读数 C.为加快固体溶解,用温度计搅拌溶液 D.将配好的溶液倒入细口瓶中,盖紧瓶塞,并贴上标签D课堂练习2. 实验室要配制100g10%的氢氧化钠溶液。现有:托盘天平、量筒(10mL、50mL、100mL)、药匙。根据要求填空(水的密度可以近似看成1g/cm3):
(1)配制主要步骤可概括为 转移。
(2)完成本实验还需要的玻璃仪器是: 。
(3)本实验取水应选用 mL的量筒。量水读数时,如 果俯视(其他操作无误),则配制的溶液中溶质的质量分数(填“大于”或“小于”或“等于”) 5%。计算 称量 溶解烧杯 胶头滴管100大于3.把50g98%的浓硫酸稀释成20%的稀硫酸,需要加水多少克?
解: 设稀释后溶液的质量为x
50g×98%=x×20%
x=245g
水的质量:245g-50g=195g
答:把50g质量分数为98%的浓硫酸稀释成质量分数为20%的稀硫酸,需要加水195g。如果把50g换成50mL,那么还需要什么条件才能解题? 溶液的密度把50mL98%的浓硫酸稀释成20%的稀硫酸,需要加水多少克?课堂小结通过本节课的学习,你知道了什么?步骤:
1.计算
2. 称量
3. 溶解
4. 转移(装瓶贴标签) 仪器 称量:药匙、托盘天平(固体)
量筒、胶头滴管(液体)
溶解:烧杯、玻璃棒。
用固体配制一定质量分数的溶液步骤:
1.计算
2. 量取
3. 稀释
4. 转移(装瓶贴标签) 仪器:
量取:量筒、胶头滴管(液体)
稀释:烧杯、玻璃棒。
用浓液体配制稀溶液再见
2、掌握用浓溶液配制一定质量分数的稀溶液。
3、在探究过程中巩固并进一步理解溶质质量分
数的含义。
4、在自主探究、观察比较中,培养学生分析、
比较、抽象、概括的思维能力。
溶质质量
溶液的溶质质量分数 = ———— ×100℅
溶液质量
溶质质量 = 溶液质量 ×溶液的溶质质量分数
水的质量 = 溶液质量 -溶质质量 1.计算3.溶解4.转移2.547.547.5托盘天平量筒、胶头滴管47.52.5氯化钠细口瓶玻璃棒标签溶液名称质量分数托盘天平、药匙烧杯、玻璃棒 量筒、胶头滴管活动与探究一:配制50g溶质质量分数为5%的氯化钠溶液2.称量学生实验:
配制50g质量分数为5%的氯化钠溶液交流与讨论1:
在溶液配制过程中,使用玻璃棒的作用是什么?搅拌,加快溶解交流与讨论2:
下列情况,对所配制溶液的溶质质量分数分别会产生什么影响?填“偏大”、“偏小”、或“不变”(5)用量筒量取蒸馏水时偏小偏小 若仰视读数,则配制结果 .
若俯视读数,则配制结果 .(6)将量筒中的水倒入烧杯时,有水洒出,则配制结果 .
(7) 配制好的溶液倒入试剂瓶中时不慎溅出,
则配制结果 .偏小(3)若氯化钠固体没有全部溶解,则配制结果 . 不变(1)若氯化钠不纯, 则配制结果 .偏小(2)称取食盐时,砝码与食盐的位置颠倒,若使用了游码,
则配制结果 .若没有使用游码,则配制结果 .
偏小偏大(4)烧杯中原来有水,则配制结果 . 偏大不变不变交流与讨论3:
向所配溶液中加水,溶质质量 ,溶剂质量 ,溶液质量 。
变大变大活动与探究二:浓溶液稀释配制稀溶液
由浓溶液配制稀溶液的计算依据是什么?溶液稀释前后,溶质的质量不变。 m浓×a%=m稀×b%m加水= m稀- m浓
m =ρ ×Vρ浓V浓×a%= ρ稀V稀×b%m加水= ρ浓V浓- ρ稀V稀例题:配制500mL20%的硫酸需要98%的硫酸多少毫升?加多少毫升水? (20%的硫酸的密度为1.14g/cm3,98%的硫酸的密度为1.84g/cm3。)
解:设需98%的硫酸的体积为x。稀释前后溶质质量不变!1.84g/cm3 × x × 98% = 1.14g/cm3 × 500 cm3 × 20%稀释前溶液中所含溶质稀释后溶液中所含溶质x = 63.2 cm3m加水= m稀- m浓= 1.14g/cm3 × 500 cm3 - 1.84g/cm3
×63.2 cm3 =453.7g
V(水)= 453.7g ÷1g/mL = 453.7 mL
答:需要98%的硫酸63.2mL,需要加入453.7 mL的水。1、计算:交流与讨论4:
用浓溶液配制稀溶液的步骤是什么?2、量取:3、稀释:4、转移(装瓶贴标签)思考:稀释配制时需用到什么仪器?量筒、胶头滴管、烧杯、玻璃棒要配制100g 溶质质量分数为10%的氯化钠溶
液,下列操作中正确的是( )
A.将10g氯化钠固体直接放在天平的托盘上称量 B.量取90ml水时,俯视读数 C.为加快固体溶解,用温度计搅拌溶液 D.将配好的溶液倒入细口瓶中,盖紧瓶塞,并贴上标签D课堂练习要配制100g 溶质质量分数为10%的氯化钠溶
液,下列操作中正确的是( )
A.将10g氯化钠固体直接放在天平的托盘上称量 B.量取90ml水时,俯视读数 C.为加快固体溶解,用温度计搅拌溶液 D.将配好的溶液倒入细口瓶中,盖紧瓶塞,并贴上标签D课堂练习2. 实验室要配制100g10%的氢氧化钠溶液。现有:托盘天平、量筒(10mL、50mL、100mL)、药匙。根据要求填空(水的密度可以近似看成1g/cm3):
(1)配制主要步骤可概括为 转移。
(2)完成本实验还需要的玻璃仪器是: 。
(3)本实验取水应选用 mL的量筒。量水读数时,如 果俯视(其他操作无误),则配制的溶液中溶质的质量分数(填“大于”或“小于”或“等于”) 5%。计算 称量 溶解烧杯 胶头滴管100大于3.把50g98%的浓硫酸稀释成20%的稀硫酸,需要加水多少克?
解: 设稀释后溶液的质量为x
50g×98%=x×20%
x=245g
水的质量:245g-50g=195g
答:把50g质量分数为98%的浓硫酸稀释成质量分数为20%的稀硫酸,需要加水195g。如果把50g换成50mL,那么还需要什么条件才能解题? 溶液的密度把50mL98%的浓硫酸稀释成20%的稀硫酸,需要加水多少克?课堂小结通过本节课的学习,你知道了什么?步骤:
1.计算
2. 称量
3. 溶解
4. 转移(装瓶贴标签) 仪器 称量:药匙、托盘天平(固体)
量筒、胶头滴管(液体)
溶解:烧杯、玻璃棒。
用固体配制一定质量分数的溶液步骤:
1.计算
2. 量取
3. 稀释
4. 转移(装瓶贴标签) 仪器:
量取:量筒、胶头滴管(液体)
稀释:烧杯、玻璃棒。
用浓液体配制稀溶液再见
