沪教化学下册第6章基础实验5 (共21张PPT)
文档属性
| 名称 | 沪教化学下册第6章基础实验5 (共21张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 165.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-01 00:00:00 | ||
图片预览








文档简介
课件21张PPT。基础实验5:配制一定溶质质量分数的NaCl溶液
【学习目标】
1.了解配制一定溶质质量分数溶液的步骤和所需的仪器;
2.初步学会配制一定溶质质量分数溶液。
3.在探究、讨论、观察比较中,培养学生分析、比较、抽象、概括的思维能力。【温故知新】 1.食盐水中溶质、溶剂是什么?
2.溶质的质量分数=---------
3.配制 50g 6% 的NaCl溶液时:
(1)经计算在 上称量 gNaCl并倒入干燥洁净的烧杯里,然后用 量取 mL蒸馏水倒入装有NaCl的烧杯里,并用 不断搅拌,使NaCl完全溶解,即得所需溶液。(水的密度约为1g/mL)溶质是NaCl,溶剂是H2O溶质质量溶液质量×100%天平3量筒47玻璃棒50g ×6% =3g (2)称量一定质量的NaCl时,砝码放在 ,NaCl放在 ,且在托盘两边各放一张 。当天平接近平衡时,为使药品不过量,添加药品的技巧是 。
(5g以下用游码)
(3)使用量筒时,量筒必须放 ,视线要与量筒内 保持水平,快接近刻度线时,改用 加液体。右盘左盘等质量的称量纸用手轻轻拍拿着盛
有氯化钠的药匙手臂平稳凹液面最低处胶头滴管逐滴4、浓溶液用水稀释时:
(1)浓溶液中溶质的质量 稀溶液中溶质的质量(填 >、<、= )。
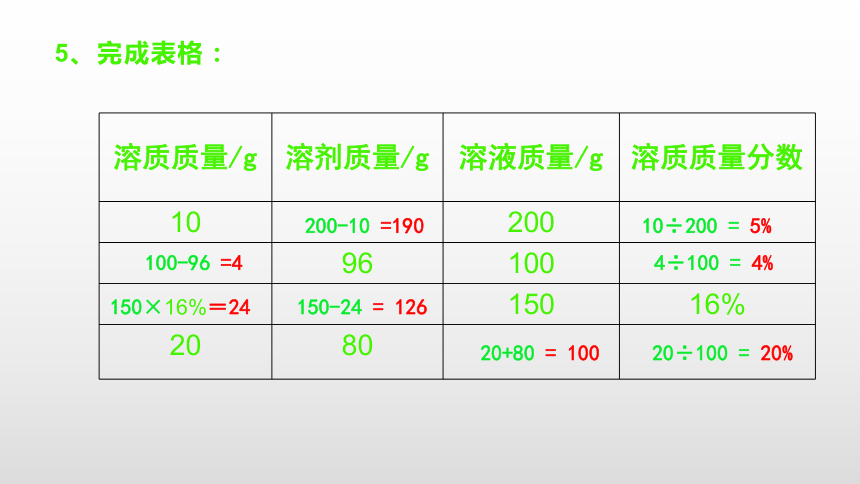
(2)所用水的质量= 。=稀溶液质量- 浓溶液质量5、完成表格:200-10 =19010÷200 = 5%100-96 =44÷100 = 4%150×16%=24150-24 = 12620+80 = 10020÷100 = 20% 那么你知道怎样配制一定溶质质量分数的溶液吗?
在医院里,我们经常会看到病人输液,许多就是氯化钠生理盐水(即溶质质量分数为0.9%的食盐水)。【情境引入】【教学过程】一、配制溶液的步骤
配制50g溶质质量分数为6%的氯化钠溶液1、计算:需氯化钠 g,水 g,即 ml;2、称量: 用 称取 g氯化钠;
用 量取 ml水,需要仪器 、 。3、溶解:将称得的食盐与水都倒入 中;
用 不停搅拌,使全溶解。需仪器 。
4、装瓶、贴签、入橱:需仪器 。47473托盘天平350mL量筒4750mL量筒胶头滴管烧杯玻璃棒玻璃棒、烧杯细口瓶50g ×6% =3g 50g -3g= 47思考:
用固体溶质配制溶质质量分数一定的溶液需要哪些仪器?二、实验仪器
称量固体:托盘天平、药匙;量取溶剂:贴近量程的量筒、胶头滴管;溶解溶质:烧杯、玻璃棒;
溶液入瓶:细口瓶。三、发现与讨论问题: 经检测刚刚配制的氯化钠溶质质量分数>6%,造成的原因可能是?分析误差的思路:
要从操作的规范性角度思考,溶质多、溶剂少的角度展开联想。
造成“溶质多”的因素: 、 ; 造成“溶剂少”的因素: 、
、 。 砝码锈蚀用托盘天平称量读取
时天平指针“偏左”读取水的体积时采用“俯视”读数倾倒水时有溶剂“洒落”或溶剂未倒完四、练一练,你发现了吗1、 称量氯化钠时需不需要用到砝码?
2、 将氯化钠固体倒入烧杯时,还有部分氯化钠固体留在纸上,则所配得的氯化钠溶液的质量分数 6%;
3、 某同学由于紧张将量筒中的水倒入烧杯时,不慎溅到烧杯的外面,则所配得的氯化钠溶液的质量分数 6%;
4、 将配制好的氯化钠溶液转移进试剂瓶时,仍有部分留在烧杯中,则所配得的氯化钠溶液的质量分数 6%;当质量整数值时,可以不用游码,当质量小于5g可以不用砝码<>=五、课堂训练
1.配制一定溶质的质量分数的氯化钠溶液的一些操作步骤见下图,正确的操作顺序是( )
A.①②③④⑤ B.②①④③⑤
C.③④①②⑤ D.④⑤①②③12345D2.要配制100g溶质质量分数为10%的氯化钠溶液,下列操作正确的是( )
A.将10g氯化钠固体直接放在天平的托盘上称量
B.量取90ml水时,俯视读数
C.为加快固体溶解,用温度计搅拌溶液
D.将配好的溶液倒入细口瓶中,盖紧瓶塞,并贴上标签××√×D3.在配制一定质量分数的氯化钠溶液时,下列出现的操作失误,会引起所配溶液的溶质质量分数降低的是( )
A.用托盘天平称量氯化钠时,将砝码放在左盘,但未使用游码
B.用量筒量取蒸馏水读数时,仰视凹液面的最低处
C.将量筒中的水倒入烧杯时,有水洒出
D.将配好的氯化钠溶液转移到细口瓶时, 不慎撒出部分溶液质量是整数值,未使用游码,砝码放反不影响质量,不影响结果,浓度不变仰视读取水体积时,导致水变多,使溶液质量分数降低,正确倒水时,水洒出,使溶液质量分数变大,不合题意溶液配好后,溶液洒出,浓度不变了,不合题意B4、欲配制50g 5%的氯化钠溶液:
(1)实验步骤是 、 、 、 、 。
(2)需要的玻璃仪器有: 。
(3)在托盘天平上称取 氯化钠,用规格为 的量筒量取 水。
(4)将称量的氯化钠和水倒入烧杯中,为加快氯化钠的溶解速率,常用的方法是 、 、 。
(5)在量取水的体积时,若俯视读数,则配制的溶液的溶质质量分数会 。(填偏高、相等、或偏低)计算称取量取溶解转移(入瓶)量筒、胶头滴管、烧杯、玻璃棒(细口瓶)2.5g50mL47.5mL玻璃棒搅拌研细食盐颗粒热水溶解或加热偏高50g ×5%= 2.5g50g -2.5g=47.5g 即47.5 mL六、课后延伸——自学:即浓配稀用浓溶液配制一定质量分数的溶液时,有几个步骤?用到哪些仪器?
【例题】现有浓盐酸溶质质量分数为37% ,密度为1.18g/cm3,现要配制50g溶质质量分数为5% 的盐酸溶液,需要该浓盐酸多少毫升?需要加水多少毫升?如何操作?
步骤
①计算:
解法一 设浓盐酸的质量为x,则:
x×37% = 50g×5% 解之,得 x = 6.8g
浓盐酸体积= 6.8g ÷1.18g/cm3≈5.7cm3=5.7mL;
m (水) = 50g—6.8g = 43.2 g;因为ρ(水) = 1 g/cm3 ,
所以:V (水) =43.2 g÷ 1 g/cm3=43.2 cm3=43.2mL
浓溶液配制成稀溶液方法:抓住“溶质不变”的核心解法二:设浓盐酸的体积为p,则:
p× 1.18g/cm3×37% = 50g×5%;p=5.7cm3=5.7mL
因为浓盐酸密度为1.18g/cm3
所以 浓盐酸的质量=1.18g/cm3×5.7mL= 6.8g
所以 水的质量=50g —6.8g = 43.2 g;
因为ρ(水) = 1 g/cm3,所以:V (水)=43.2g÷1g/cm3=43.2 cm3=43.2mL
②量取:用 mL量筒43.2 mL 水,倒入烧杯中,再用 mL量筒量取5.7 mL浓盐酸
③溶解:将5.7 mL浓盐酸倒入上面盛水的烧杯中,用玻璃棒不停搅拌,使它们完全溶解、并均匀混合;
④装瓶、贴签、入橱:标签上注明 ①5%;②溶液名称:盐酸
仪器:量筒、胶头滴管、玻璃棒、烧杯、细口瓶等5010七、小结配制一定质量分数的溶液:主要有2种情况
1.固配液
主要步骤是: 计算、称取、量取、溶解、转移;
玻璃仪器是:贴近量程的量筒、胶头滴管、烧杯、玻璃棒;
影响误差有:“俯视:读大得小”水少变浓;“仰视:读小得大”水多变稀;砝码是否磨损与锈蚀、读数时指针是否居中、砝码与被测物是否放反等。
2.浓配稀
主要步骤是: 计算、量取、溶解、转移;
玻璃仪器是:贴近量程的量筒、胶头滴管、烧杯、玻璃棒;
影响误差有:
“俯视”:读水得小”水少变浓; “俯视:读浓得小”浓少变稀; “仰视”:读浓得大”浓多变浓;“仰视:读水得大”水多变稀;八、课后思考与作业1、如何用含沙土的不纯食盐,来操作配制一定质量分数的食盐水?
基本思路:①先提纯,②后配制。
先提纯步骤:加水溶解 过滤(除去不溶性杂质) 蒸发结晶
充分干燥晶体
2、完成:印发的《实验报告》。
感谢倾听,再见!
【学习目标】
1.了解配制一定溶质质量分数溶液的步骤和所需的仪器;
2.初步学会配制一定溶质质量分数溶液。
3.在探究、讨论、观察比较中,培养学生分析、比较、抽象、概括的思维能力。【温故知新】 1.食盐水中溶质、溶剂是什么?
2.溶质的质量分数=---------
3.配制 50g 6% 的NaCl溶液时:
(1)经计算在 上称量 gNaCl并倒入干燥洁净的烧杯里,然后用 量取 mL蒸馏水倒入装有NaCl的烧杯里,并用 不断搅拌,使NaCl完全溶解,即得所需溶液。(水的密度约为1g/mL)溶质是NaCl,溶剂是H2O溶质质量溶液质量×100%天平3量筒47玻璃棒50g ×6% =3g (2)称量一定质量的NaCl时,砝码放在 ,NaCl放在 ,且在托盘两边各放一张 。当天平接近平衡时,为使药品不过量,添加药品的技巧是 。
(5g以下用游码)
(3)使用量筒时,量筒必须放 ,视线要与量筒内 保持水平,快接近刻度线时,改用 加液体。右盘左盘等质量的称量纸用手轻轻拍拿着盛
有氯化钠的药匙手臂平稳凹液面最低处胶头滴管逐滴4、浓溶液用水稀释时:
(1)浓溶液中溶质的质量 稀溶液中溶质的质量(填 >、<、= )。
(2)所用水的质量= 。=稀溶液质量- 浓溶液质量5、完成表格:200-10 =19010÷200 = 5%100-96 =44÷100 = 4%150×16%=24150-24 = 12620+80 = 10020÷100 = 20% 那么你知道怎样配制一定溶质质量分数的溶液吗?
在医院里,我们经常会看到病人输液,许多就是氯化钠生理盐水(即溶质质量分数为0.9%的食盐水)。【情境引入】【教学过程】一、配制溶液的步骤
配制50g溶质质量分数为6%的氯化钠溶液1、计算:需氯化钠 g,水 g,即 ml;2、称量: 用 称取 g氯化钠;
用 量取 ml水,需要仪器 、 。3、溶解:将称得的食盐与水都倒入 中;
用 不停搅拌,使全溶解。需仪器 。
4、装瓶、贴签、入橱:需仪器 。47473托盘天平350mL量筒4750mL量筒胶头滴管烧杯玻璃棒玻璃棒、烧杯细口瓶50g ×6% =3g 50g -3g= 47思考:
用固体溶质配制溶质质量分数一定的溶液需要哪些仪器?二、实验仪器
称量固体:托盘天平、药匙;量取溶剂:贴近量程的量筒、胶头滴管;溶解溶质:烧杯、玻璃棒;
溶液入瓶:细口瓶。三、发现与讨论问题: 经检测刚刚配制的氯化钠溶质质量分数>6%,造成的原因可能是?分析误差的思路:
要从操作的规范性角度思考,溶质多、溶剂少的角度展开联想。
造成“溶质多”的因素: 、 ; 造成“溶剂少”的因素: 、
、 。 砝码锈蚀用托盘天平称量读取
时天平指针“偏左”读取水的体积时采用“俯视”读数倾倒水时有溶剂“洒落”或溶剂未倒完四、练一练,你发现了吗1、 称量氯化钠时需不需要用到砝码?
2、 将氯化钠固体倒入烧杯时,还有部分氯化钠固体留在纸上,则所配得的氯化钠溶液的质量分数 6%;
3、 某同学由于紧张将量筒中的水倒入烧杯时,不慎溅到烧杯的外面,则所配得的氯化钠溶液的质量分数 6%;
4、 将配制好的氯化钠溶液转移进试剂瓶时,仍有部分留在烧杯中,则所配得的氯化钠溶液的质量分数 6%;当质量整数值时,可以不用游码,当质量小于5g可以不用砝码<>=五、课堂训练
1.配制一定溶质的质量分数的氯化钠溶液的一些操作步骤见下图,正确的操作顺序是( )
A.①②③④⑤ B.②①④③⑤
C.③④①②⑤ D.④⑤①②③12345D2.要配制100g溶质质量分数为10%的氯化钠溶液,下列操作正确的是( )
A.将10g氯化钠固体直接放在天平的托盘上称量
B.量取90ml水时,俯视读数
C.为加快固体溶解,用温度计搅拌溶液
D.将配好的溶液倒入细口瓶中,盖紧瓶塞,并贴上标签××√×D3.在配制一定质量分数的氯化钠溶液时,下列出现的操作失误,会引起所配溶液的溶质质量分数降低的是( )
A.用托盘天平称量氯化钠时,将砝码放在左盘,但未使用游码
B.用量筒量取蒸馏水读数时,仰视凹液面的最低处
C.将量筒中的水倒入烧杯时,有水洒出
D.将配好的氯化钠溶液转移到细口瓶时, 不慎撒出部分溶液质量是整数值,未使用游码,砝码放反不影响质量,不影响结果,浓度不变仰视读取水体积时,导致水变多,使溶液质量分数降低,正确倒水时,水洒出,使溶液质量分数变大,不合题意溶液配好后,溶液洒出,浓度不变了,不合题意B4、欲配制50g 5%的氯化钠溶液:
(1)实验步骤是 、 、 、 、 。
(2)需要的玻璃仪器有: 。
(3)在托盘天平上称取 氯化钠,用规格为 的量筒量取 水。
(4)将称量的氯化钠和水倒入烧杯中,为加快氯化钠的溶解速率,常用的方法是 、 、 。
(5)在量取水的体积时,若俯视读数,则配制的溶液的溶质质量分数会 。(填偏高、相等、或偏低)计算称取量取溶解转移(入瓶)量筒、胶头滴管、烧杯、玻璃棒(细口瓶)2.5g50mL47.5mL玻璃棒搅拌研细食盐颗粒热水溶解或加热偏高50g ×5%= 2.5g50g -2.5g=47.5g 即47.5 mL六、课后延伸——自学:即浓配稀用浓溶液配制一定质量分数的溶液时,有几个步骤?用到哪些仪器?
【例题】现有浓盐酸溶质质量分数为37% ,密度为1.18g/cm3,现要配制50g溶质质量分数为5% 的盐酸溶液,需要该浓盐酸多少毫升?需要加水多少毫升?如何操作?
步骤
①计算:
解法一 设浓盐酸的质量为x,则:
x×37% = 50g×5% 解之,得 x = 6.8g
浓盐酸体积= 6.8g ÷1.18g/cm3≈5.7cm3=5.7mL;
m (水) = 50g—6.8g = 43.2 g;因为ρ(水) = 1 g/cm3 ,
所以:V (水) =43.2 g÷ 1 g/cm3=43.2 cm3=43.2mL
浓溶液配制成稀溶液方法:抓住“溶质不变”的核心解法二:设浓盐酸的体积为p,则:
p× 1.18g/cm3×37% = 50g×5%;p=5.7cm3=5.7mL
因为浓盐酸密度为1.18g/cm3
所以 浓盐酸的质量=1.18g/cm3×5.7mL= 6.8g
所以 水的质量=50g —6.8g = 43.2 g;
因为ρ(水) = 1 g/cm3,所以:V (水)=43.2g÷1g/cm3=43.2 cm3=43.2mL
②量取:用 mL量筒43.2 mL 水,倒入烧杯中,再用 mL量筒量取5.7 mL浓盐酸
③溶解:将5.7 mL浓盐酸倒入上面盛水的烧杯中,用玻璃棒不停搅拌,使它们完全溶解、并均匀混合;
④装瓶、贴签、入橱:标签上注明 ①5%;②溶液名称:盐酸
仪器:量筒、胶头滴管、玻璃棒、烧杯、细口瓶等5010七、小结配制一定质量分数的溶液:主要有2种情况
1.固配液
主要步骤是: 计算、称取、量取、溶解、转移;
玻璃仪器是:贴近量程的量筒、胶头滴管、烧杯、玻璃棒;
影响误差有:“俯视:读大得小”水少变浓;“仰视:读小得大”水多变稀;砝码是否磨损与锈蚀、读数时指针是否居中、砝码与被测物是否放反等。
2.浓配稀
主要步骤是: 计算、量取、溶解、转移;
玻璃仪器是:贴近量程的量筒、胶头滴管、烧杯、玻璃棒;
影响误差有:
“俯视”:读水得小”水少变浓; “俯视:读浓得小”浓少变稀; “仰视”:读浓得大”浓多变浓;“仰视:读水得大”水多变稀;八、课后思考与作业1、如何用含沙土的不纯食盐,来操作配制一定质量分数的食盐水?
基本思路:①先提纯,②后配制。
先提纯步骤:加水溶解 过滤(除去不溶性杂质) 蒸发结晶
充分干燥晶体
2、完成:印发的《实验报告》。
感谢倾听,再见!
