第7章 应用广泛的酸、碱、盐—氢氧化钠溶液变质的探究 教案
文档属性
| 名称 | 第7章 应用广泛的酸、碱、盐—氢氧化钠溶液变质的探究 教案 |  | |
| 格式 | zip | ||
| 文件大小 | 127.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-09 16:32:03 | ||
图片预览




文档简介
教学设计
———氢氧化钠溶液变质的探究
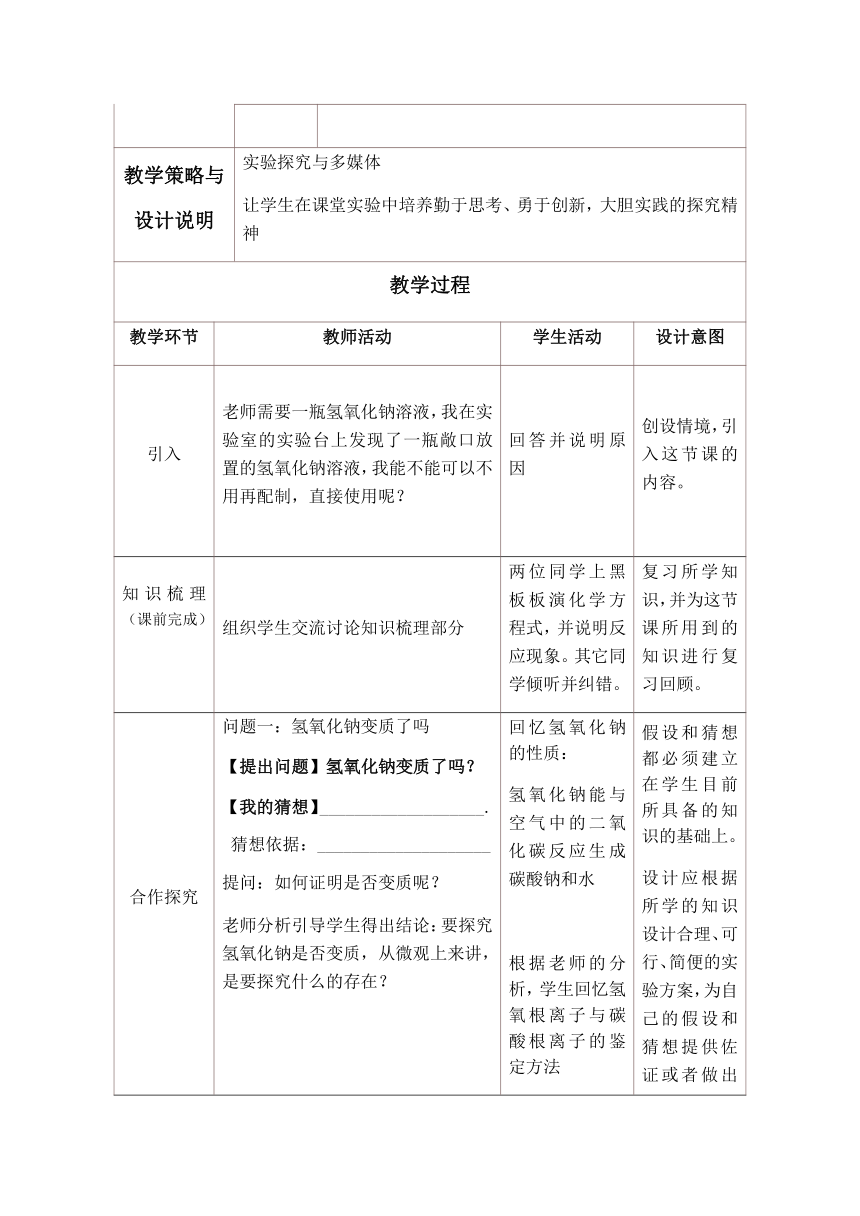
基本信息 名称 氢氧化钠溶液变质的探究 课型 专题复习
执教者 课时 1课时
所属教材 沪教版 化学下册
学情分析 学习了碱的化学性质,学生对氢氧化钠的性质有所了解,由氢氧化钠的化学性质,知道了氢氧化钠如何保存及其原因。如何通过氢氧化钠的变质,能够举一反三,进而得出物质的鉴别、除杂等一系列的问题,是一个难点。所以设计了一节关于氢氧化钠溶液变质的探究的专题复习。
教学目标 知识与能力目标 1、加深对酸碱盐知识的理解,使相关知识由点形成网络。2、通过对氢氧化钠变质的探究,学生初步学会解决此类问题的方法,知道如何设计实验方案,并学会如何合理评价实验方案。3、掌握物质检验、鉴别、除杂的一般思路和方法
过程与方法目标 通过氢氧化钠变质的实验探究,学生初步掌握运用知识解决实际问题的能力和进行科学探究的方法。
情感态度与价值观目标 1、激发学生开展科学探究和学习化学的兴趣。2、培养学生互相配合,取长补短、共同进步的合作精神。
教学重难点 重点 物质变质的探究方法
难点 物质检验、鉴别、除杂的一般思路和方法.
教学策略与 设计说明 实验探究与多媒体让学生在课堂实验中培养勤于思考、勇于创新,大胆实践的探究精神
教学过程
教学环节 教师活动 学生活动 设计意图
引入 老师需要一瓶氢氧化钠溶液,我在实验室的实验台上发现了一瓶敞口放置的氢氧化钠溶液,我能不能可以不用再配制,直接使用呢? 回答并说明原因 创设情境,引入这节课的内容。
知识梳理(课前完成) 组织学生交流讨论知识梳理部分 两位同学上黑板板演化学方程式,并说明反应现象。其它同学倾听并纠错。 复习所学知识,并为这节课所用到的知识进行复习回顾。
合作探究 问题一:氢氧化钠变质了吗【提出问题】氢氧化钠变质了吗?【我的猜想】___________________.猜想依据:____________________提问:如何证明是否变质呢?老师分析引导学生得出结论:要探究氢氧化钠是否变质,从微观上来讲,是要探究什么的存在? 对学生们的答案进行总结。 问题二:氢氧化钠的变质程度提出问题:如果变质,那变质的程度如何呢?【我的猜想】1、________,溶质________2、_________,溶质______提问:如何设计实验证明你的猜想呢? 对学生们的答案进行点评,并纠正。总结。 问题三、变质后NaOH溶液的处理 若要除去上述变质的氢氧化钠溶液中的杂质,应加入适量的__________溶液而除去。对学生们的回答进行点评,并小结除杂与鉴别的区别 回忆氢氧化钠的性质:氢氧化钠能与空气中的二氧化碳反应生成碳酸钠和水 根据老师的分析,学生回忆氢氧根离子与碳酸根离子的鉴定方法分组设计实验学生展示自己的答案。学生对展示的答案进行点评。 经讨论,第一步,完全除去某一离子,而根据之前的分析,可知除掉氢氧根离子的同时,亦能除去碳酸根离子,所以第一步必先除去碳酸根离子。选择的试剂,应选择能除碳酸根离子 ,而不影响OH-的Ca2+ 。第二步,证明是否还有OH-存在。 师友小组间讨论给出答案,并解释。 假设和猜想都必须建立在学生目前所具备的知识的基础上。设计应根据所学的知识设计合理、可行、简便的实验方案,为自己的假设和猜想提供佐证或者做出合理的解释。 要地探究全过程进行考虑。
知识运用 指导对学生的讲解进行点评 完成习题,一组师友讲解 对所学知识的巩固
课堂小结 氢氧化钠溶液变质的探究方法,除杂、鉴别的一般步骤。
布置作业 学案上的互助提高
板书设计 氢氧化钠溶液变质的探究氢氧化钠是否变质原因:2NaOH+CO2 == Na2CO3+H2O氢氧化钠的变质程度部分变质:全部变质:三、变质后NaOH溶液的处理
教学反思 1、本节课运用多媒体和实验探究,充分调动了学生的积极性,课题气氛很好。2.这节课让我最满意和最兴奋的环节就是学生们对实验探究过程中表现出的积极性。3、学生们对这堂课的学习也非常满意,达到了我的预期效果和目的。
附:学案
氢氧化钠溶液变质的探究
学习目标:1、加深对酸碱盐知识的理解,使相关知识由点形成网络。
2、通过对氢氧化钠变质的探究,学生初步学会解决此类问题的方法,知道如何设计实验方案,并学会如何合理评价实验方案。
3、掌握物质检验、鉴别、除杂的一般思路和方法
学习重点:物质变质的探究方法
学习难点:物质检验、鉴别、除杂的一般思路和方法.
学习过程:
【知识梳理】(课前完成)
1、NaOH的化学性质
化学性质 化学方程式 现象
水溶液显_____性,滴加无色酚酞试液
能与____________发生反应 NaOH+CO2=
能与____________发生反应 NaOH+HCl=
能与____________发生反应 NaOH+CuSO4= NaOH+N H4Cl=
2、Na2CO3的化学性质
化学性质 化学方程式 现象
水溶液显_____性,滴加无色酚酞试液
能与____________发生反应 Na2CO3+ HCl=
能与____________发生反应 Na2CO3+ Ca(OH)2= Na2CO3+ Ba(OH)2=
能与____________发生反应 Na2CO3+ CaCl2= Na2CO3+ BaCl2=
3、对比NaOH和Na2CO3的性质,你认为它们是同一类物质吗?
______________________________________________________
【合作探究】
在准备化学实验加试时,老师在实验台上发现了一瓶敞口放置的氢氧化钠溶液,于是和同学们对这瓶敞口放置的氢氧化钠溶液进行了如下探究。
一、氢氧化钠是否变质
【提出问题】氢氧化钠变质了吗?
【我的猜想】_________________________;
_________________________.
猜想依据:__________________________________________
怎样证明氢氧化钠是否变质?
【设计实验】探究的实质:证明溶液中是否存在_______________
【实验方案】
实验步骤 实验现象 实验结论
方法一:取少量待测液于试管中,向其中滴加足量的____________方法二:取少量待测液于试管中,向其中滴加少量的___________方法三:取少量待测液于试管中,向其中滴加少量的___________(或___________) 氢氧化钠溶液没有变质
氢氧化钠溶液已经变质
二、氢氧化钠的变质程度
【提出问题】如果变质,那变质的程度如何呢?
【我的猜想】1、___________________,溶质_______________
2、___________________,溶质_______________
【设计实验】实质是证明_________的存在,但是是在有_________存在的条件下来确定它的存在。
【实验方案】
实验步骤 实验现象 实验结论
取少量样品于试管中,向其中滴加足量的________________________,静置,取上层清液于试管中,向其中滴加_________ 氢氧化钠溶液全部变质
氢氧化钠溶液部分变质
【反思与拓展】
氢氧化钠变质是由于它与二氧化碳发生反应的缘故,因些氢氧化钠应__________保存。
三、变质后NaOH溶液的处理
若要除去上述变质的氢氧化钠溶液中的杂质,应加入适量的__________溶液而除去。
【知识运用】
1、下列实验方案能达到目的是( )
选项 实验目的 所用试剂或方法
A 检验一瓶气体是否为CO2 燃着的木条
B 鉴别氢氧化钠溶液和饱和石灰水 升高温度
C 除去氢氧化钠溶液中的碳酸钠 稀盐酸
D 分离铁粉和铜粉 稀硫酸
2、氢氧化钠和氢氧化钙是两种常见的碱。李红同学将两种碱的溶液分别装人试管A 、B 中,并进行了如下图所示的三组实验。
(1)实验l 中,两支试管的溶液都变成 色。
(2)实验2中,若B 盛装的是NaOH 溶液,发生反应的化学方程式为 , 该反应的墓本类型是 反应。
(3)实验3中,李红同学向两支试管吹气,A 中有白色沉淀生成,发生反应的化学方程式为 。B 中无现象,为了探究吹气后B 中溶质的成分,李红进行了如下探究。
提出猜想:
猜想1 :溶质只有氢氧化钠 猜想2 :溶质只有碳酸钠 猜想3 :溶质有氢氧化钠和碳酸钠……
实验和结论:
实验 实验现象 结论
取B 中少量溶液,加人澄清石灰水至不再产生沉淀为止,过滤后取上层清液,向其中加几滴酚酞试液。 产生白色沉淀,溶液呈现红色。 猜想3成立
反思与评价:
老师评价李红得出的结论不正确,是因为猜想 (填数字)也会产生相同的现象。如果要验证“猜想3成立”,必须要换试剂,将 溶液换成 溶液。
【拓展提高】
1、小明和小艳在实验室配制石灰水时,小明同学将两药匙熟石灰样品放入小烧杯中,向其中加入一定量的蒸馏水,充分搅拌后发现烧杯底部仍有不溶性的固体,于是他认为熟石灰样品已经变质。小艳同学不同意他的判断,你认为小艳同学的理由是??????????????????????。同学们针对该熟石灰样品的成分展开了讨论,请你参与讨论并完成实验报告。
??【提出问题】熟石灰样品的主要成分是什么?
??【作出猜想】甲同学猜想是Ca(OH)2;
???????? 乙同学猜想是CaCO3
??????? ?你认为是??????????。
??【实验与结论】请你通过实验验证你的猜想:
【拓展与应用】小组同学反思了熟石灰变质的原因(用化学方程式表示)_________________________,认识到实验室应????????保存熟石灰。
2、实验室常用的干燥剂“碱石灰”是CaO和固体NaOH的混合物,极易与空气中水蒸汽和CO2反应而变质。某同学对一瓶久置的“碱石灰”作了如下探究:
(1)【猜想】
猜想Ⅰ:没有变质,“碱石灰”只含有CaO、固体NaOH;
猜想Ⅱ:已完全变质,“碱石灰”全部变成了CaCO3和Na2CO3。
则CaO与水反应的反应方程式为 。
(2)【实验】如下图所示:
(3)【判断】
a.若Ca(OH)2、CaCO3和Na2CO3投入到水中不会放热,则由操作②现象判断:猜想Ⅱ (填:成立、不成立)
b.操作④发生化学反应的方程式为 ;由操作
⑤⑥的现象判断:滤液中含有 (写化学式);由此判断猜想Ⅰ (填:成立、不成立)。
c.综合a和b的结论,判断该样品变质情况为 。
(4)【拓展】由上述实验说明,实验室中“碱石灰”应 保存;操作③中玻棒的作用是 。
