6.2溶液组成的表示-教学设计
图片预览

文档简介
课 题 : 第6章 溶解现象
第2节 溶液组成的表示
【教学目标】
1. 知识与技能:
①知道溶液是由溶质和溶剂组成的;知道水是重要的溶剂,酒精、汽油也是常用的溶剂;
②能进行溶质质量分数的简单计算;
③认识溶质质量分数的含义,能配制一定溶质质量分数的溶液。
2. 过程与方法:
①通过溶质质量分数的简单计算,掌握基本的解题方法,提高解题能力;
②通过分组实验,掌握配制溶液的基本操作步骤,并体会合作学习的乐趣。
3. 情感态度与价值观:
①用所学知识解决生活中常见问题,树立学知识、用知识的正确观念;
②根据最基本的化学知识,会解决很多引申知识,培养由特殊到一般的哲学思维。
【教学重难点】
重点:溶液组成的定性表示方法和定量表示方法,学会配制最简单的溶液。
难点:溶液配制中的实验操作和误差分析。
【教学方法】
讲解法、讨论法、实验法
【实验准备】
氯化钠固体、蒸馏水、蒸馏水瓶、托盘天平、滤纸片、量筒、烧杯、玻璃棒、药匙、标签纸、细口瓶。
【教学过程】
教学环节 教师活动 学生活动
温故知新 前面我们学习了什么是溶液? 溶液是一种______、______的 混合物;2、物质以______或______形式均匀分散到另一种物质中形成溶液的过程,伴随着能量变化。 3、水溶液的两个性质________、 ________________。 联系第一节的一些知识点,简单回顾。 学生齐答。
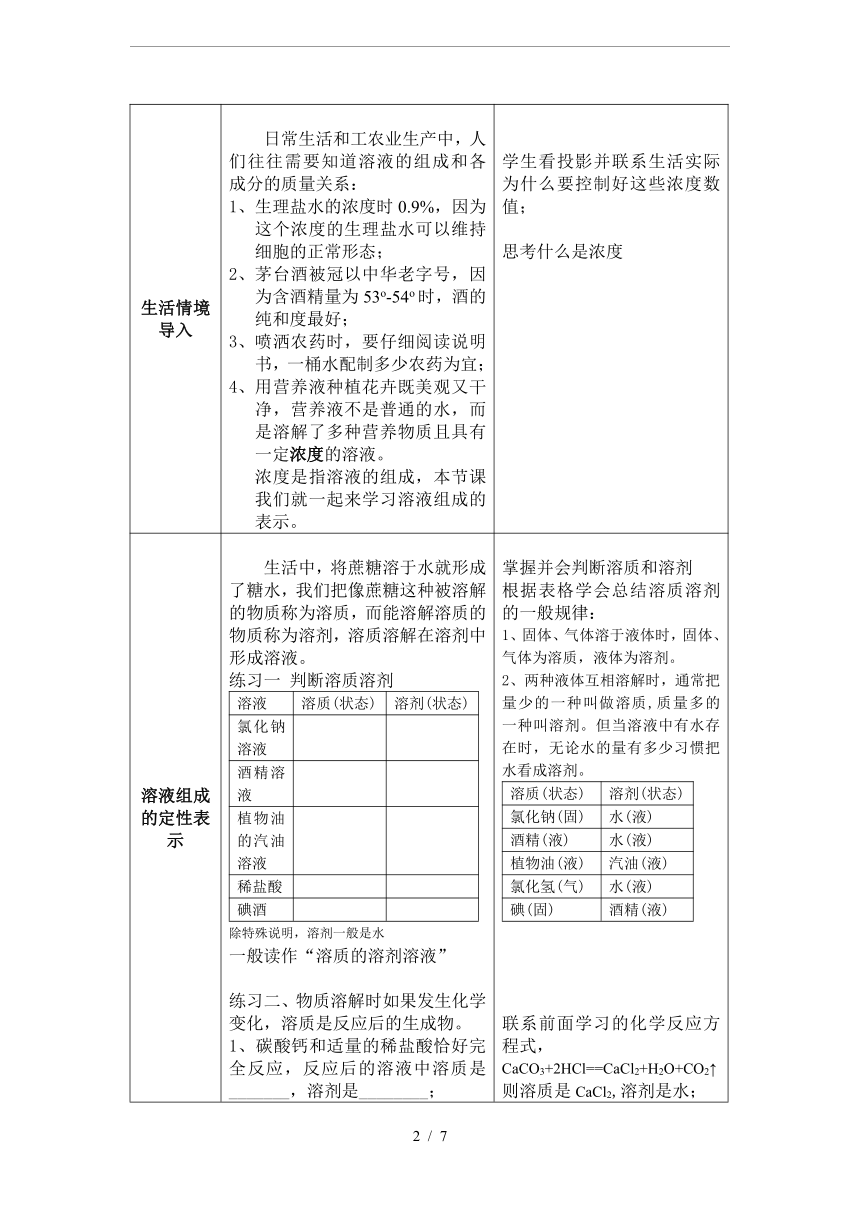
生活情境导入 日常生活和工农业生产中,人们往往需要知道溶液的组成和各成分的质量关系: 生理盐水的浓度时0.9%,因为这个浓度的生理盐水可以维持细胞的正常形态; 茅台酒被冠以中华老字号,因为含酒精量为53o-54o时,酒的纯和度最好; 喷洒农药时,要仔细阅读说明书,一桶水配制多少农药为宜; 用营养液种植花卉既美观又干净,营养液不是普通的水,而是溶解了多种营养物质且具有一定浓度的溶液。 浓度是指溶液的组成,本节课我们就一起来学习溶液组成的表示。 学生看投影并联系生活实际为什么要控制好这些浓度数值; 思考什么是浓度
溶液组成的定性表示 生活中,将蔗糖溶于水就形成了糖水,我们把像蔗糖这种被溶解的物质称为溶质,而能溶解溶质的物质称为溶剂,溶质溶解在溶剂中形成溶液。 练习一 判断溶质溶剂溶液 溶质(状态) 溶剂(状态) 氯化钠溶液 酒精溶液 植物油的汽油溶液 稀盐酸 碘酒 除特殊说明,溶剂一般是水一般读作“溶质的溶剂溶液”练习二、物质溶解时如果发生化学变化,溶质是反应后的生成物。 1、碳酸钙和适量的稀盐酸恰好完全反应,反应后的溶液中溶质是_______,溶剂是________;2、向试管中加入镁条和稀盐酸至恰好完全反应,反应后的溶液中溶质是_______,溶剂是_______。 掌握并会判断溶质和溶剂 根据表格学会总结溶质溶剂的一般规律:1、固体、气体溶于液体时,固体、气体为溶质,液体为溶剂。 2、两种液体互相溶解时,通常把量少的一种叫做溶质,质量多的一种叫溶剂。但当溶液中有水存在时,无论水的量有多少习惯把水看成溶剂。溶质(状态) 溶剂(状态) 氯化钠(固) 水(液) 酒精(液) 水(液) 植物油(液) 汽油(液) 氯化氢(气) 水(液) 碘(固) 酒精(液) 联系前面学习的化学反应方程式,CaCO3+2HCl==CaCl2+H2O+CO2↑ 则溶质是CaCl2,溶剂是水; 结合化学反应方程式:Mg+2HCl== MgCl2+H2↑则溶质是MgCl2,溶剂是水;
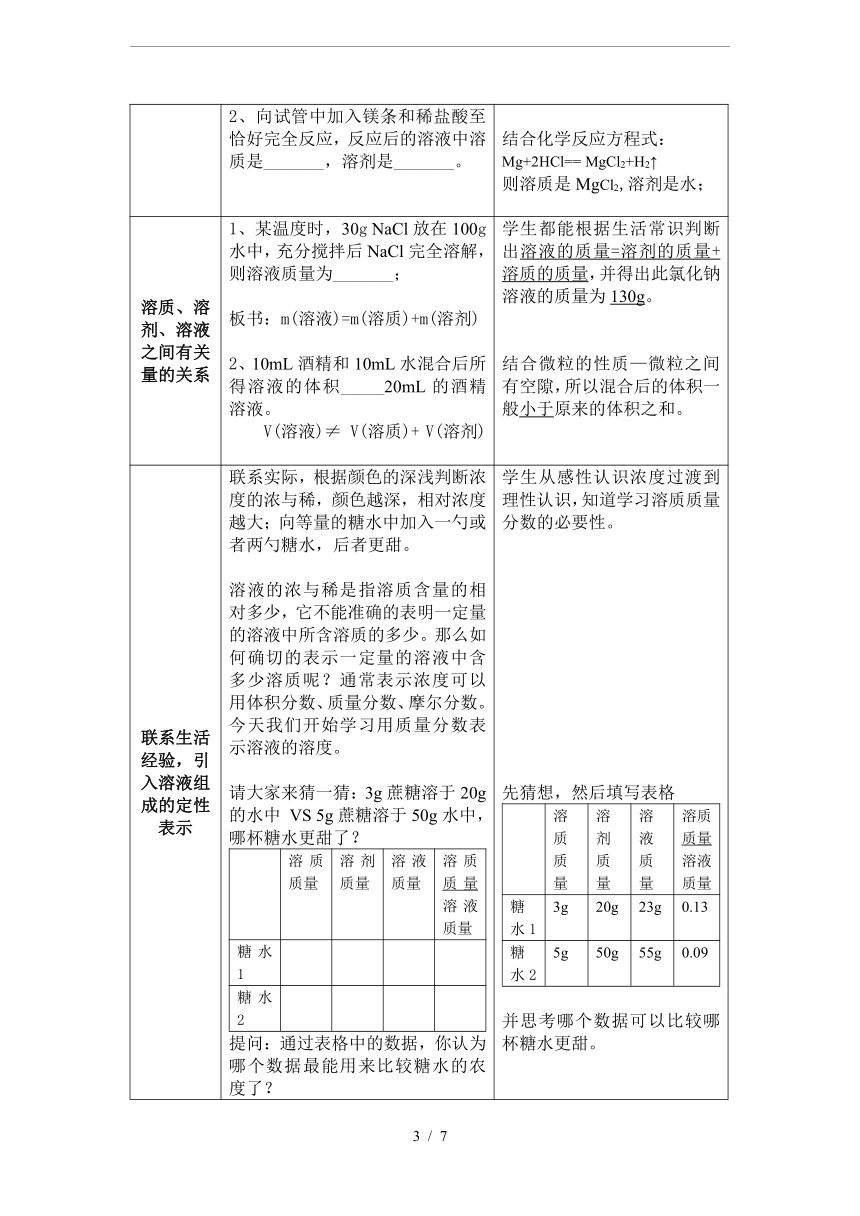
溶质、溶剂、溶液 之间有关量的关系 1、某温度时,30g NaCl放在100g水中,充分搅拌后NaCl完全溶解,则溶液质量为_______; 板书:m(溶液)=m(溶质)+m(溶剂) 2、10mL酒精和10mL水混合后所得溶液的体积_____20mL的酒精溶液。 V(溶液)≠ V(溶质)+ V(溶剂) 学生都能根据生活常识判断出溶液的质量=溶剂的质量+溶质的质量,并得出此氯化钠溶液的质量为130g。 结合微粒的性质—微粒之间有空隙,所以混合后的体积一般小于原来的体积之和。
联系生活经验,引入溶液组成的定性表示 联系实际,根据颜色的深浅判断浓度的浓与稀,颜色越深,相对浓度越大;向等量的糖水中加入一勺或者两勺糖水,后者更甜。 溶液的浓与稀是指溶质含量的相对多少,它不能准确的表明一定量的溶液中所含溶质的多少。那么如何确切的表示一定量的溶液中含多少溶质呢?通常表示浓度可以用体积分数、质量分数、摩尔分数。今天我们开始学习用质量分数表示溶液的溶度。 请大家来猜一猜:3g蔗糖溶于20g的水中 VS 5g蔗糖溶于50g水中,哪杯糖水更甜了? 溶质质量 溶剂质量 溶液质量 溶质质量溶液质量 糖水1 糖水2 提问:通过表格中的数据,你认为哪个数据最能用来比较糖水的农度了? 学生从感性认识浓度过渡到理性认识,知道学习溶质质量分数的必要性。 先猜想,然后填写表格 溶质质量 溶剂质量 溶液质量 溶质质量溶液质量 糖水13g 20g 23g 0.13 糖水25g 50g 55g 0.09 并思考哪个数据可以比较哪杯糖水更甜。
溶液组成的定量表示方法 分析表格中的数据,用溶质质量/溶液质量这组数据最能看出浓度的比较。化学上将溶质质量/溶液质量×100 %这个计算结果叫做溶质的质量分数 板书:溶液中溶质质量分数=m(溶质)/m(溶液)×100 % 例1.在做电解水的实验时,为了增强水的导电性,可在水中加入少量氢氧化钠溶液。将 4g 氢氧化钠固体溶解在 46g 水中,得到的氢氧化钠溶液的溶质质量分数是多少?这个例题主要考察同学们对基本公式的运用,解题的过程中一定要注意格式的规范性。 例2.质量分数的含义 思考:上题中,溶质质量分数为 8 % 的氢氧化钠溶液,表示什么意义呢? 例3.加深概念的理解: 考考你:你会犯错吗? 在100g水中溶解20g食盐,所得溶液的质量分数为20 %。( ) 从100g 4 %的氢氧化钠溶液中取出50g,剩下的溶液中溶质质量分数为2 %。( )例4.解释生活问题:生理盐水标签上0.9%表示什么意义?公式的变换: 1)现有200g 0.9%的氯化钠溶液,则该溶液中所含溶质的质量是 _____g。 2)现有一定量0.9%的氯化钠溶液,其中含溶质氯化钠2.7g,则该溶液的质量是_____g。 例5.巩固升华氯化钠溶液质量 溶剂质量 溶质质量 溶质的质量分数 90g 10g 200g 15% 400g 20g 通过这些基本的练习,相信同学们对溶质质量分数的计算有了基本的认识。 一起理解这个公式是怎么来的,并能够迅速记住最基本的公式。 自己在笔记本上进行初步的计算 解:氯化钠溶液中溶质质量分数=m(NaCl)/m(溶液)×100 % =4g/(4g+46g)×100 % =8 % 答:氯化钠溶液中溶质质量分数为8 %。 简化题目,填空:溶质质量分数为 8 % 的氢氧化钠溶液表示:每 __g 氢氧化钠溶液中溶解 __g 氢氧化钠。即该食盐溶液中溶质、溶剂、溶液之间的质量比是___:___:___ 学生先集体思考,派代表发言:1、错误。应该修改为20g/120g×100 %=16.7 % 2、错误。根据溶液的均一性,各部分浓度应该都是4 %。 不断修正答案,直至说出此表示每100g溶液中含溶质氯化钠0.9g。 根据溶质质量分数的公式灵活变换:m(溶质) = m(溶液)×溶质质量分数m(溶液) =m(溶质)/溶质质量分数 氯化钠溶液质量 溶剂质量 溶质质量 溶质的质量分数 100g 90g 10g 10% 200g 170g 30g 15% 400g 380g 20g 5%
感受溶液--—配制氯化钠 相信现在同学们已经掌握了溶质质量分数的含义,如何配制50g溶质质量分数为5%的食盐溶液了? 我们大家一起来分析一下简要的实验步骤,等会同学们自己操作: 计算,需要溶质___g,整个溶液需要50g,则溶剂的质量为___g。 称量,即要称量固体物质氯化钠2.5g,量取液体水47.5mL。固体物质用天平称量,托盘天平的使用同学们在具体操作中思考。液体用量筒,量筒的读数一定要注意。溶解,这个过程中用玻璃棒不断搅拌。转移,溶解完了之后的溶液应该如何处理了?以便于下次使用,可以装到滴瓶或细口瓶中,还要贴上标签。 实验中的误差分析: 老师刚才也参与到部分学生的实验操作中,有些学生的实验操作不当导致溶质质量分数有偏差,现在我们一起来分析一下哪些方法导致实验误差偏大了? 哪些不当的操作导致误差偏小?可以从溶质和溶剂两方面考虑 巩固练习: 1、实验过程中的误差分析: 称量结束后,有少量固体洒落( )2、量取溶剂时,俯视量筒量取液体( ) 仰视量筒量取液体( ) 3、溶解前,烧杯内壁有蒸馏水( )4、配制一定溶质质量分数的氯化钠溶液的操作步骤见下图,其中正确的操作顺序是 ( )① ② ③ ④ ⑤ 学生4-5人一组合作实验:配制溶质质量分数为5%的食盐溶液50g。 1,计算:溶质需要2.5g 溶剂需要47.5mL 2,称:托盘天平、药匙 量:量筒、蒸馏水瓶操作要点:左物右码,且食盐和砝码要放在相同质量的纸上;量筒的读数要平视凹液面最低处。3,溶解:烧杯、玻璃棒倾倒水要沿杯壁,玻璃棒搅拌,不要碰到杯壁.4,转移到细口瓶内,用玻璃棒引流,在标签纸上写上溶液名称和溶质质量分数贴到细口瓶上。 小组讨论,回顾实验中的每一步,导致误差偏大的原因:1、量取液体时,俯视量筒读数;2、量筒中的水未全部转移。 误差偏小的原因:从溶质考虑1、物码倒置;2、转移固体有损失;3、左盘放纸,右盘未放;从溶液考虑4、烧杯中原来有水;5、仰视读数。 进一步强化实验操作并分析实验中的误差 1、偏小 2、偏大 偏小 3、偏小 4、④⑤①②③
总结提升 本节课我们主要学习了什么了?你有什么收获了? 自我总结更有利于知识的掌握 溶液组成的定量表示 溶液都是由溶质和溶剂组成,且三者质量关系为溶液质量=溶质质量+溶液质量 2、溶液组成的定量表示 溶质质量分数=溶质质量/溶剂质量×100% 3、会配制简单的溶液 实验步骤:计算、称量、 溶解、转移
布置作业 课后独立完成作业
【板书设计】
溶液组成的表示
定性表示方法
溶液:溶质和溶剂组成
m(溶液)=m(溶质)+m(溶剂)
二、定量表示方法
溶液中:溶质质量分数=m(溶质)/m(溶液)×100 %
m(溶质) = m(溶液)×溶质质量分数
m(溶液) =m(溶质)/溶质质量分数
三、溶液的简单配制
计算
称量
溶解
转移
实验误差分析
PAGE / NUMPAGES
