沪教化学下册第6章 溶解现象 复习(第一课时)(共19张PPT)
文档属性
| 名称 | 沪教化学下册第6章 溶解现象 复习(第一课时)(共19张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-16 14:07:05 | ||
图片预览




文档简介
(共19张PPT)
第六章 溶解现象 整理与归纳(第一课时)
沪教2011课标版九年级下册
熟练掌握溶解度曲线的绘制和分析方法,体验数据处理的过程,学习数据处理的方法。
深化理解溶解度曲线中包含的意义,能利用溶解度曲线中的信息解决相关的问题。
运用定量的方法准确判断和精确调控溶液的形成和变化,感受定量研究的重要性。
1
2
3
T
a r g e t
三维目标
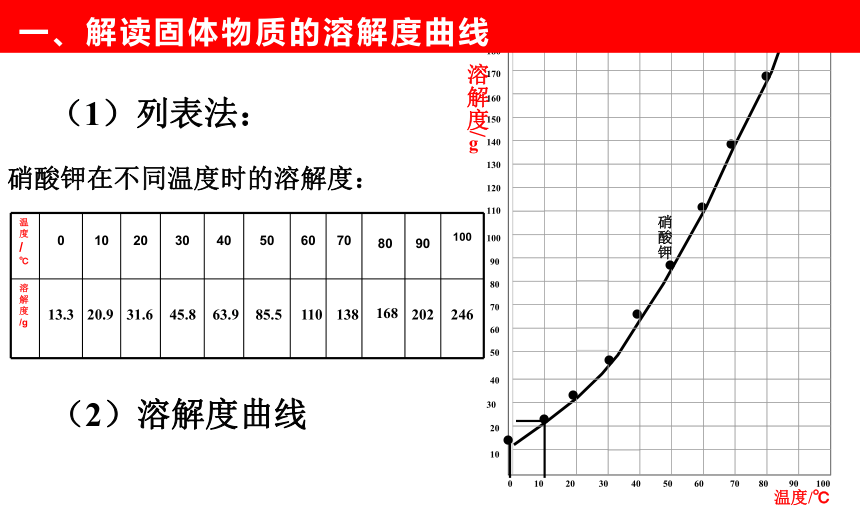
固体物质的溶解度:
一、解读固体物质的溶解度曲线
在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量。
.
.
.
.
.
硝酸钾
.
.
.
.
硝酸钾在不同温度时的溶解度:
13.3
31.6
20.9
45.8
63.9
85.5
110
138
168
202
246
(1)列表法:
(2)溶解度曲线
一、解读固体物质的溶解度曲线
温度/℃ 0 10 20 30 40 50 60 70
80
90 100
溶解度/g
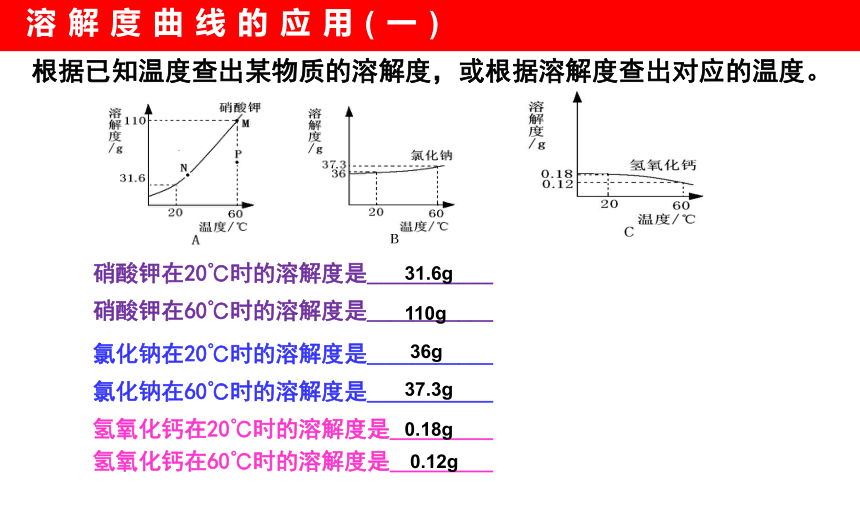
硝酸钾在20℃时的溶解度是___________
硝酸钾在60℃时的溶解度是___________
氯化钠在20℃时的溶解度是___________
氯化钠在60℃时的溶解度是___________
氢氧化钙在20℃时的溶解度是_________
氢氧化钙在60℃时的溶解度是_________
110g
31.6g
36g
37.3g
0.12g
0.18g
根据已知温度查出某物质的溶解度,或根据溶解度查出对应的温度。
溶解度曲线的应用(一)
溶解度曲线的应用(二)
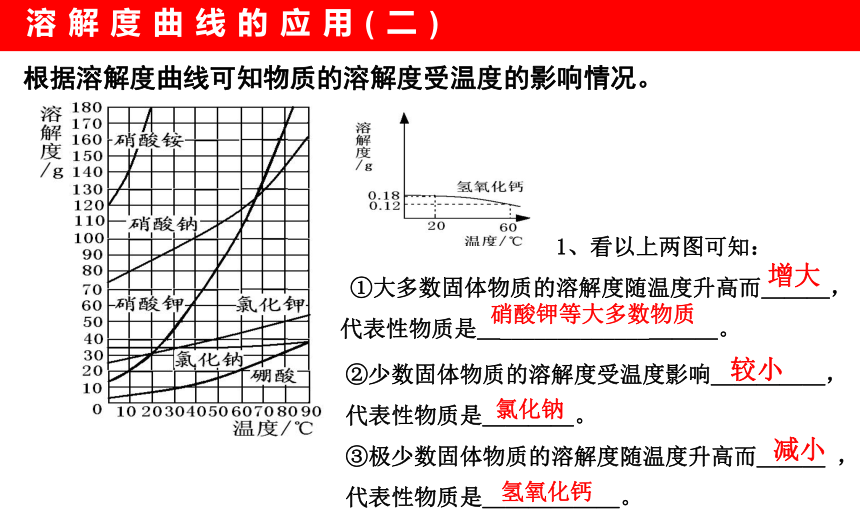
根据溶解度曲线可知物质的溶解度受温度的影响情况。
②少数固体物质的溶解度受温度影响_____,
代表性物质是____。
③极少数固体物质的溶解度随温度升高而___ ,
代表性物质是______。
1、看以上两图可知:
①大多数固体物质的溶解度随温度升高而___,代表性物质是_________________。
增大
较小
减小
硝酸钾等大多数物质
氯化钠
氢氧化钙
溶解度曲线的应用(三)
比较不同物质在同一温度下的溶解度大小,以及两条曲线的交点表示的意义。
结论:两条曲线的交点表示的意义是:
对应温度下两种物质的溶解度____。
1、比较10℃时A、B两物质的溶解度大小:_________
2、比较20℃ <t <30℃区间内A、B两物质的溶解度大小:_________
3、曲线上Q点表示_____________________
B﹥ A
A﹥B
在20℃时,A、B两物质的溶解度相同,都为10g
相同
M点表示的溶液_____(“饱和”“不饱和”),
P点表示溶液______(“饱和”“不饱和”),
P点溶液转化为M点溶液,可采用的方法有_________、____________。
M点溶液转化为P点溶液,可采用中的方法有_______。
M点表示的意义是:_____℃时,在_____g水中,达到______状态,溶解硝酸钾的质量_____g。或说____ ℃时,硝酸钾的溶解度是_______。
根据溶解度曲线可知曲线上和曲线上下部区域点的意义,以及知道点与点的转化方法。
溶解度曲线的应用(四)
60
100
饱和
110
60
110g
饱和
不饱和
增加溶质硝酸钾
蒸发溶剂
增加溶剂
溶解度曲线的应用(五)
蒸发饱和食盐水,一段
时间后,出现的现象是:____________________。
这是用___________法
使饱和溶液析出晶体。
给KNO3的热饱和溶液降温,一段时间后出现的现象是:____________________。
这是用___________法使饱和溶液析出晶体。
【观察与思考】观察下面的实验,思考问题:使饱和溶液析出晶体的方法有哪些?
【结论】
使饱和溶液析出晶体的方法有:①__________法,②____________法。
KNO3的热
饱和溶液
有氯化钠晶体析出
蒸发结晶
有硝酸钾晶体析出
降温结晶
蒸发结晶
降温结晶
利用溶解度曲线确定饱和溶液析出晶体的方法:
溶解度曲线的应用(五)
【讨论】为什么使饱和氯化钠溶液析出晶体用蒸发结晶法,而使饱和硝酸钾溶液析出晶体却用降温结晶法呢?分析下面两个实验,可找到答案。
80℃ KNO3
饱和溶液
80℃NaCl
饱和溶液
大
小
多
少
溶解度曲线的应用(五)
【结论】
使溶解度受温度影响大的物质的饱和溶液析出晶体,最好采用__________法。
使溶解度受温度影响小的物质的饱和溶液析出晶体,最好采用__________法。
【讨论】
饱和溶液降温析出晶体后,所得溶液__________ 。
(“变浓”、“变稀”“浓稀不变”)
饱和溶液蒸发溶剂析出晶体后,所得溶液__________ 。
(“变浓”、“变稀”“浓稀不变”)
【结论】
饱和溶液析出晶体后,所得溶液的浓稀可能_____ ,也可能_____ 。
【温馨告知】
⑴降温或蒸发溶剂有晶体析出的原溶液______(“一定”“不一定”)是饱和溶液。
⑵给氢氧化钙的饱和溶液和硝酸钾的饱和溶液降温,有晶体析出的是_______ 。
所以,给饱和溶液降温________(“一定”“不一定”)有晶体析出。
⑶某物质的饱和溶液析出晶体后,所得溶液____(“是”“不是”)该物质的饱和
溶液。
蒸发结晶
降温结晶
变稀
浓稀不变
变稀
不变
不一定
硝酸钾
不一定
是
溶解度
溶解度曲线的应用(六)
1.____________是定量表示溶液浓稀的,_______是定量表示物质溶解能力大小的。
2.若溶液饱和,溶解度与溶质质量分数的换算关系是
( )
( )= ——————————×100%
100g(水)+( )
?3.讨论:根据右侧溶解度曲线图判断,下列说法正确的是_________。
①t2℃时,A的溶液与B的溶液溶质质量分数相同
②t2℃时,A的饱和溶液与B的饱和溶液溶质质量分数相同
③t3℃时,A的溶液和B的溶液蒸发等量的溶剂,析出的A比B多
④t3℃时,A的饱和溶液和B的饱和溶液蒸发等量溶剂,析出的A比B多
⑤t1℃时,B的溶液比A的溶液所含溶质多
⑥t1℃时,B的饱和溶液比A的饱和溶液所含溶质多
⑦t1℃时,等质量的B的饱和溶液比A的饱和溶液所含溶质多
根据溶解度曲线分析理解溶解度的大小对溶质质量分数的影响。
溶质质量分数
溶质质量分数
溶解度
溶解度
②
④
⑦
饱和
饱和
饱和
溶液质量
20℃时,向Ca(OH)2 饱和溶液中,加入生石灰CaO,绘制从加入CaO至恢复到20℃的过程中,下列物理量随时间的变化图像!
请各小组讨论完成,限时3分钟!
我们议一议!
氢氧化钙的溶解度曲线
1、溶解度曲线——单线型
二、大庆近八年中考试卷分析—高频考点
二、大庆近八年中考试卷分析—高频考点
1、溶解度曲线——双线型
1、溶解度曲线——三线型
二、大庆近八年中考试卷分析—高频考点
宝贝们!想一想这节课你收获了什么?还有哪些疑惑呢?
我们来总结!
二、大庆近八年中考试卷分析—高频考点
1、溶解度曲线——双线型
15.右图是甲、乙两种物质的溶解度曲线。在t2℃时向盛有100g水的烧杯中中先后加入wg甲和wg乙 (两种物质溶解时互不影响),充分搅拌。将混合物的温度降低到 t1℃ ,下列说法中正确的是 ( )
A.甲物质的溶解度随温度升高而小
B.温度降低到 t1℃ 时,得到甲、乙的饱和溶液
C.温度降低到 t1℃ 时、甲、乙的溶质质量分数 相等,得到甲、乙的不饱和溶液
D. t2℃ 时,甲物质的溶液为饱和溶液,乙物质的溶液为不饱和溶液
1、溶解度曲线——三线型
二、大庆近八年中考试卷分析—高频考点
(2014大庆11题)如图a、b、c分别表示KNO3、NaCl,Ca(OH)2的溶解度曲线,下列说法错误的是 ( )
A.T1时,KNO3和NaCl饱和溶液溶质的质量分数相等
B.T2时,A点表示KNO3的不饱和溶液,降温至T1时有晶体析出,且变为T1时KNO3的饱和溶液
C.T1时,将Ca(OH)2饱和溶液升温至T2变为不饱和溶液
D.温度高于T1时,KNO3溶解度大于NaCl溶解度,温度低于T1时,KNO3溶解度小于NaCl溶解度
第六章 溶解现象 整理与归纳(第一课时)
沪教2011课标版九年级下册
熟练掌握溶解度曲线的绘制和分析方法,体验数据处理的过程,学习数据处理的方法。
深化理解溶解度曲线中包含的意义,能利用溶解度曲线中的信息解决相关的问题。
运用定量的方法准确判断和精确调控溶液的形成和变化,感受定量研究的重要性。
1
2
3
T
a r g e t
三维目标
固体物质的溶解度:
一、解读固体物质的溶解度曲线
在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量。
.
.
.
.
.
硝酸钾
.
.
.
.
硝酸钾在不同温度时的溶解度:
13.3
31.6
20.9
45.8
63.9
85.5
110
138
168
202
246
(1)列表法:
(2)溶解度曲线
一、解读固体物质的溶解度曲线
温度/℃ 0 10 20 30 40 50 60 70
80
90 100
溶解度/g
硝酸钾在20℃时的溶解度是___________
硝酸钾在60℃时的溶解度是___________
氯化钠在20℃时的溶解度是___________
氯化钠在60℃时的溶解度是___________
氢氧化钙在20℃时的溶解度是_________
氢氧化钙在60℃时的溶解度是_________
110g
31.6g
36g
37.3g
0.12g
0.18g
根据已知温度查出某物质的溶解度,或根据溶解度查出对应的温度。
溶解度曲线的应用(一)
溶解度曲线的应用(二)
根据溶解度曲线可知物质的溶解度受温度的影响情况。
②少数固体物质的溶解度受温度影响_____,
代表性物质是____。
③极少数固体物质的溶解度随温度升高而___ ,
代表性物质是______。
1、看以上两图可知:
①大多数固体物质的溶解度随温度升高而___,代表性物质是_________________。
增大
较小
减小
硝酸钾等大多数物质
氯化钠
氢氧化钙
溶解度曲线的应用(三)
比较不同物质在同一温度下的溶解度大小,以及两条曲线的交点表示的意义。
结论:两条曲线的交点表示的意义是:
对应温度下两种物质的溶解度____。
1、比较10℃时A、B两物质的溶解度大小:_________
2、比较20℃ <t <30℃区间内A、B两物质的溶解度大小:_________
3、曲线上Q点表示_____________________
B﹥ A
A﹥B
在20℃时,A、B两物质的溶解度相同,都为10g
相同
M点表示的溶液_____(“饱和”“不饱和”),
P点表示溶液______(“饱和”“不饱和”),
P点溶液转化为M点溶液,可采用的方法有_________、____________。
M点溶液转化为P点溶液,可采用中的方法有_______。
M点表示的意义是:_____℃时,在_____g水中,达到______状态,溶解硝酸钾的质量_____g。或说____ ℃时,硝酸钾的溶解度是_______。
根据溶解度曲线可知曲线上和曲线上下部区域点的意义,以及知道点与点的转化方法。
溶解度曲线的应用(四)
60
100
饱和
110
60
110g
饱和
不饱和
增加溶质硝酸钾
蒸发溶剂
增加溶剂
溶解度曲线的应用(五)
蒸发饱和食盐水,一段
时间后,出现的现象是:____________________。
这是用___________法
使饱和溶液析出晶体。
给KNO3的热饱和溶液降温,一段时间后出现的现象是:____________________。
这是用___________法使饱和溶液析出晶体。
【观察与思考】观察下面的实验,思考问题:使饱和溶液析出晶体的方法有哪些?
【结论】
使饱和溶液析出晶体的方法有:①__________法,②____________法。
KNO3的热
饱和溶液
有氯化钠晶体析出
蒸发结晶
有硝酸钾晶体析出
降温结晶
蒸发结晶
降温结晶
利用溶解度曲线确定饱和溶液析出晶体的方法:
溶解度曲线的应用(五)
【讨论】为什么使饱和氯化钠溶液析出晶体用蒸发结晶法,而使饱和硝酸钾溶液析出晶体却用降温结晶法呢?分析下面两个实验,可找到答案。
80℃ KNO3
饱和溶液
80℃NaCl
饱和溶液
大
小
多
少
溶解度曲线的应用(五)
【结论】
使溶解度受温度影响大的物质的饱和溶液析出晶体,最好采用__________法。
使溶解度受温度影响小的物质的饱和溶液析出晶体,最好采用__________法。
【讨论】
饱和溶液降温析出晶体后,所得溶液__________ 。
(“变浓”、“变稀”“浓稀不变”)
饱和溶液蒸发溶剂析出晶体后,所得溶液__________ 。
(“变浓”、“变稀”“浓稀不变”)
【结论】
饱和溶液析出晶体后,所得溶液的浓稀可能_____ ,也可能_____ 。
【温馨告知】
⑴降温或蒸发溶剂有晶体析出的原溶液______(“一定”“不一定”)是饱和溶液。
⑵给氢氧化钙的饱和溶液和硝酸钾的饱和溶液降温,有晶体析出的是_______ 。
所以,给饱和溶液降温________(“一定”“不一定”)有晶体析出。
⑶某物质的饱和溶液析出晶体后,所得溶液____(“是”“不是”)该物质的饱和
溶液。
蒸发结晶
降温结晶
变稀
浓稀不变
变稀
不变
不一定
硝酸钾
不一定
是
溶解度
溶解度曲线的应用(六)
1.____________是定量表示溶液浓稀的,_______是定量表示物质溶解能力大小的。
2.若溶液饱和,溶解度与溶质质量分数的换算关系是
( )
( )= ——————————×100%
100g(水)+( )
?3.讨论:根据右侧溶解度曲线图判断,下列说法正确的是_________。
①t2℃时,A的溶液与B的溶液溶质质量分数相同
②t2℃时,A的饱和溶液与B的饱和溶液溶质质量分数相同
③t3℃时,A的溶液和B的溶液蒸发等量的溶剂,析出的A比B多
④t3℃时,A的饱和溶液和B的饱和溶液蒸发等量溶剂,析出的A比B多
⑤t1℃时,B的溶液比A的溶液所含溶质多
⑥t1℃时,B的饱和溶液比A的饱和溶液所含溶质多
⑦t1℃时,等质量的B的饱和溶液比A的饱和溶液所含溶质多
根据溶解度曲线分析理解溶解度的大小对溶质质量分数的影响。
溶质质量分数
溶质质量分数
溶解度
溶解度
②
④
⑦
饱和
饱和
饱和
溶液质量
20℃时,向Ca(OH)2 饱和溶液中,加入生石灰CaO,绘制从加入CaO至恢复到20℃的过程中,下列物理量随时间的变化图像!
请各小组讨论完成,限时3分钟!
我们议一议!
氢氧化钙的溶解度曲线
1、溶解度曲线——单线型
二、大庆近八年中考试卷分析—高频考点
二、大庆近八年中考试卷分析—高频考点
1、溶解度曲线——双线型
1、溶解度曲线——三线型
二、大庆近八年中考试卷分析—高频考点
宝贝们!想一想这节课你收获了什么?还有哪些疑惑呢?
我们来总结!
二、大庆近八年中考试卷分析—高频考点
1、溶解度曲线——双线型
15.右图是甲、乙两种物质的溶解度曲线。在t2℃时向盛有100g水的烧杯中中先后加入wg甲和wg乙 (两种物质溶解时互不影响),充分搅拌。将混合物的温度降低到 t1℃ ,下列说法中正确的是 ( )
A.甲物质的溶解度随温度升高而小
B.温度降低到 t1℃ 时,得到甲、乙的饱和溶液
C.温度降低到 t1℃ 时、甲、乙的溶质质量分数 相等,得到甲、乙的不饱和溶液
D. t2℃ 时,甲物质的溶液为饱和溶液,乙物质的溶液为不饱和溶液
1、溶解度曲线——三线型
二、大庆近八年中考试卷分析—高频考点
(2014大庆11题)如图a、b、c分别表示KNO3、NaCl,Ca(OH)2的溶解度曲线,下列说法错误的是 ( )
A.T1时,KNO3和NaCl饱和溶液溶质的质量分数相等
B.T2时,A点表示KNO3的不饱和溶液,降温至T1时有晶体析出,且变为T1时KNO3的饱和溶液
C.T1时,将Ca(OH)2饱和溶液升温至T2变为不饱和溶液
D.温度高于T1时,KNO3溶解度大于NaCl溶解度,温度低于T1时,KNO3溶解度小于NaCl溶解度
