第3节 几种重要的盐--复分解反应及其应用课件(18张PPT)
文档属性
| 名称 | 第3节 几种重要的盐--复分解反应及其应用课件(18张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-24 00:00:00 | ||
图片预览




文档简介
(共18张PPT)
复分解反应条件及应用
1、定义:
两种化合物互相交换成分
,生成另外两种化合物的反应
2、通式:
AB+CD
=
3、特点:
双交换、价不变
CB+AD
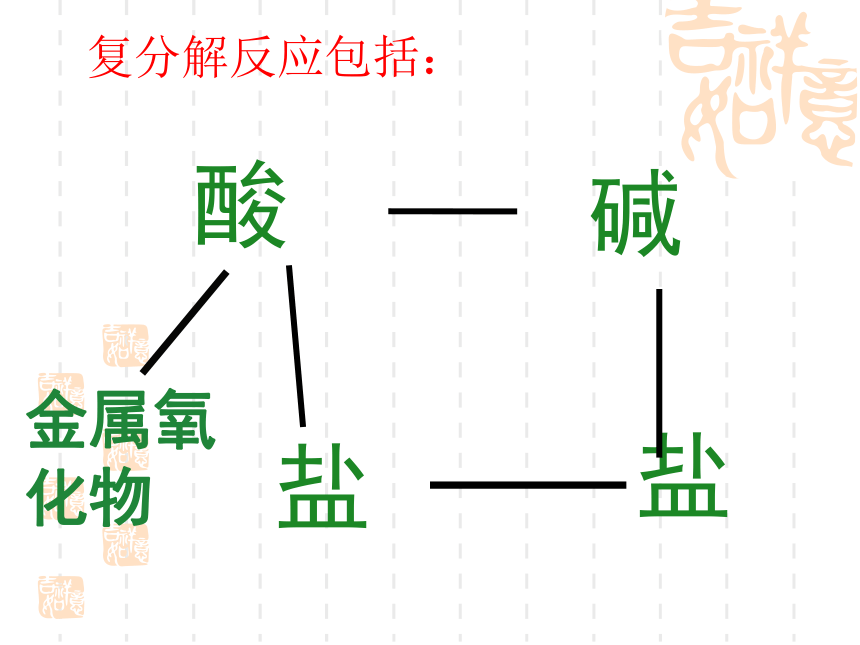
酸
碱
金属氧化物
盐
盐
复分解反应包括:
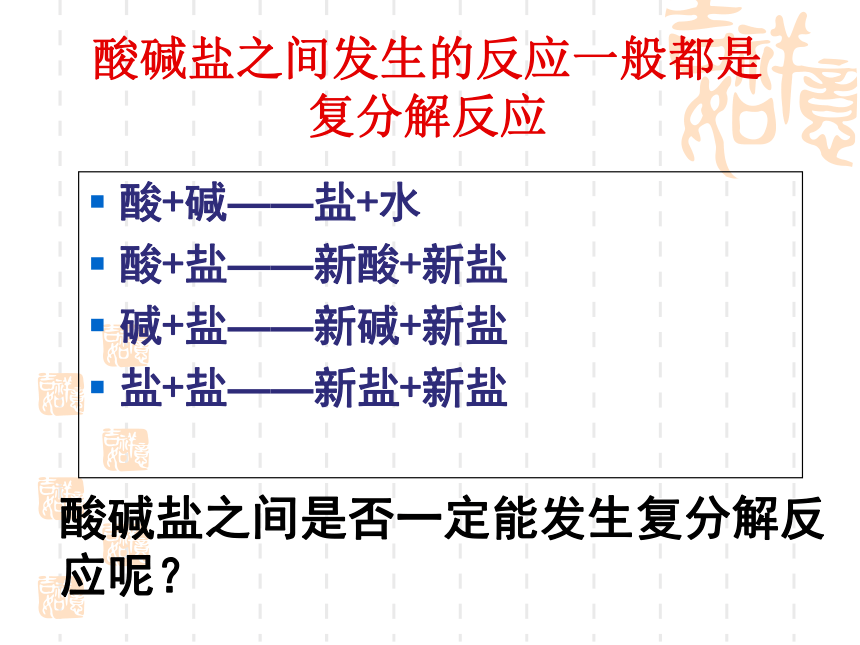
酸+碱——盐+水
酸+盐——新酸+新盐
碱+盐——新碱+新盐
盐+盐——新盐+新盐
酸碱盐之间发生的反应一般都是
复分解反应
酸碱盐之间是否一定能发生复分解反应呢?
1、碳酸钠溶液和稀盐酸混合
2、氯化钡溶液和硫酸钠溶液混合
3、硫酸铜溶液和氢氧化钠溶液混合
4、硝酸银溶液和氯化钠溶液混合
探究活动:
复分解反应要发生,需
要具备一定的条件:
有
沉淀、气体或水生成
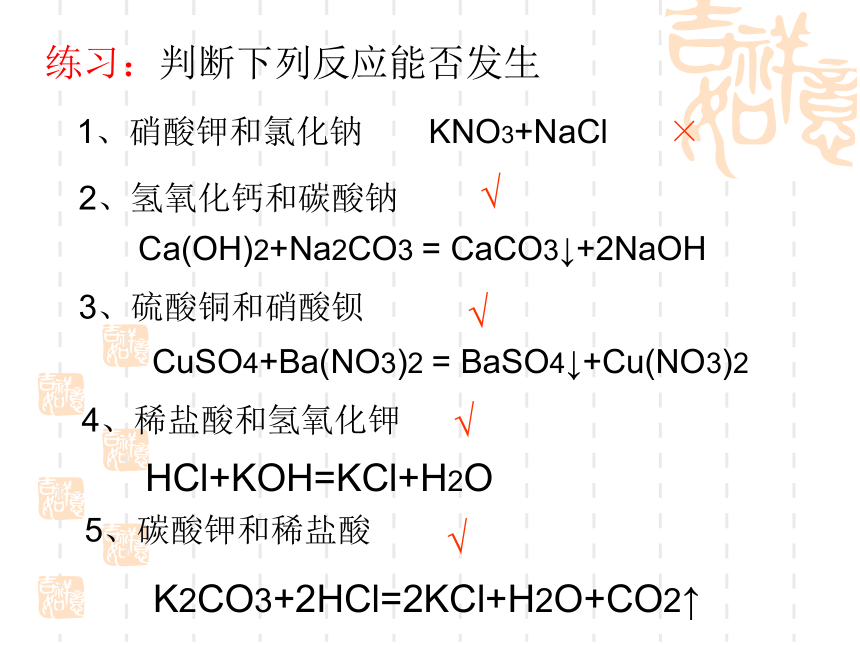
练习:判断下列反应能否发生
1、硝酸钾和氯化钠
KNO3+NaCl
×
2、氢氧化钙和碳酸钠
√
Ca(OH)2+Na2CO3
=
CaCO3↓+2NaOH
3、硫酸铜和硝酸钡
√
CuSO4+Ba(NO3)2
=
BaSO4↓+Cu(NO3)2
4、稀盐酸和氢氧化钾
√
HCl+KOH=KCl+H2O
5、碳酸钾和稀盐酸
√
K2CO3+2HCl=2KCl+H2O+CO2↑
看图探究
Na+
Na+
CO32-
Cl-
H+
Cl-
H+
H2O
碳酸钠和稀盐酸反应
CO2
实质:
旁观者:
Cl-和Na+
CO2
看图探究
Ba2+
SO42-
Cl-
Cl-
Na+
Na+
BaSO4
氯化钡与硫酸钠反应
实质:
旁观者:
Cl-和Na+
Na+
OH-
H+
Cl-
H2O
NaOH溶液和稀盐酸反应
看图探究
实质:
旁观者:
Cl
-和Na+
思维冲浪
通过上面的知识积累,你能整理出几种常见不共存离子吗?
(1)生成沉淀:
沉淀:
Cu2+
Fe3+
Al3+
Mg2+
OH-
2OH-
+
Cu2+=Cu(OH)2↓(蓝色)
3OH-
+
Fe3+=
Fe(OH)3
↓
(红褐色)
3OH-
+
Al3+=Al(OH)3
↓
2OH-+
Mg2+=Mg(OH)2↓
Ba2+
+SO42-=BaSO4↓
Ag++Cl-=AgCl↓
CO32-+Ca2+=CaCO3↓
CO32-
+Ba2+=BaCO3↓
(2)生成气体
CO32-
HCO3-
H+
2H++
CO32-
=
CO2↑+H2O
H++
HCO3-
=
CO2↑+H2O
H++OH-
=
H2O
OH-
+NH4+=
NH3·H2O=
NH3
↑
+H2O
NH4+与
OH
(3)生成水
例1、下列各组物质,能共同存在于水溶液中的是(
)
A.
H2SO4
Na2CO3
KOH
B.MgCl2
CuSO4
NaNO3
C.AgNO3
BaCl2
K2SO4
D.HCl
K2CO3
NaNO3
例2、下列各组离子能在同一种溶液中大量共存的是(
)
A.H+、Na+、Cl-、CO32-
B.NH4+、Cl-、K+、OH-
C.Na+、K+、Cu2+、Cl-
D.Ag+、H+、NO3-、Cl-
B
C
3.下列离子能在PH<7的溶液中大量共存,并形成
无色溶液的是(
)
A、Cu2+、SO42-、Na+、OH-
B、K+、Na+、CO32-、Cl-
C、K+、Fe3+、NO3-、SO42-
D、Na+、Cl-、K+、NO3-
D
谢谢大家
复分解反应条件及应用
1、定义:
两种化合物互相交换成分
,生成另外两种化合物的反应
2、通式:
AB+CD
=
3、特点:
双交换、价不变
CB+AD
酸
碱
金属氧化物
盐
盐
复分解反应包括:
酸+碱——盐+水
酸+盐——新酸+新盐
碱+盐——新碱+新盐
盐+盐——新盐+新盐
酸碱盐之间发生的反应一般都是
复分解反应
酸碱盐之间是否一定能发生复分解反应呢?
1、碳酸钠溶液和稀盐酸混合
2、氯化钡溶液和硫酸钠溶液混合
3、硫酸铜溶液和氢氧化钠溶液混合
4、硝酸银溶液和氯化钠溶液混合
探究活动:
复分解反应要发生,需
要具备一定的条件:
有
沉淀、气体或水生成
练习:判断下列反应能否发生
1、硝酸钾和氯化钠
KNO3+NaCl
×
2、氢氧化钙和碳酸钠
√
Ca(OH)2+Na2CO3
=
CaCO3↓+2NaOH
3、硫酸铜和硝酸钡
√
CuSO4+Ba(NO3)2
=
BaSO4↓+Cu(NO3)2
4、稀盐酸和氢氧化钾
√
HCl+KOH=KCl+H2O
5、碳酸钾和稀盐酸
√
K2CO3+2HCl=2KCl+H2O+CO2↑
看图探究
Na+
Na+
CO32-
Cl-
H+
Cl-
H+
H2O
碳酸钠和稀盐酸反应
CO2
实质:
旁观者:
Cl-和Na+
CO2
看图探究
Ba2+
SO42-
Cl-
Cl-
Na+
Na+
BaSO4
氯化钡与硫酸钠反应
实质:
旁观者:
Cl-和Na+
Na+
OH-
H+
Cl-
H2O
NaOH溶液和稀盐酸反应
看图探究
实质:
旁观者:
Cl
-和Na+
思维冲浪
通过上面的知识积累,你能整理出几种常见不共存离子吗?
(1)生成沉淀:
沉淀:
Cu2+
Fe3+
Al3+
Mg2+
OH-
2OH-
+
Cu2+=Cu(OH)2↓(蓝色)
3OH-
+
Fe3+=
Fe(OH)3
↓
(红褐色)
3OH-
+
Al3+=Al(OH)3
↓
2OH-+
Mg2+=Mg(OH)2↓
Ba2+
+SO42-=BaSO4↓
Ag++Cl-=AgCl↓
CO32-+Ca2+=CaCO3↓
CO32-
+Ba2+=BaCO3↓
(2)生成气体
CO32-
HCO3-
H+
2H++
CO32-
=
CO2↑+H2O
H++
HCO3-
=
CO2↑+H2O
H++OH-
=
H2O
OH-
+NH4+=
NH3·H2O=
NH3
↑
+H2O
NH4+与
OH
(3)生成水
例1、下列各组物质,能共同存在于水溶液中的是(
)
A.
H2SO4
Na2CO3
KOH
B.MgCl2
CuSO4
NaNO3
C.AgNO3
BaCl2
K2SO4
D.HCl
K2CO3
NaNO3
例2、下列各组离子能在同一种溶液中大量共存的是(
)
A.H+、Na+、Cl-、CO32-
B.NH4+、Cl-、K+、OH-
C.Na+、K+、Cu2+、Cl-
D.Ag+、H+、NO3-、Cl-
B
C
3.下列离子能在PH<7的溶液中大量共存,并形成
无色溶液的是(
)
A、Cu2+、SO42-、Na+、OH-
B、K+、Na+、CO32-、Cl-
C、K+、Fe3+、NO3-、SO42-
D、Na+、Cl-、K+、NO3-
D
谢谢大家
