第3节 化学方程式 作业设计
图片预览




文档简介
(
…………○…………外…………○…………装…………○…………订…………○…………线…………○…………
) (
※※请※※不※※要※※在※※装※※订※※线※※内※※答※※题※※
) (
…………○…………内…………○…………装…………○…………订…………○…………线…………○…………
)
第三节 化学方程式
一、单选题
1.建立模型是学习科学的重要方法,在理解化学反应的本质时往往引入模型。下图是某反应的微观模型,有关该模型的叙述中,正确的是(? ? ? ? ? )
A.?反应前后分子数目不变?????????????????B.?反应前后原子种类发生改变
C.?和化学性质相似??????D.?是保持氧气化学性质的微粒
2.表示氢原子,表示氧原子,它们组成的分子发生了如图所示的反应。关于该反应的说法不正确的是(?? ? ? ? ? )
A.?该反应属于化合反应?????????????????????B.?反应前后元素种类没有改变
C.?原子在化学反应中不能再分???????????????D.?反应前后分子的种类没有改变
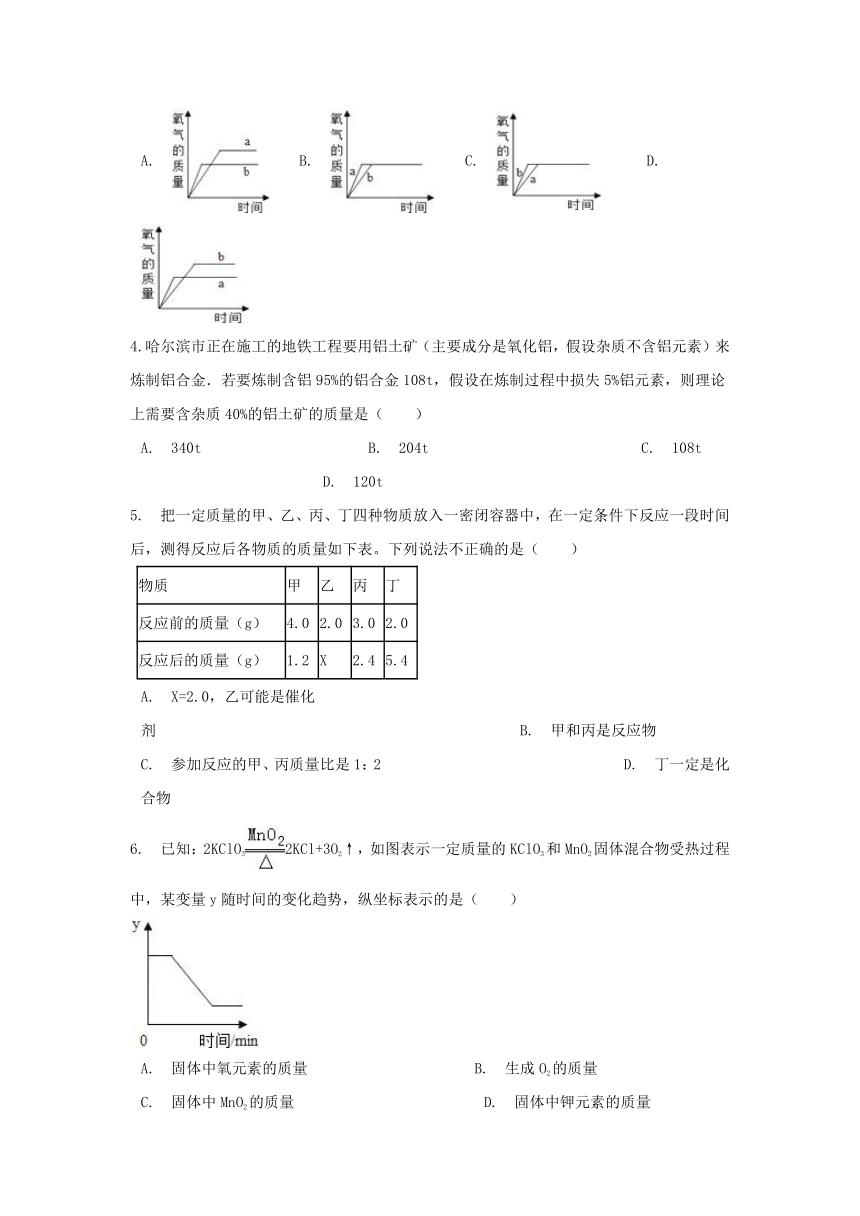
3.a和b为两份质量相等的固体,已知a为氯酸钾,b为混有少量二氧化锰的氯酸钾。当分别同时加热a和b至完全反应时,能正确表示生成氧气的质量随反应时间而变化的图象是( )
A.???B.???C.????D.?
4.哈尔滨市正在施工的地铁工程要用铝土矿(主要成分是氧化铝,假设杂质不含铝元素)来炼制铝合金.若要炼制含铝95%的铝合金108t,假设在炼制过程中损失5%铝元素,则理论上需要含杂质40%的铝土矿的质量是( )
A.?340t???????????B.?204t??????????????C.?108t?????????????D.?120t
5.?把一定质量的甲、乙、丙、丁四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下表。下列说法不正确的是( )
物质 甲 乙 丙 丁
反应前的质量(g) 4.0 2.0 3.0 2.0
反应后的质量(g) 1.2 X 2.4 5.4
A.?X=2.0,乙可能是催化剂????????????????????????B.?甲和丙是反应物
C.?参加反应的甲、丙质量比是1:2????????????????D.?丁一定是化合物
6.?已知:2KClO32KCl+3O2↑,如图表示一定质量的KClO3和MnO2固体混合物受热过程中,某变量y随时间的变化趋势,纵坐标表示的是( )
A.?固体中氧元素的质量?????? B.?生成O2的质量???????
C.?固体中MnO2的质量??????? D.?固体中钾元素的质量
7.?在不同时刻,某反应中的甲、乙、丙、丁四种物质的质量如下表.已知甲的相对分子质量为丁的2倍.则下列说法不正确的是( )
甲的质量/g 乙的质量/g 丙的质量/g 丁的质量/g
反应前 64 10 1 16
t时刻 32 a
反应后 0 54 b 0
A.?乙和丙为生成物 ? B.?a等于32
C.?b等于37????????????????????? D.?该反应方程式中甲与丁的化学计量数之比为1:2
8.?质量守恒定律是帮助我们认识化学反应实质的重要理论.某物质R与水和氧气反应的化学方程式为:2R+2H2O+7O2═2FeSO4+2H2SO4则R的化学式应为( )
A.?FeS?????????B.?Fe2S3? ?????? C.?FeO????????D.?FeS2
9.在反应2A+3B===2C+4D中,若 A、B、C、D的质量比为8∶12∶11∶9,则A、B、C、D的相对分子质量之比为(??? )
A.?8∶12∶11∶9?? ? ?B.?16∶36∶22∶36?? C.?16∶16∶22∶9??? D.?2∶3∶2∶4
10.下列化合物在氧气中燃烧,生成CO2和H2O的质量比为22∶9的是(??? )
A.?CH4?? ?B.?C6H12O6??? ??????C.?C2H5OH???????????D.?C2H6
11.?如图为某化学反应的微观模拟图,“○”和“●”分别表示两种不同的原子,下列说法正确的是( )
A.?该反应的基本反应类型为置换反应
B.?反应前后原子的种类和数目保持不变
C.?由大量微观甲“?”聚集成的物质是单质
D.?参加反应的甲、乙两种反应物的分子个数比为1:1
12.下列制备氧气的反应中,用等质量的反应物能获得氧气最多的是( )
A.?2H2O2 2H2O+O2↑?????????????????????B.?2KClO3 2KCl+3O2↑
C.?2H2O 2H2↑+O2↑????????????????????D.?2KMnO4 △ K2MnO4+MnO2+O2↑
13.乙醇在一定量的氧气中燃烧,测得反应前后各物质的质量如表所示
?
下列判断正确的是( )
A.?表中a的值为2.6??????? B.?X一定是该反应的催化剂???????
C.?X不一定含有碳元素??????? D.?X一定不含氮元素
14.某密闭容器中有X、氧气和二氧化碳三种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表.根据表中信息,判断下列说法正确的是( )
?
A.?该反应为置换反应????????????????????B.?X中一定含有碳、氢两种元素
C.?表中“待测”值为5??????????????????D.?反应生成的CO2和H2O的质量比为45:36
15.某物质在氧气中充分燃烧后生成二氧化碳和水,则该物质( ? ? )
A.?只含有碳、氢两种元素????????????????? B.?一定含有碳、氢、氧三种元素
C.?一定含有碳、氢两种元素,可能含有氧元素?????D.?可能由氧元素与另一种元素组成
二、填空题
16.在一密闭容器内盛有20gH2、O2、N2的混合气体,在实验室中某同学误加热此容器,混合气体发生了爆炸,冷却后,测知生成的H2O为18g,请帮助该同学判断一下,剩余气体是________。
17.(1)某钢铁厂若需消耗500t含Fe2O396%的赤铁矿石,该厂理论上可产含Fe98%的生铁________?t。
(2)用上述得到的生铁与足量的废硫酸反应,可得硫酸亚铁的质量是________?t。
18.?现有在敞口容器中放置的氢氧化钠固体,分析得知含水6.62%、碳酸钠2.38%、氢氧化钠91%.将此样品1g放入烧杯中,然后向其中加入46克溶质质量分数为3.65%的稀盐酸,过量的稀盐酸用溶质质量分数为4.43%的氢氧化钠溶液恰好中和,用去氢氧化钠的溶液20.5g.蒸干中和后的溶液,可得到固体的质量为 ________?g。
19.?碲(Te)被誉为“现代工业、国防与尖端技术的维生素,创造人间奇迹的桥梁”.实验室模拟提取碲的一个实验是:取某含碲溶液于烧瓶中,加入适量NaC1,加热到一定温度,持续通入SO2 , 待反应一定时间,过滤得到粗碲。
(1)反应的总化学方程式为:TeOSO4+2SO2+3XTe↓+3H2SO4,则X为________?(填化学式)。
(2)为探究获得较高粗碲沉淀率的反应条件,某研究小组在控制NaC1浓度和SO2流量不变的条件下,进行下述对比试验,数据如下:
实验 温度/℃ 反应时间/h 粗蹄沉淀率
a 65 3.0 65.0
b 80 3.0 98.9
c 80 2.0 98.9
d 90 2.0 97.0
①该小组研究的反应条件是________和________ 。
②实验a和b的目的是________ 。
③在上述四组实验中,最佳的反应条件是________?℃和________?h。
④为了提升设备利用效率和节约能源,可进一步优化反应条件测定粗碲沉淀率.若再设计对比实验,选择的反应条件还可以是________?(填选项)。
A.80℃,1.5h?? B.80℃,2.5h??? C.70℃,2.0h??? D.95℃,2.0h.
20.?(1)下列氮肥含氮量由高到低是排列顺序是:________? (用序号表示)。
常见氮肥 ①NH4NO3 ②NH4HCO3 ③CO(NH2)2
相对分子质量 80 79 60
(2)治理汽车尾气中的NO和CO的一种方法是:在汽车的排气管上装一个催化转化装置。使NO和CO反应生成N2和CO2 , 写出该反应的化学方程式 ________?。
(3)有机物中碳氢化合物可用CxHy表示,其完全燃烧的化学方程式:CxHy+(x+)O2xCO2+H2O.判断等质量的①CH4 , ②C2H2 , ③C2H4 , 三种碳氢化合物完全燃烧消耗氧气由大到小的顺序是________?。(用序号表示)
21.?能源是人类生存和发展的基础,能源成为人们日益关注的问题。
(1)化石燃料包括煤、________?、天然气等,是重要的能源;目前正在利用和开发的新能源有核能、生物质能、________?(填一种)等。
(2)发射卫星的火箭可使用液氢作燃料,液氢在液氧中燃烧的化学方程式为________?,该反应属于基本反应类型中的________反应。
(3)物质R是一种可再生绿色能源,其燃烧的化学方程式为R+3O22CO2+3H2O,则R的化学式为________。
22.下列化学方程式正确的是________。
A.Cu+2HCl=CuCl2+H2↑???????????? B.Zn+2HNO3=Zn(NO3)2+H2↑
C.2Fe+3H2SO4=Fe2(SO4)3+3H2↑?????? D.SO2+2NaOH=Na2SO4+H2O
E.Cu+2AgCl=CuCl2+2Ag???????????? F.Cu(OH)2+Na2CO3=CuCO3↓+2NaOH
G.2Fe+3CuCl2=2FeCl3+3Cu?????????? H.Ba(NO3)2+CuSO4=Cu(NO3)2+BaSO4↓
23.某元素R的化合价无变价,已知其氧化物的式量为m,其氯化物的式量为n。则R的化合价为________。
24.学校运动会上短跑项目“发令枪”里的火药成分为KClO3 , MnO2和红磷,当扣动扳机时,①撞针撞击火药,产生热量使KClO3分解产生O2②并引燃红磷产生白烟.试分别写这两步反应的化学方程式。
①________; ②________基本反应类型是________。
25.以氧化铜、铁、稀硫酸三种物质为原料,设计两种不同的方法制取铜,写出有关的化学方程式。
方法一:________;
方法二:________。
三、实验探究题
26.科学研究小组的同学在用一定浓度的硫酸溶液处理废金属材料(主要是生铁、镀锌铁皮)时,溶液发烫并闻到了刺激性气味,这种反常现象引起了同学们的思考。从组成物质的元素角度分析,他们猜测气体可能是SO2、CO、CO2、H2中的一种或几种。为了确定该气体的成分,他们进行了如下探究。查阅资料:I.SO2、CO2都能与碱溶液反应生成盐和水,CaSO3难溶于水;II.SO2能与酸性高锰酸钾溶液反应并使它褪色,上述其它气体不能。
实验探究:
(1)甲同学为了验证处理废金属材料产生的气体中是否含有CO2 , 把它直接通入澄清石灰水,并观察实验现象。乙同学认为甲同学的做法不合理。请用化学方程式表示其原因________。
(2)同学们设计了一套合理的实验装置,如下图所示(铁架台已略去)。
请你从下列试剂中选择所需药品并完成实验(药品可重复选用):澄清石灰水、氢氧化钠溶液、酸性高锰酸钾溶液、浓硫酸、无水硫酸铜、碱石灰(假设每步反应都是完全的)
①写出E装置中试剂的名称或化学式________。
②若观察到________(填装置序号)中澄清石灰水变浑浊,证明原气体中有CO2。
③若观察到________的现象,证明原气体中有H2无CO。
27.小明同学学习了氢氧化钙和氢氧化钠的化学性质后知道:氢氧化钙和氢氧化钠都能与二氧化碳反应,二氧化碳通入澄清石灰水中能产生明显的现象。于是小明同学提出了一个问题:________?小明同学联想到在做“固体碘溶解在酒精中”的实验时,酒精作为溶剂能溶解固体碘。酒精能否溶解氢氧化钠和碳酸钠呢?小明查阅资料并通过实验获知:氢氧化钠不与酒精发生化学反应,但能溶解在酒精中形成无色透明的溶液,氢氧化钠的酒精溶液与氢氧化钠的水溶液化学性质相似,碳酸钠不与酒精反应也不溶于酒精。
至此,小明同学对自己提出的问题有了清晰的解决方案。
小明同学的解决方案是________。
写出解决方案中涉及到的化学方程式:________。
28.?据图中的实验常用仪器回答有关问题.
(1)仪器F的名称是________?。
(2)若用KMnO4加热制取氧气,应选用上述仪器中的________?(填序号);其化学反应方程式为________?;当用铁夹固定好试管后,要使试管口略低于试管底部,应调节螺旋________?(填“K1”、“K2”或“K3”);要调节试管与酒精灯相对高度,应调节螺旋________?(填“K1”、“K2”或“K3”)。
(3)若用废铁片与稀盐酸反应制取氢气,并装配一个使反应随时发生和停止的装置,应选上述仪器中的 ________?(填序号);若需测量收集到氢气的体积,则收集的仪器应选 ________?(填序号)。
(4)如图为某同学制作的微型实验装置(夹持仪器略).甲酸与热的浓硫酸反应的方程式为:
①HCOOHX+CO↑,则X是 ________?(填化学式);
②氧化铜的颜色变化为________?,其化学反应方程式为 ________?。
③此实验装置的主要优点是环保,其理由是________?(只写一点)。
参考答案
一、单选题
1.D 2.D 3.A 4.A 5.C 6.A 7.D 8.D 9.C 10.B 11.B 12.C 13.D 14.B 15.C
二、填空题
16. 2gN2或N2和H2的混合气体或N2和O2的混合气体
17. (1)342.9;(2)912.1
18. 2.691
19.(1) H2O;(2)①温度;反应时间;②比较相同时间,不同的反应温度对粗碲沉淀率的影响;③80℃;2.0h;④A
20.(1)③①②;(2)2CO+2NO2CO2+N2;(3)①③②
21.(1)石油;太阳能;(2)2H2+O2?2H2O;化合;(3)C2H5OH(或C2H6O)
22. H
23. 或
24. ①2KClO3 2KCl+3O2↑;②4P+5O2 2P2O5;化合反应
25.①Fe+H2SO4═FeSO4+H2↑;H2+CuO Cu+H2O;②CuO+H2SO4═CuSO4+H2O;CuSO4+Fe═FeSO4+Cu
三、实验探究题
26.(1)SO2+Ca(OH)2=CaSO3↓+H2O
(2)CuSO4;B;D装置中黑色粉末变成红色,E中的无水硫酸铜变蓝,F中的石灰水没有变化
27.能否让二氧化碳与氢氧化钠反应产生明显的现象;将二氧化碳通入氢氧化钠的酒精溶液中;CO2+2NaOH=Na2CO3↓+H2O
28.(1)量筒
(2)ABE;2KMnO4K2MnO4+MnO2+O2↑;K2;K1
(3)CDI;FGH
(4)①H2O;②黑色变红色;CO+CuOCu+CO2;③一氧化碳被点燃生成二氧化碳,不污染环境,并且节约能源
…………○…………外…………○…………装…………○…………订…………○…………线…………○…………
) (
※※请※※不※※要※※在※※装※※订※※线※※内※※答※※题※※
) (
…………○…………内…………○…………装…………○…………订…………○…………线…………○…………
)
第三节 化学方程式
一、单选题
1.建立模型是学习科学的重要方法,在理解化学反应的本质时往往引入模型。下图是某反应的微观模型,有关该模型的叙述中,正确的是(? ? ? ? ? )
A.?反应前后分子数目不变?????????????????B.?反应前后原子种类发生改变
C.?和化学性质相似??????D.?是保持氧气化学性质的微粒
2.表示氢原子,表示氧原子,它们组成的分子发生了如图所示的反应。关于该反应的说法不正确的是(?? ? ? ? ? )
A.?该反应属于化合反应?????????????????????B.?反应前后元素种类没有改变
C.?原子在化学反应中不能再分???????????????D.?反应前后分子的种类没有改变
3.a和b为两份质量相等的固体,已知a为氯酸钾,b为混有少量二氧化锰的氯酸钾。当分别同时加热a和b至完全反应时,能正确表示生成氧气的质量随反应时间而变化的图象是( )
A.???B.???C.????D.?
4.哈尔滨市正在施工的地铁工程要用铝土矿(主要成分是氧化铝,假设杂质不含铝元素)来炼制铝合金.若要炼制含铝95%的铝合金108t,假设在炼制过程中损失5%铝元素,则理论上需要含杂质40%的铝土矿的质量是( )
A.?340t???????????B.?204t??????????????C.?108t?????????????D.?120t
5.?把一定质量的甲、乙、丙、丁四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下表。下列说法不正确的是( )
物质 甲 乙 丙 丁
反应前的质量(g) 4.0 2.0 3.0 2.0
反应后的质量(g) 1.2 X 2.4 5.4
A.?X=2.0,乙可能是催化剂????????????????????????B.?甲和丙是反应物
C.?参加反应的甲、丙质量比是1:2????????????????D.?丁一定是化合物
6.?已知:2KClO32KCl+3O2↑,如图表示一定质量的KClO3和MnO2固体混合物受热过程中,某变量y随时间的变化趋势,纵坐标表示的是( )
A.?固体中氧元素的质量?????? B.?生成O2的质量???????
C.?固体中MnO2的质量??????? D.?固体中钾元素的质量
7.?在不同时刻,某反应中的甲、乙、丙、丁四种物质的质量如下表.已知甲的相对分子质量为丁的2倍.则下列说法不正确的是( )
甲的质量/g 乙的质量/g 丙的质量/g 丁的质量/g
反应前 64 10 1 16
t时刻 32 a
反应后 0 54 b 0
A.?乙和丙为生成物 ? B.?a等于32
C.?b等于37????????????????????? D.?该反应方程式中甲与丁的化学计量数之比为1:2
8.?质量守恒定律是帮助我们认识化学反应实质的重要理论.某物质R与水和氧气反应的化学方程式为:2R+2H2O+7O2═2FeSO4+2H2SO4则R的化学式应为( )
A.?FeS?????????B.?Fe2S3? ?????? C.?FeO????????D.?FeS2
9.在反应2A+3B===2C+4D中,若 A、B、C、D的质量比为8∶12∶11∶9,则A、B、C、D的相对分子质量之比为(??? )
A.?8∶12∶11∶9?? ? ?B.?16∶36∶22∶36?? C.?16∶16∶22∶9??? D.?2∶3∶2∶4
10.下列化合物在氧气中燃烧,生成CO2和H2O的质量比为22∶9的是(??? )
A.?CH4?? ?B.?C6H12O6??? ??????C.?C2H5OH???????????D.?C2H6
11.?如图为某化学反应的微观模拟图,“○”和“●”分别表示两种不同的原子,下列说法正确的是( )
A.?该反应的基本反应类型为置换反应
B.?反应前后原子的种类和数目保持不变
C.?由大量微观甲“?”聚集成的物质是单质
D.?参加反应的甲、乙两种反应物的分子个数比为1:1
12.下列制备氧气的反应中,用等质量的反应物能获得氧气最多的是( )
A.?2H2O2 2H2O+O2↑?????????????????????B.?2KClO3 2KCl+3O2↑
C.?2H2O 2H2↑+O2↑????????????????????D.?2KMnO4 △ K2MnO4+MnO2+O2↑
13.乙醇在一定量的氧气中燃烧,测得反应前后各物质的质量如表所示
?
下列判断正确的是( )
A.?表中a的值为2.6??????? B.?X一定是该反应的催化剂???????
C.?X不一定含有碳元素??????? D.?X一定不含氮元素
14.某密闭容器中有X、氧气和二氧化碳三种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表.根据表中信息,判断下列说法正确的是( )
?
A.?该反应为置换反应????????????????????B.?X中一定含有碳、氢两种元素
C.?表中“待测”值为5??????????????????D.?反应生成的CO2和H2O的质量比为45:36
15.某物质在氧气中充分燃烧后生成二氧化碳和水,则该物质( ? ? )
A.?只含有碳、氢两种元素????????????????? B.?一定含有碳、氢、氧三种元素
C.?一定含有碳、氢两种元素,可能含有氧元素?????D.?可能由氧元素与另一种元素组成
二、填空题
16.在一密闭容器内盛有20gH2、O2、N2的混合气体,在实验室中某同学误加热此容器,混合气体发生了爆炸,冷却后,测知生成的H2O为18g,请帮助该同学判断一下,剩余气体是________。
17.(1)某钢铁厂若需消耗500t含Fe2O396%的赤铁矿石,该厂理论上可产含Fe98%的生铁________?t。
(2)用上述得到的生铁与足量的废硫酸反应,可得硫酸亚铁的质量是________?t。
18.?现有在敞口容器中放置的氢氧化钠固体,分析得知含水6.62%、碳酸钠2.38%、氢氧化钠91%.将此样品1g放入烧杯中,然后向其中加入46克溶质质量分数为3.65%的稀盐酸,过量的稀盐酸用溶质质量分数为4.43%的氢氧化钠溶液恰好中和,用去氢氧化钠的溶液20.5g.蒸干中和后的溶液,可得到固体的质量为 ________?g。
19.?碲(Te)被誉为“现代工业、国防与尖端技术的维生素,创造人间奇迹的桥梁”.实验室模拟提取碲的一个实验是:取某含碲溶液于烧瓶中,加入适量NaC1,加热到一定温度,持续通入SO2 , 待反应一定时间,过滤得到粗碲。
(1)反应的总化学方程式为:TeOSO4+2SO2+3XTe↓+3H2SO4,则X为________?(填化学式)。
(2)为探究获得较高粗碲沉淀率的反应条件,某研究小组在控制NaC1浓度和SO2流量不变的条件下,进行下述对比试验,数据如下:
实验 温度/℃ 反应时间/h 粗蹄沉淀率
a 65 3.0 65.0
b 80 3.0 98.9
c 80 2.0 98.9
d 90 2.0 97.0
①该小组研究的反应条件是________和________ 。
②实验a和b的目的是________ 。
③在上述四组实验中,最佳的反应条件是________?℃和________?h。
④为了提升设备利用效率和节约能源,可进一步优化反应条件测定粗碲沉淀率.若再设计对比实验,选择的反应条件还可以是________?(填选项)。
A.80℃,1.5h?? B.80℃,2.5h??? C.70℃,2.0h??? D.95℃,2.0h.
20.?(1)下列氮肥含氮量由高到低是排列顺序是:________? (用序号表示)。
常见氮肥 ①NH4NO3 ②NH4HCO3 ③CO(NH2)2
相对分子质量 80 79 60
(2)治理汽车尾气中的NO和CO的一种方法是:在汽车的排气管上装一个催化转化装置。使NO和CO反应生成N2和CO2 , 写出该反应的化学方程式 ________?。
(3)有机物中碳氢化合物可用CxHy表示,其完全燃烧的化学方程式:CxHy+(x+)O2xCO2+H2O.判断等质量的①CH4 , ②C2H2 , ③C2H4 , 三种碳氢化合物完全燃烧消耗氧气由大到小的顺序是________?。(用序号表示)
21.?能源是人类生存和发展的基础,能源成为人们日益关注的问题。
(1)化石燃料包括煤、________?、天然气等,是重要的能源;目前正在利用和开发的新能源有核能、生物质能、________?(填一种)等。
(2)发射卫星的火箭可使用液氢作燃料,液氢在液氧中燃烧的化学方程式为________?,该反应属于基本反应类型中的________反应。
(3)物质R是一种可再生绿色能源,其燃烧的化学方程式为R+3O22CO2+3H2O,则R的化学式为________。
22.下列化学方程式正确的是________。
A.Cu+2HCl=CuCl2+H2↑???????????? B.Zn+2HNO3=Zn(NO3)2+H2↑
C.2Fe+3H2SO4=Fe2(SO4)3+3H2↑?????? D.SO2+2NaOH=Na2SO4+H2O
E.Cu+2AgCl=CuCl2+2Ag???????????? F.Cu(OH)2+Na2CO3=CuCO3↓+2NaOH
G.2Fe+3CuCl2=2FeCl3+3Cu?????????? H.Ba(NO3)2+CuSO4=Cu(NO3)2+BaSO4↓
23.某元素R的化合价无变价,已知其氧化物的式量为m,其氯化物的式量为n。则R的化合价为________。
24.学校运动会上短跑项目“发令枪”里的火药成分为KClO3 , MnO2和红磷,当扣动扳机时,①撞针撞击火药,产生热量使KClO3分解产生O2②并引燃红磷产生白烟.试分别写这两步反应的化学方程式。
①________; ②________基本反应类型是________。
25.以氧化铜、铁、稀硫酸三种物质为原料,设计两种不同的方法制取铜,写出有关的化学方程式。
方法一:________;
方法二:________。
三、实验探究题
26.科学研究小组的同学在用一定浓度的硫酸溶液处理废金属材料(主要是生铁、镀锌铁皮)时,溶液发烫并闻到了刺激性气味,这种反常现象引起了同学们的思考。从组成物质的元素角度分析,他们猜测气体可能是SO2、CO、CO2、H2中的一种或几种。为了确定该气体的成分,他们进行了如下探究。查阅资料:I.SO2、CO2都能与碱溶液反应生成盐和水,CaSO3难溶于水;II.SO2能与酸性高锰酸钾溶液反应并使它褪色,上述其它气体不能。
实验探究:
(1)甲同学为了验证处理废金属材料产生的气体中是否含有CO2 , 把它直接通入澄清石灰水,并观察实验现象。乙同学认为甲同学的做法不合理。请用化学方程式表示其原因________。
(2)同学们设计了一套合理的实验装置,如下图所示(铁架台已略去)。
请你从下列试剂中选择所需药品并完成实验(药品可重复选用):澄清石灰水、氢氧化钠溶液、酸性高锰酸钾溶液、浓硫酸、无水硫酸铜、碱石灰(假设每步反应都是完全的)
①写出E装置中试剂的名称或化学式________。
②若观察到________(填装置序号)中澄清石灰水变浑浊,证明原气体中有CO2。
③若观察到________的现象,证明原气体中有H2无CO。
27.小明同学学习了氢氧化钙和氢氧化钠的化学性质后知道:氢氧化钙和氢氧化钠都能与二氧化碳反应,二氧化碳通入澄清石灰水中能产生明显的现象。于是小明同学提出了一个问题:________?小明同学联想到在做“固体碘溶解在酒精中”的实验时,酒精作为溶剂能溶解固体碘。酒精能否溶解氢氧化钠和碳酸钠呢?小明查阅资料并通过实验获知:氢氧化钠不与酒精发生化学反应,但能溶解在酒精中形成无色透明的溶液,氢氧化钠的酒精溶液与氢氧化钠的水溶液化学性质相似,碳酸钠不与酒精反应也不溶于酒精。
至此,小明同学对自己提出的问题有了清晰的解决方案。
小明同学的解决方案是________。
写出解决方案中涉及到的化学方程式:________。
28.?据图中的实验常用仪器回答有关问题.
(1)仪器F的名称是________?。
(2)若用KMnO4加热制取氧气,应选用上述仪器中的________?(填序号);其化学反应方程式为________?;当用铁夹固定好试管后,要使试管口略低于试管底部,应调节螺旋________?(填“K1”、“K2”或“K3”);要调节试管与酒精灯相对高度,应调节螺旋________?(填“K1”、“K2”或“K3”)。
(3)若用废铁片与稀盐酸反应制取氢气,并装配一个使反应随时发生和停止的装置,应选上述仪器中的 ________?(填序号);若需测量收集到氢气的体积,则收集的仪器应选 ________?(填序号)。
(4)如图为某同学制作的微型实验装置(夹持仪器略).甲酸与热的浓硫酸反应的方程式为:
①HCOOHX+CO↑,则X是 ________?(填化学式);
②氧化铜的颜色变化为________?,其化学反应方程式为 ________?。
③此实验装置的主要优点是环保,其理由是________?(只写一点)。
参考答案
一、单选题
1.D 2.D 3.A 4.A 5.C 6.A 7.D 8.D 9.C 10.B 11.B 12.C 13.D 14.B 15.C
二、填空题
16. 2gN2或N2和H2的混合气体或N2和O2的混合气体
17. (1)342.9;(2)912.1
18. 2.691
19.(1) H2O;(2)①温度;反应时间;②比较相同时间,不同的反应温度对粗碲沉淀率的影响;③80℃;2.0h;④A
20.(1)③①②;(2)2CO+2NO2CO2+N2;(3)①③②
21.(1)石油;太阳能;(2)2H2+O2?2H2O;化合;(3)C2H5OH(或C2H6O)
22. H
23. 或
24. ①2KClO3 2KCl+3O2↑;②4P+5O2 2P2O5;化合反应
25.①Fe+H2SO4═FeSO4+H2↑;H2+CuO Cu+H2O;②CuO+H2SO4═CuSO4+H2O;CuSO4+Fe═FeSO4+Cu
三、实验探究题
26.(1)SO2+Ca(OH)2=CaSO3↓+H2O
(2)CuSO4;B;D装置中黑色粉末变成红色,E中的无水硫酸铜变蓝,F中的石灰水没有变化
27.能否让二氧化碳与氢氧化钠反应产生明显的现象;将二氧化碳通入氢氧化钠的酒精溶液中;CO2+2NaOH=Na2CO3↓+H2O
28.(1)量筒
(2)ABE;2KMnO4K2MnO4+MnO2+O2↑;K2;K1
(3)CDI;FGH
(4)①H2O;②黑色变红色;CO+CuOCu+CO2;③一氧化碳被点燃生成二氧化碳,不污染环境,并且节约能源
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
