第2节 常见的酸和碱第2课时课件(18张PPT)
文档属性
| 名称 | 第2节 常见的酸和碱第2课时课件(18张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 9.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-29 18:47:27 | ||
图片预览




文档简介
(共18张PPT)
常见的
酸和碱
(第二课时)
沪教版九年级化学第七章第二节
沪教版九年级化学第七章第二节
沪教版九年级化学第七章第二节
紫甘蓝怎么变红了?
实验探究1:慧眼识酸
现有甲、乙、丙三瓶的无色液体,分别是白醋、苏打水和食盐水中的一种,你能设计实验鉴别出这三瓶无色液体哪瓶是白醋吗?
无色酚酞? 紫色石蕊?
红色
无色
无色
红色
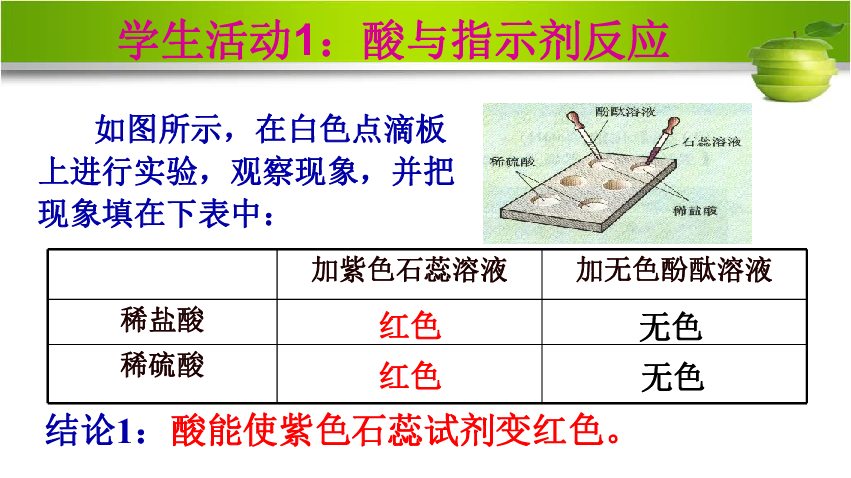
如图所示,在白色点滴板上进行实验,观察现象,并把现象填在下表中:
学生活动1:酸与指示剂反应
结论1:酸能使紫色石蕊试剂变红色。
加紫色石蕊溶液 加无色酚酞溶液
稀盐酸
稀硫酸
铝壶
铁壶
厨房中能否用铝壶或不锈钢壶长时间储存白醋?
实验探究2:谁是冠军?
金属王国的四位潜水健将——镁、锌、铁、铜正在进行一场潜“酸”大赛,冠军将花落谁家呢?我们拭目以待……
学生活动2:酸与金属单质反应
→
如图所示,在培养皿中加入镁、锌、铁、铜四种金属,并在培养皿正中间倒入酸至四种金属均与酸充分接触,观察现象,并记录现象。
课堂延伸:实验室制取氢气一般选择锌与酸反应。
反应非常剧烈,产生气泡
反应非常剧烈,产生气泡
反应速度适中,产生气泡
反应速度适中,产生气泡
反应比较慢,产生气泡
反应比较慢,产生气泡
酸能与活泼金属反应
与稀盐酸反应 与稀硫酸反应
镁 现象
反应的化学方程式
锌 现象
反应的化学方程式
铁 现象
反应的化学方程式
生锈的菜刀
生锈的铁锅
你有什么办法除去铁锅或菜刀上的铁锈?
砂纸
酸能与金属铁反应,能否与铁锈反应?
探究实验3:除锈专家
步骤:分别将生锈的铁钉(铁锈主要成分Fe2O3)放入稀盐酸和稀硫酸中,观察现象。
Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
仔细观察实验现象,并完成下列表格
探究实验3:酸与金属氧化物的反应
现象 化学方程式
铁锈+盐酸
铁锈+硫酸
1、利用上述反应清除金属制品表面的锈时,能否将金属制品长时间浸在酸中?为什么?
2、氧化铜能与稀硫酸发生化学反应吗?为什么?
当长时间浸泡时,与铁锈反应剩余的酸就会继续与铁反应。
溶液由无色变为蓝色
实验证明:氧化铜也能与酸反应。
请你写出氧化铜与盐酸或硫酸反应的化学方程式:
CuO + 2HCl = CuCl2+ H2O
CuO + H2SO4 = CuSO4+ H2O
结论3:酸能与金属氧化物反应生成盐和水。
Fe2O3+ 6HCl = 2FeCl3+ 3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
酸能与金属氧化物反应
厨房中泄露的白醋为什么会腐蚀大理石灶面?
泄露的白醋
被腐蚀的大理石灶面
根据上述化学方程式,你推测酸能与哪一类物质发生反应?
BaCl2 + H2SO4 = BaSO4 + 2HCl
酸能与某些盐反应
1.酸能使酸碱指示剂显示不同的颜色;
2.酸能与活泼金属反应,生成盐和氢气;
3.酸能与某些金属氧化物反应,生成盐和水;
酸有一些相似的化学性质:
为什么不同的酸有相似的化学性质呢?
酸在水溶液中都能电离出氢离子(H+),即不同的酸溶液中都含有氢离子(H+),所以它们具有相似的化学性质。
4.酸能与某些盐反应,生成新盐和新酸……
常见的
酸和碱
(第二课时)
沪教版九年级化学第七章第二节
沪教版九年级化学第七章第二节
沪教版九年级化学第七章第二节
紫甘蓝怎么变红了?
实验探究1:慧眼识酸
现有甲、乙、丙三瓶的无色液体,分别是白醋、苏打水和食盐水中的一种,你能设计实验鉴别出这三瓶无色液体哪瓶是白醋吗?
无色酚酞? 紫色石蕊?
红色
无色
无色
红色
如图所示,在白色点滴板上进行实验,观察现象,并把现象填在下表中:
学生活动1:酸与指示剂反应
结论1:酸能使紫色石蕊试剂变红色。
加紫色石蕊溶液 加无色酚酞溶液
稀盐酸
稀硫酸
铝壶
铁壶
厨房中能否用铝壶或不锈钢壶长时间储存白醋?
实验探究2:谁是冠军?
金属王国的四位潜水健将——镁、锌、铁、铜正在进行一场潜“酸”大赛,冠军将花落谁家呢?我们拭目以待……
学生活动2:酸与金属单质反应
→
如图所示,在培养皿中加入镁、锌、铁、铜四种金属,并在培养皿正中间倒入酸至四种金属均与酸充分接触,观察现象,并记录现象。
课堂延伸:实验室制取氢气一般选择锌与酸反应。
反应非常剧烈,产生气泡
反应非常剧烈,产生气泡
反应速度适中,产生气泡
反应速度适中,产生气泡
反应比较慢,产生气泡
反应比较慢,产生气泡
酸能与活泼金属反应
与稀盐酸反应 与稀硫酸反应
镁 现象
反应的化学方程式
锌 现象
反应的化学方程式
铁 现象
反应的化学方程式
生锈的菜刀
生锈的铁锅
你有什么办法除去铁锅或菜刀上的铁锈?
砂纸
酸能与金属铁反应,能否与铁锈反应?
探究实验3:除锈专家
步骤:分别将生锈的铁钉(铁锈主要成分Fe2O3)放入稀盐酸和稀硫酸中,观察现象。
Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
仔细观察实验现象,并完成下列表格
探究实验3:酸与金属氧化物的反应
现象 化学方程式
铁锈+盐酸
铁锈+硫酸
1、利用上述反应清除金属制品表面的锈时,能否将金属制品长时间浸在酸中?为什么?
2、氧化铜能与稀硫酸发生化学反应吗?为什么?
当长时间浸泡时,与铁锈反应剩余的酸就会继续与铁反应。
溶液由无色变为蓝色
实验证明:氧化铜也能与酸反应。
请你写出氧化铜与盐酸或硫酸反应的化学方程式:
CuO + 2HCl = CuCl2+ H2O
CuO + H2SO4 = CuSO4+ H2O
结论3:酸能与金属氧化物反应生成盐和水。
Fe2O3+ 6HCl = 2FeCl3+ 3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
酸能与金属氧化物反应
厨房中泄露的白醋为什么会腐蚀大理石灶面?
泄露的白醋
被腐蚀的大理石灶面
根据上述化学方程式,你推测酸能与哪一类物质发生反应?
BaCl2 + H2SO4 = BaSO4 + 2HCl
酸能与某些盐反应
1.酸能使酸碱指示剂显示不同的颜色;
2.酸能与活泼金属反应,生成盐和氢气;
3.酸能与某些金属氧化物反应,生成盐和水;
酸有一些相似的化学性质:
为什么不同的酸有相似的化学性质呢?
酸在水溶液中都能电离出氢离子(H+),即不同的酸溶液中都含有氢离子(H+),所以它们具有相似的化学性质。
4.酸能与某些盐反应,生成新盐和新酸……
