酸的性质复习课件(17张PPT)
图片预览


文档简介
(共17张PPT)
化学谜语竞猜
1.老者生来脾气燥,每逢喝水必高烧,高寿虽己九十八,性情依然不可交。(打一化学物质)
2.我入水中较安全,水入我中有危险,我与水合多放热,实验牢记保平安。(打一化学物质)
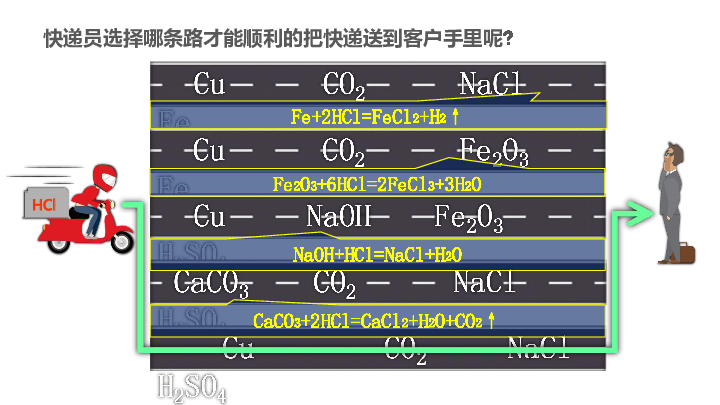
快递员选择哪条路才能顺利的把快递送到客户手里呢?
Fe2O3+6HCl=2FeCl3+3H2O
Fe+2HCl=FeCl2+H2↑
NaOH+HCl=NaCl+H2O
CaCO3+2HCl=CaCl2+H2O+CO2↑
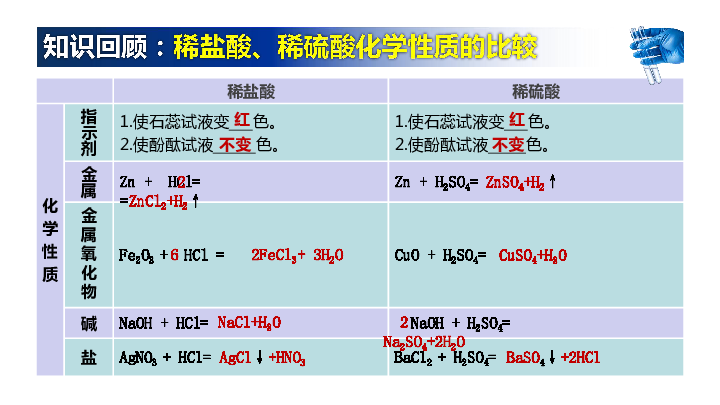
知识回顾:稀盐酸、稀硫酸化学性质的比较
红
红
不变
不变
2 =ZnCl2+H2↑
ZnSO4+H2↑
2 Na2SO4+2H2O
AgCl↓+HNO3
BaSO4↓+2HCl
6 2FeCl3+ 3H2O
CuSO4+H2O
NaCl+H2O
酸
指示剂
活泼金属
金属氧化物
碱
盐
H+
酸根离子
结构决定性质
规律提升——酸的通性
酸溶液都能电离出共同的阳离子—H+
学以致用——制备物质
根据酸的化学性质写出四种制备氯化镁的方法,用化学方程式表示。
①Mg+2HCl=MgCl2+H2↑
②MgO+2HCl=MgCl2+H2O
③Mg(OH)2+2HCl=MgCl2+2H2O
④MgCO3+2HCl=MgCl2+H2O+CO2↑
学以致用——鉴别物质
实验室中有两瓶失去标签的无色液体,一瓶是稀盐酸,另一瓶为稀硫酸。
①. 写出鉴别两种溶液的化学试剂。
②. 选择一种试剂简述鉴别方法。
规律总结——离子的检验
1.如何检验含Cl-的化合物?
先滴加AgNO3溶液,再滴几滴稀HNO3
2.如何检验含SO42-的化合物?
方法一:先滴加Ba(NO3)2溶液,再滴几滴稀HNO3
方法二:先滴几滴稀HCl,再滴加BaCl2溶液
3.当溶液中同时存在Cl-和SO42-时,如何检验?
先用足量Ba(NO3)2溶液,再用AgNO3溶液,然后加稀HNO3。
学以致用——除杂问题
1.如果稀盐酸中混有稀硫酸,你能想办法除净杂质吗?
先加入适量氯化钡溶液,充分反应后过滤
2.除杂质的原则
不增:不引入新杂质(加适量试剂)
不减:不改变原来的物质
易分:反应后的物质易分离
3.除杂质最常用的方法
转化法、气体法、沉淀法
在线测试——我能行!
1.下列说法正确的是( )
A.能电离出氢离子的化合物叫酸
B.电离出的阳离子全部是氢离子的物质叫酸
C.能电离出酸根离子的化合物都是酸
2.稀盐酸和稀硫酸具有许多的相似的化学性质的原因是( )
A.它们都是溶液 B.它们都含有酸根离子
C.它们都含有氢元素 D.它们都电离出了氢离子。
B
D
在线测试——我能行!
3.含下列离子的溶液中,溶质全部为酸的是( )
A.H+、Na+、SO42- B.H+、Cl-、NO3-
C.OH-、K+、Ba2+ D . Ag+、K+、NO3-
4.聪明的小红同学在烧水时发现壶中有许多水垢[水垢的主要成分是CaCO3和Mg(OH)2],想用下列物质除去水垢,你认为可行的是( )
A.用热的纯碱溶液浸泡后冲洗 B.用洗涤剂溶液浸泡后冲洗
C.用食盐水浸泡后冲洗 D.用食醋浸泡后冲洗
B
D
实验探究
小青同学做硫在氧气中燃烧的实验前,预先在集气瓶底装有少量水。实验过程中她联想到老师介绍过二氧化硫排放到空气中会形成酸雨,于是想了解燃烧后集气瓶底部残留的“水”是否也呈酸性。
她取“水”多次测其pH,发现其pH始终小于7并逐渐减小,直至稳定在pH=4,证明集气瓶底残留液呈酸性。
随后小青想进一步了解该残留液是否具有酸的通性,请你与她一起探究。(温馨提示:酸雨的形成SO2+H2O=H2SO3,2H2SO3+O2=2H2SO4)
我会分析
残留液还能与什么物质反应呢?
试剂 可能观察到的现象 结论
1 石蕊试液 紫色石蕊试液变为红色 残留液能与石蕊试液反应
2 铁粉 铁粉逐渐溶解,溶液由无色变为浅绿色,有大量气泡生成 残留液能与铁粉反应
3 氧化铜 黑色粉末逐渐溶解,溶液由无色变为蓝色 残留液能与氧化铜反应
4 氢氧化铜 蓝色粉末逐渐溶解,溶液由无色变为蓝色 残留液能与氢氧化铜反应
5 碳酸钠粉末 碳酸钠粉末消失,有大量气泡生成 残留液能与碳酸钠粉
反应
试剂 可能观察到的现象 结论
1 石蕊试液
2 铁粉
3 氧化铜
4 氢氧化铜
5 碳酸钠粉末
归纳总结
这些方法体现了酸溶液有哪些化学性质?
酸溶液能与指示剂反应
酸+金属→盐+氢气
酸+金属氧化物→盐+水
酸+碱→盐+水
酸+盐→新酸+新盐
结构决定性质
不靠猜想,而要根据事实。——安托万·洛朗·拉瓦锡
化学谜语竞猜
1.老者生来脾气燥,每逢喝水必高烧,高寿虽己九十八,性情依然不可交。(打一化学物质)
2.我入水中较安全,水入我中有危险,我与水合多放热,实验牢记保平安。(打一化学物质)
快递员选择哪条路才能顺利的把快递送到客户手里呢?
Fe2O3+6HCl=2FeCl3+3H2O
Fe+2HCl=FeCl2+H2↑
NaOH+HCl=NaCl+H2O
CaCO3+2HCl=CaCl2+H2O+CO2↑
知识回顾:稀盐酸、稀硫酸化学性质的比较
红
红
不变
不变
2 =ZnCl2+H2↑
ZnSO4+H2↑
2 Na2SO4+2H2O
AgCl↓+HNO3
BaSO4↓+2HCl
6 2FeCl3+ 3H2O
CuSO4+H2O
NaCl+H2O
酸
指示剂
活泼金属
金属氧化物
碱
盐
H+
酸根离子
结构决定性质
规律提升——酸的通性
酸溶液都能电离出共同的阳离子—H+
学以致用——制备物质
根据酸的化学性质写出四种制备氯化镁的方法,用化学方程式表示。
①Mg+2HCl=MgCl2+H2↑
②MgO+2HCl=MgCl2+H2O
③Mg(OH)2+2HCl=MgCl2+2H2O
④MgCO3+2HCl=MgCl2+H2O+CO2↑
学以致用——鉴别物质
实验室中有两瓶失去标签的无色液体,一瓶是稀盐酸,另一瓶为稀硫酸。
①. 写出鉴别两种溶液的化学试剂。
②. 选择一种试剂简述鉴别方法。
规律总结——离子的检验
1.如何检验含Cl-的化合物?
先滴加AgNO3溶液,再滴几滴稀HNO3
2.如何检验含SO42-的化合物?
方法一:先滴加Ba(NO3)2溶液,再滴几滴稀HNO3
方法二:先滴几滴稀HCl,再滴加BaCl2溶液
3.当溶液中同时存在Cl-和SO42-时,如何检验?
先用足量Ba(NO3)2溶液,再用AgNO3溶液,然后加稀HNO3。
学以致用——除杂问题
1.如果稀盐酸中混有稀硫酸,你能想办法除净杂质吗?
先加入适量氯化钡溶液,充分反应后过滤
2.除杂质的原则
不增:不引入新杂质(加适量试剂)
不减:不改变原来的物质
易分:反应后的物质易分离
3.除杂质最常用的方法
转化法、气体法、沉淀法
在线测试——我能行!
1.下列说法正确的是( )
A.能电离出氢离子的化合物叫酸
B.电离出的阳离子全部是氢离子的物质叫酸
C.能电离出酸根离子的化合物都是酸
2.稀盐酸和稀硫酸具有许多的相似的化学性质的原因是( )
A.它们都是溶液 B.它们都含有酸根离子
C.它们都含有氢元素 D.它们都电离出了氢离子。
B
D
在线测试——我能行!
3.含下列离子的溶液中,溶质全部为酸的是( )
A.H+、Na+、SO42- B.H+、Cl-、NO3-
C.OH-、K+、Ba2+ D . Ag+、K+、NO3-
4.聪明的小红同学在烧水时发现壶中有许多水垢[水垢的主要成分是CaCO3和Mg(OH)2],想用下列物质除去水垢,你认为可行的是( )
A.用热的纯碱溶液浸泡后冲洗 B.用洗涤剂溶液浸泡后冲洗
C.用食盐水浸泡后冲洗 D.用食醋浸泡后冲洗
B
D
实验探究
小青同学做硫在氧气中燃烧的实验前,预先在集气瓶底装有少量水。实验过程中她联想到老师介绍过二氧化硫排放到空气中会形成酸雨,于是想了解燃烧后集气瓶底部残留的“水”是否也呈酸性。
她取“水”多次测其pH,发现其pH始终小于7并逐渐减小,直至稳定在pH=4,证明集气瓶底残留液呈酸性。
随后小青想进一步了解该残留液是否具有酸的通性,请你与她一起探究。(温馨提示:酸雨的形成SO2+H2O=H2SO3,2H2SO3+O2=2H2SO4)
我会分析
残留液还能与什么物质反应呢?
试剂 可能观察到的现象 结论
1 石蕊试液 紫色石蕊试液变为红色 残留液能与石蕊试液反应
2 铁粉 铁粉逐渐溶解,溶液由无色变为浅绿色,有大量气泡生成 残留液能与铁粉反应
3 氧化铜 黑色粉末逐渐溶解,溶液由无色变为蓝色 残留液能与氧化铜反应
4 氢氧化铜 蓝色粉末逐渐溶解,溶液由无色变为蓝色 残留液能与氢氧化铜反应
5 碳酸钠粉末 碳酸钠粉末消失,有大量气泡生成 残留液能与碳酸钠粉
反应
试剂 可能观察到的现象 结论
1 石蕊试液
2 铁粉
3 氧化铜
4 氢氧化铜
5 碳酸钠粉末
归纳总结
这些方法体现了酸溶液有哪些化学性质?
酸溶液能与指示剂反应
酸+金属→盐+氢气
酸+金属氧化物→盐+水
酸+碱→盐+水
酸+盐→新酸+新盐
结构决定性质
不靠猜想,而要根据事实。——安托万·洛朗·拉瓦锡
