九年级化学沪教版下学期第七章7.2.3《中和反应》(共29张PPT)
文档属性
| 名称 | 九年级化学沪教版下学期第七章7.2.3《中和反应》(共29张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-08-12 00:00:00 | ||
图片预览


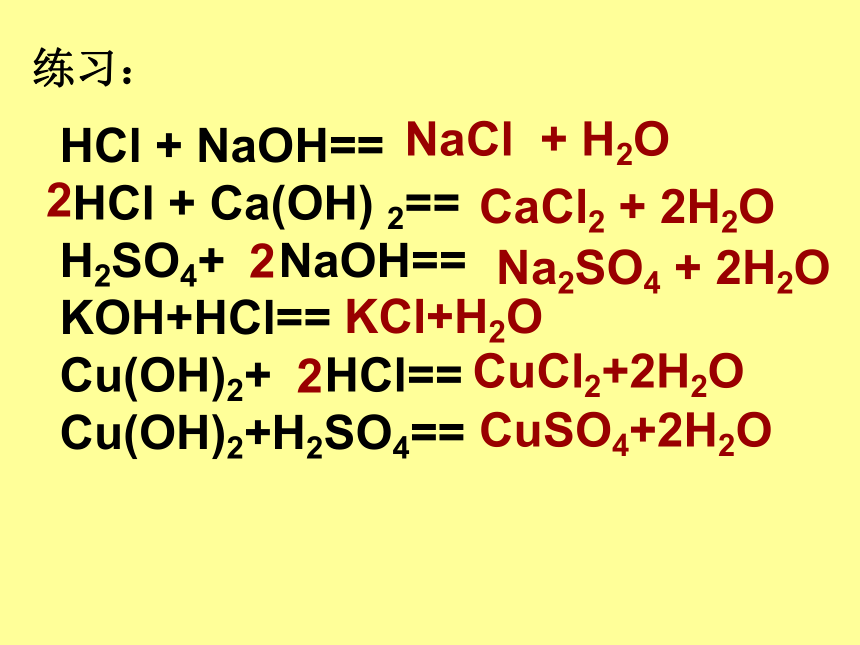
文档简介
(共37张PPT)
第2节
常见的酸和碱
中和反应
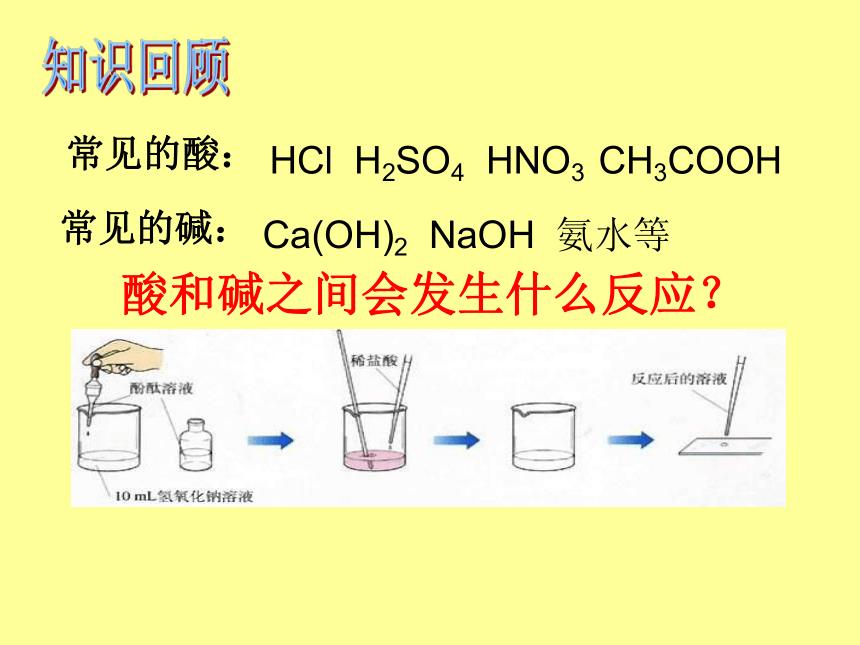
常见的酸:
常见的碱:
酸和碱之间会发生什么反应?
HCl
H2SO4
HNO3
CH3COOH
Ca(OH)2
NaOH
氨水等
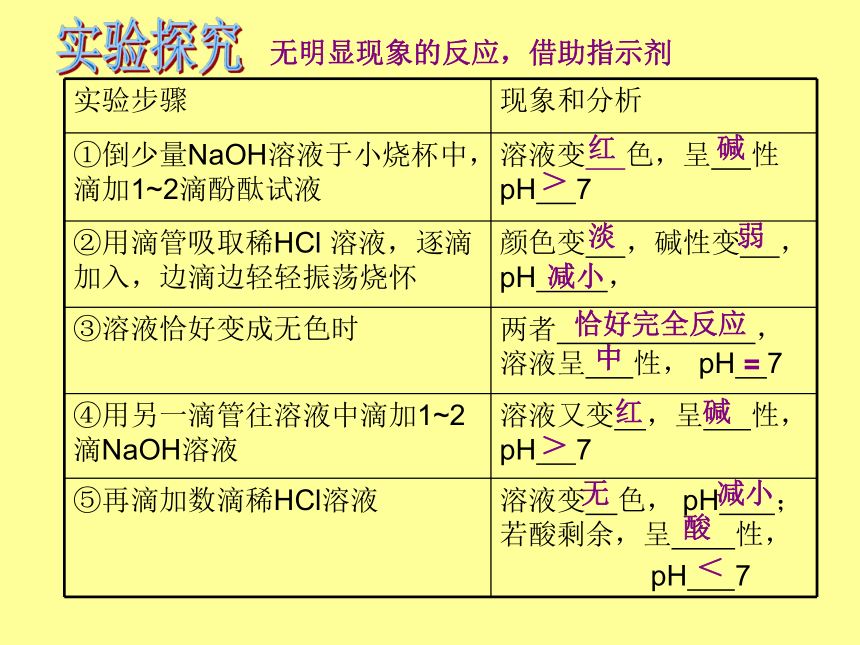
实验步骤
现象和分析
①倒少量NaOH溶液于小烧杯中,
滴加1~2滴酚酞试液
溶液变
色,呈
性pH
7
②用滴管吸取稀HCl
溶液,逐滴加入,边滴边轻轻振荡烧怀
颜色变
,碱性变
,pH
,
③溶液恰好变成无色时
两者
,溶液呈
性,
pH
7
④用另一滴管往溶液中滴加1~2滴NaOH溶液
溶液又变
,呈
性,
pH
7
⑤再滴加数滴稀HCl溶液
溶液变
色,
pH
;若酸剩余,呈
性,
pH
7
红
碱
>
淡
弱
减小
恰好完全反应
中
=
红
碱
>
无
减小
酸
<
无明显现象的反应,借助指示剂
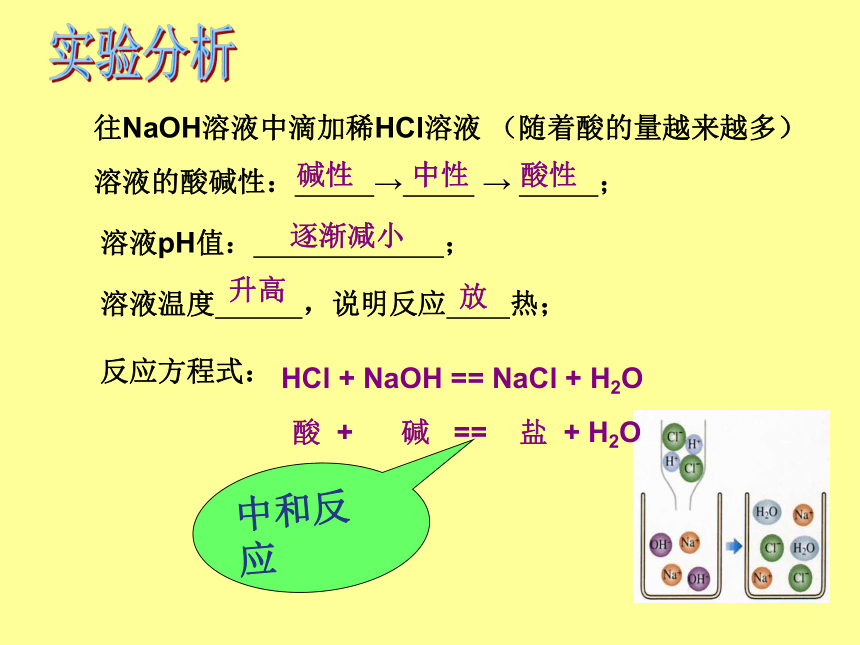
往NaOH溶液中滴加稀HCl溶液
(随着酸的量越来越多)
溶液的酸碱性:
→
→
;
溶液pH值:
;
溶液温度
,说明反应
热;
碱性
中性
酸性
逐渐减小
升高
放
反应方程式:
HCl
+
NaOH
==
NaCl
+
H2O
酸
+
碱
==
盐
+
H2O
中和反应
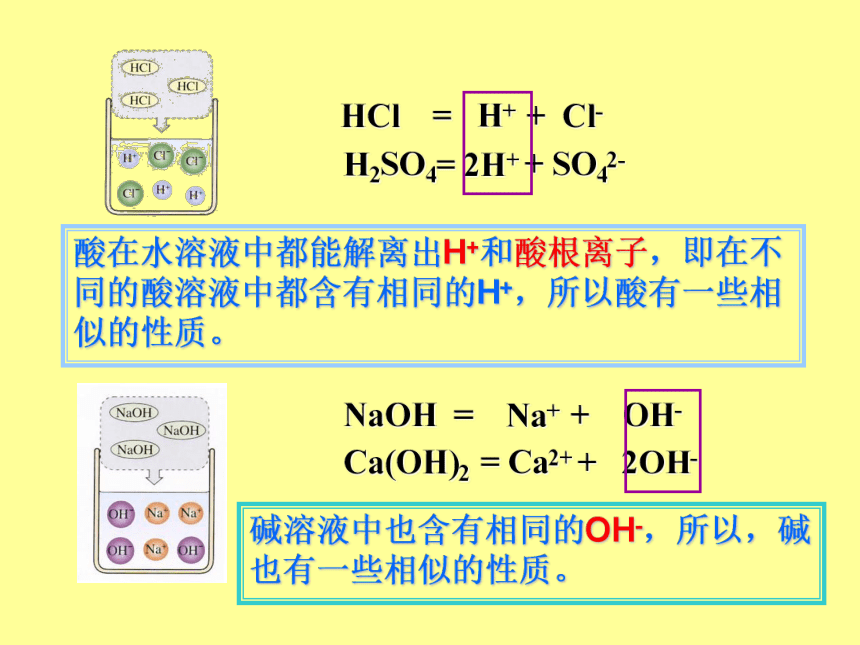
酸碱溶液中的粒子
酸溶液为什么具有一些相似的化学性质
碱溶液为什么也具有一些相似的化学性质
物质
盐酸
硫酸
NaOH溶液
Ca(OH)2溶液
蒸馏水
乙醇
导电性
酸溶液、碱溶液为什么能导电?而蒸馏水、乙醇为什么不导电?
×
×
自由移动的离子
HCl
=
H+
+
Cl-
H2SO4=
2H+
+
SO42-
NaOH
= Na+
+
OH-
Ca(OH)2
=
Ca2+
+
2OH-
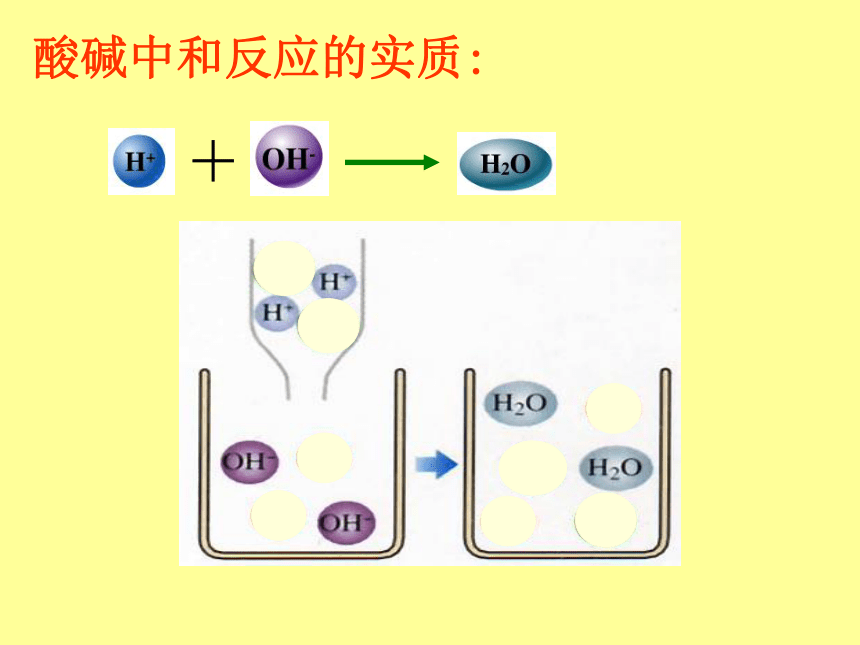
酸在水溶液中都能解离出H+和酸根离子,即在不同的酸溶液中都含有相同的H+,所以酸有一些相似的性质。
碱溶液中也含有相同的OH-,所以,碱也有一些相似的性质。
酸碱中和反应的实质:
+
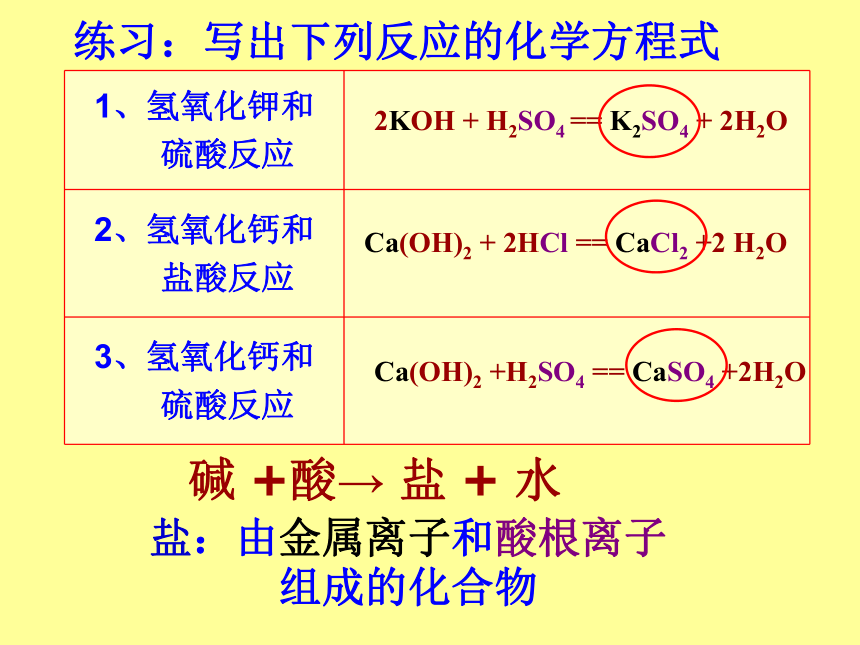
练习:写出下列反应的化学方程式
1、氢氧化钾和
硫酸反应
2、氢氧化钙和
盐酸反应
3、氢氧化钙和
硫酸反应
2KOH
+
H2SO4
==
K2SO4
+
2H2O
Ca(OH)2
+
2HCl
==
CaCl2
+2
H2O
Ca(OH)2
+H2SO4
==
CaSO4
+2H2O
盐:由金属离子和酸根离子
组成的化合物
碱
+酸→
盐
+
水
练习:
HCl
+
NaOH==
HCl
+
Ca(OH)
2==
H2SO4+
NaOH==
KOH+HCl==
Cu(OH)2+
HCl==
Cu(OH)2+H2SO4==
NaCl
+
H2O
CaCl2
+
2H2O
Na2SO4
+
2H2O
2
2
KCl+H2O
CuCl2+2H2O
2
CuSO4+2H2O
注意
中
和反应一定有盐和水生成,但有盐和水生成的反应不一定是中和反应。
如:CuO+H2SO4==CuSO4+H2O
金属氧化物+酸==盐+水
Fe2O3+6HCl==2FeCl3+3H2O
你认为判断一个反应是不是中和反应的关键是什么?
反应物必须是酸与碱,生成物必须是盐和水
例:H2SO4
+
Cu(OH)2
=
CuSO4+2H2O
化合反应
复分解反应
分解反应
置换反应
中和反应
加盐酸溶液的体积/mL
0
2
4
6
8
10
12
14
16
18
烧杯溶液的pH
12.5
12.4
12.2
11.0
7.0
2.0
1.6
1.4
1.2
1.1
分析表中数据,并绘出溶液的pH变化图。
无明显现象的反应,还可以利用高科技手段,测其pH值的变化、温度的变化、物质浓度等等
盐酸和氢氧化钠反应过程中溶液酸碱性的变化
往氢氧化钠溶液中滴加盐酸溶液
溶液酸碱性的变化
0
2
4
6
8
10
12
14
16
18
V/mL
12
11
10
9
8
7
6
5
4
3
2
1
pH
往氢氧化钠溶液中滴加盐酸溶液
说明两者确实发生了反应
A
B
C
D
曲线上各点的溶质分析
A只有碱:NaOH
B酸不足:NaCl、NaOH
C恰好完全反应:NaCl
D酸过量:NaCl、HCl
溶液温度的变化
0
2
4
6
8
10
12
14
16
18
20
V/mL
20
18
16
14
12
10
8
6
4
2
△t/℃
往氢氧化钠溶液中滴加盐酸溶液
也能说明两者确实发生了反应
加盐酸溶液的体积/mL
0
2
4
6
8
10
12
14
16
18
溶液温度上升△t/℃
12.5
12.4
12.2
11.0
7.0
2.0
1.6
1.4
1.2
1.1
课本P51
12
A
B
C
D
曲线走势分析
A只有碱:NaOH
B酸不足:NaCl、NaOH
C恰好完全反应:NaCl
D酸过量:NaCl、HCl
A→C温度升高,因中和反应放热,为中和反应过程
C→D温度降低,加入的酸过量,分散了热量
蜜蜂蛰伤
蚊子叮咬
蚊虫叮咬时,在蚊子的口器中分泌出一种有机酸--蚁酸,在家庭中可用肥皂水涂抹可迅速止痒。
显碱性
1、用稀氨水或肥皂水止痛、消肿
(制成含碱性物质的药水,
防蚊虫叮咬)
中和反应在实际生活中的应用
植物需要在一定酸碱性的土壤中生长,但近年来由于不合理使用化肥,或酸雨的形成,破坏土壤的酸碱性,不利于植物的生长,应怎样去改变酸性土壤?
能用生石灰代替熟石灰吗?为什么?
也可以用生石灰代替熟石灰:
CaO
+
H2O
==
Ca(OH)2
酸性的土壤用碱性物质中和,如熟石灰等。
碱性的土壤用酸性的肥料。
能用氢氧化钠代替熟石灰吗?为什么?
不能,氢氧化钠碱性太强、腐蚀性太强
反应后
H+和
OH-结合生成中性的水,溶液的酸碱性也随之改变。因此,在工农业生产中常利用中和反应调节溶液的酸碱性或pH大小。
某硫酸厂排出的废水中含有硫酸等杂质,严重危害当地的生态环境,你会怎样处理这些废水呢?
用碱性物质(例如熟石灰)进行中和处理。
Ca(OH)2
+
H2
SO4
==
CaSO4
+
2H2O
胃药胶囊的主要成分
胃酸的主要成分是
盐酸
氢氧化铝、氢氧化镁
Al(OH)3
+
3HCl==AlCl3
+
3H2O(治疗胃酸过多)
氢氧化铝能中和胃酸的化学方程式
氢氧化镁也能中和胃酸,化学方程式
Mg(OH)2
+
2HCl==MgCl2
+
2H2O
碳酸氢钠也能和胃酸反应,化学方程式
NaHCO3
+
HCl==NaCl
+
H2O
+
CO2↑(不是中和反应原理)
1、反应实质:
酸
+
碱
==
盐
+
H2O
2、反应放热
复分解反应中的一种
3、应用:
3、处理工厂废水、调节溶液酸碱性
2、改变土壤的酸碱性
农业上用熟石灰改良酸性土壤
1、用稀氨水或肥皂水止痛、消肿
(制成含碱性物质的药水,
防蚊虫叮咬)
4、用于医药:如治疗胃酸过多等
加氢氧化钠溶液的体积/mL
0
2
4
6
8
10
12
14
16
18
烧杯溶液的pH
1.1
1.2
1.4
1.6
2.0
7.0
11.0
12.2
12.4
12.5
盐酸和氢氧化钠反应过程中溶液酸碱性的变化
分析表中数据,并绘出溶液的pH变化图。
向5%的稀盐酸中滴加5%的氢氧化钠溶液,又该怎么分析呢?
盐酸和氢氧化钠反应过程中溶液酸碱性的变化
0
2
4
6
8
10
12
14
16
18
V/mL
12
11
10
9
8
7
6
5
4
3
2
1
pH
实验步骤
现象和分析
①倒少量
HCl溶液于小烧杯中,
滴加1~2滴紫色石蕊试液
溶液变
色,呈
性pH
7
②用滴管吸取稀NaOH溶液,逐滴加入,边滴边轻轻振荡烧怀
颜色变
,碱性变
,pH
,
③溶液恰好变成紫色时
两者
,溶液呈
性,
pH
7
④用另一滴管往溶液中滴加1~2滴HCl溶液
溶液又变
,呈
性,
pH
7
⑤再滴加数滴稀NaOH溶液
溶液变
色,
pH
;若碱剩余,
呈
性,
pH
7
红
酸
<
淡
弱
增大
恰好完全反应
中
=
红
酸
<
紫再变蓝
增大
碱
>
无明显现象的反应,借助指示剂
向稀盐酸中滴加氢氧化钠溶液:
(1)当滴入氢氧化钠溶液不足时,pH<7,溶液显酸性,HCl有剩余。
(2)当滴入氢氧化钠溶液与HCl恰好完全反应时,
pH=7,溶液显中性。
(3)当滴入氢氧化钠溶液过量时,pH>7,溶液显碱性,氢氧化钠有剩余。
实验结论
知识点一:中和反应及酸碱性强弱pH变化曲线分析
1.
向NaOH溶液中不断滴加稀盐酸,溶液pH随加
入盐酸体积变化与下图相符的是
(
)
A
B
C
D
pH
14
盐酸的体积
0
pH
14
7
盐酸的体积
0
盐酸的体积
14
7
0
pH
盐酸的体积
14
7
0
pH
7
C
2.在氢氧化钠溶液中不断地加入水,下列能正确表示溶液的pH值变化的曲线是(
)
7
7
7
7
A
水
B
水
C
水
D
水
pH
pH
pH
pH
指导:一看起点
二看趋势
三看终点
解图像题的“三看”
D
4.下列反应,属于中和反应的是(
)
A
Zn
+2HCl
==
ZnCl2
+
H2
B
CuO
+
2HCl
==
CuCl2
+
H2O
C
Cu(OH)2
+
H2SO4
==
CuSO4
+
2H2O
D
AgNO3
+
HCl
==
AgCl
+
HNO3
C
5.完成下列化学方程式:
①
Cu(OH)2
+
H2SO4
===
+
②
KOH
+
===
K2SO4
+
③用稀盐酸除水垢(主要成分是碳酸钙和氢氧化镁)
CuSO4
2H2O
2
H2SO4
2H2O
Mg(OH)2
+
2HCl
===
MgCl2
+
2H2O
CaCO3
+
2HCl
===
CaCl2
+H2O
+
CO2
6.下列各组物质通常借助指示剂才能证明是否反应的是(
)
A.氢氧化铜和稀盐酸
B.石灰石和稀盐酸
C.氢氧化钙与碳酸钠反应
D.烧碱和稀硫酸
D
7.酸与碱作用生成盐和水的反应,叫做中和反应。
它在工农业生产和日常生活中有广泛的用途。下列应用一定与中和反应原理无关的是(
)
A.施用熟石灰改良酸性土壤
B.服用含Al(OH)3的药物治疗胃酸过多
C.用大理石和盐酸制取CO2
D.用NaOH溶液洗涤石油产品中的残余硫酸
C
第2节
常见的酸和碱
中和反应
常见的酸:
常见的碱:
酸和碱之间会发生什么反应?
HCl
H2SO4
HNO3
CH3COOH
Ca(OH)2
NaOH
氨水等
实验步骤
现象和分析
①倒少量NaOH溶液于小烧杯中,
滴加1~2滴酚酞试液
溶液变
色,呈
性pH
7
②用滴管吸取稀HCl
溶液,逐滴加入,边滴边轻轻振荡烧怀
颜色变
,碱性变
,pH
,
③溶液恰好变成无色时
两者
,溶液呈
性,
pH
7
④用另一滴管往溶液中滴加1~2滴NaOH溶液
溶液又变
,呈
性,
pH
7
⑤再滴加数滴稀HCl溶液
溶液变
色,
pH
;若酸剩余,呈
性,
pH
7
红
碱
>
淡
弱
减小
恰好完全反应
中
=
红
碱
>
无
减小
酸
<
无明显现象的反应,借助指示剂
往NaOH溶液中滴加稀HCl溶液
(随着酸的量越来越多)
溶液的酸碱性:
→
→
;
溶液pH值:
;
溶液温度
,说明反应
热;
碱性
中性
酸性
逐渐减小
升高
放
反应方程式:
HCl
+
NaOH
==
NaCl
+
H2O
酸
+
碱
==
盐
+
H2O
中和反应
酸碱溶液中的粒子
酸溶液为什么具有一些相似的化学性质
碱溶液为什么也具有一些相似的化学性质
物质
盐酸
硫酸
NaOH溶液
Ca(OH)2溶液
蒸馏水
乙醇
导电性
酸溶液、碱溶液为什么能导电?而蒸馏水、乙醇为什么不导电?
×
×
自由移动的离子
HCl
=
H+
+
Cl-
H2SO4=
2H+
+
SO42-
NaOH
= Na+
+
OH-
Ca(OH)2
=
Ca2+
+
2OH-
酸在水溶液中都能解离出H+和酸根离子,即在不同的酸溶液中都含有相同的H+,所以酸有一些相似的性质。
碱溶液中也含有相同的OH-,所以,碱也有一些相似的性质。
酸碱中和反应的实质:
+
练习:写出下列反应的化学方程式
1、氢氧化钾和
硫酸反应
2、氢氧化钙和
盐酸反应
3、氢氧化钙和
硫酸反应
2KOH
+
H2SO4
==
K2SO4
+
2H2O
Ca(OH)2
+
2HCl
==
CaCl2
+2
H2O
Ca(OH)2
+H2SO4
==
CaSO4
+2H2O
盐:由金属离子和酸根离子
组成的化合物
碱
+酸→
盐
+
水
练习:
HCl
+
NaOH==
HCl
+
Ca(OH)
2==
H2SO4+
NaOH==
KOH+HCl==
Cu(OH)2+
HCl==
Cu(OH)2+H2SO4==
NaCl
+
H2O
CaCl2
+
2H2O
Na2SO4
+
2H2O
2
2
KCl+H2O
CuCl2+2H2O
2
CuSO4+2H2O
注意
中
和反应一定有盐和水生成,但有盐和水生成的反应不一定是中和反应。
如:CuO+H2SO4==CuSO4+H2O
金属氧化物+酸==盐+水
Fe2O3+6HCl==2FeCl3+3H2O
你认为判断一个反应是不是中和反应的关键是什么?
反应物必须是酸与碱,生成物必须是盐和水
例:H2SO4
+
Cu(OH)2
=
CuSO4+2H2O
化合反应
复分解反应
分解反应
置换反应
中和反应
加盐酸溶液的体积/mL
0
2
4
6
8
10
12
14
16
18
烧杯溶液的pH
12.5
12.4
12.2
11.0
7.0
2.0
1.6
1.4
1.2
1.1
分析表中数据,并绘出溶液的pH变化图。
无明显现象的反应,还可以利用高科技手段,测其pH值的变化、温度的变化、物质浓度等等
盐酸和氢氧化钠反应过程中溶液酸碱性的变化
往氢氧化钠溶液中滴加盐酸溶液
溶液酸碱性的变化
0
2
4
6
8
10
12
14
16
18
V/mL
12
11
10
9
8
7
6
5
4
3
2
1
pH
往氢氧化钠溶液中滴加盐酸溶液
说明两者确实发生了反应
A
B
C
D
曲线上各点的溶质分析
A只有碱:NaOH
B酸不足:NaCl、NaOH
C恰好完全反应:NaCl
D酸过量:NaCl、HCl
溶液温度的变化
0
2
4
6
8
10
12
14
16
18
20
V/mL
20
18
16
14
12
10
8
6
4
2
△t/℃
往氢氧化钠溶液中滴加盐酸溶液
也能说明两者确实发生了反应
加盐酸溶液的体积/mL
0
2
4
6
8
10
12
14
16
18
溶液温度上升△t/℃
12.5
12.4
12.2
11.0
7.0
2.0
1.6
1.4
1.2
1.1
课本P51
12
A
B
C
D
曲线走势分析
A只有碱:NaOH
B酸不足:NaCl、NaOH
C恰好完全反应:NaCl
D酸过量:NaCl、HCl
A→C温度升高,因中和反应放热,为中和反应过程
C→D温度降低,加入的酸过量,分散了热量
蜜蜂蛰伤
蚊子叮咬
蚊虫叮咬时,在蚊子的口器中分泌出一种有机酸--蚁酸,在家庭中可用肥皂水涂抹可迅速止痒。
显碱性
1、用稀氨水或肥皂水止痛、消肿
(制成含碱性物质的药水,
防蚊虫叮咬)
中和反应在实际生活中的应用
植物需要在一定酸碱性的土壤中生长,但近年来由于不合理使用化肥,或酸雨的形成,破坏土壤的酸碱性,不利于植物的生长,应怎样去改变酸性土壤?
能用生石灰代替熟石灰吗?为什么?
也可以用生石灰代替熟石灰:
CaO
+
H2O
==
Ca(OH)2
酸性的土壤用碱性物质中和,如熟石灰等。
碱性的土壤用酸性的肥料。
能用氢氧化钠代替熟石灰吗?为什么?
不能,氢氧化钠碱性太强、腐蚀性太强
反应后
H+和
OH-结合生成中性的水,溶液的酸碱性也随之改变。因此,在工农业生产中常利用中和反应调节溶液的酸碱性或pH大小。
某硫酸厂排出的废水中含有硫酸等杂质,严重危害当地的生态环境,你会怎样处理这些废水呢?
用碱性物质(例如熟石灰)进行中和处理。
Ca(OH)2
+
H2
SO4
==
CaSO4
+
2H2O
胃药胶囊的主要成分
胃酸的主要成分是
盐酸
氢氧化铝、氢氧化镁
Al(OH)3
+
3HCl==AlCl3
+
3H2O(治疗胃酸过多)
氢氧化铝能中和胃酸的化学方程式
氢氧化镁也能中和胃酸,化学方程式
Mg(OH)2
+
2HCl==MgCl2
+
2H2O
碳酸氢钠也能和胃酸反应,化学方程式
NaHCO3
+
HCl==NaCl
+
H2O
+
CO2↑(不是中和反应原理)
1、反应实质:
酸
+
碱
==
盐
+
H2O
2、反应放热
复分解反应中的一种
3、应用:
3、处理工厂废水、调节溶液酸碱性
2、改变土壤的酸碱性
农业上用熟石灰改良酸性土壤
1、用稀氨水或肥皂水止痛、消肿
(制成含碱性物质的药水,
防蚊虫叮咬)
4、用于医药:如治疗胃酸过多等
加氢氧化钠溶液的体积/mL
0
2
4
6
8
10
12
14
16
18
烧杯溶液的pH
1.1
1.2
1.4
1.6
2.0
7.0
11.0
12.2
12.4
12.5
盐酸和氢氧化钠反应过程中溶液酸碱性的变化
分析表中数据,并绘出溶液的pH变化图。
向5%的稀盐酸中滴加5%的氢氧化钠溶液,又该怎么分析呢?
盐酸和氢氧化钠反应过程中溶液酸碱性的变化
0
2
4
6
8
10
12
14
16
18
V/mL
12
11
10
9
8
7
6
5
4
3
2
1
pH
实验步骤
现象和分析
①倒少量
HCl溶液于小烧杯中,
滴加1~2滴紫色石蕊试液
溶液变
色,呈
性pH
7
②用滴管吸取稀NaOH溶液,逐滴加入,边滴边轻轻振荡烧怀
颜色变
,碱性变
,pH
,
③溶液恰好变成紫色时
两者
,溶液呈
性,
pH
7
④用另一滴管往溶液中滴加1~2滴HCl溶液
溶液又变
,呈
性,
pH
7
⑤再滴加数滴稀NaOH溶液
溶液变
色,
pH
;若碱剩余,
呈
性,
pH
7
红
酸
<
淡
弱
增大
恰好完全反应
中
=
红
酸
<
紫再变蓝
增大
碱
>
无明显现象的反应,借助指示剂
向稀盐酸中滴加氢氧化钠溶液:
(1)当滴入氢氧化钠溶液不足时,pH<7,溶液显酸性,HCl有剩余。
(2)当滴入氢氧化钠溶液与HCl恰好完全反应时,
pH=7,溶液显中性。
(3)当滴入氢氧化钠溶液过量时,pH>7,溶液显碱性,氢氧化钠有剩余。
实验结论
知识点一:中和反应及酸碱性强弱pH变化曲线分析
1.
向NaOH溶液中不断滴加稀盐酸,溶液pH随加
入盐酸体积变化与下图相符的是
(
)
A
B
C
D
pH
14
盐酸的体积
0
pH
14
7
盐酸的体积
0
盐酸的体积
14
7
0
pH
盐酸的体积
14
7
0
pH
7
C
2.在氢氧化钠溶液中不断地加入水,下列能正确表示溶液的pH值变化的曲线是(
)
7
7
7
7
A
水
B
水
C
水
D
水
pH
pH
pH
pH
指导:一看起点
二看趋势
三看终点
解图像题的“三看”
D
4.下列反应,属于中和反应的是(
)
A
Zn
+2HCl
==
ZnCl2
+
H2
B
CuO
+
2HCl
==
CuCl2
+
H2O
C
Cu(OH)2
+
H2SO4
==
CuSO4
+
2H2O
D
AgNO3
+
HCl
==
AgCl
+
HNO3
C
5.完成下列化学方程式:
①
Cu(OH)2
+
H2SO4
===
+
②
KOH
+
===
K2SO4
+
③用稀盐酸除水垢(主要成分是碳酸钙和氢氧化镁)
CuSO4
2H2O
2
H2SO4
2H2O
Mg(OH)2
+
2HCl
===
MgCl2
+
2H2O
CaCO3
+
2HCl
===
CaCl2
+H2O
+
CO2
6.下列各组物质通常借助指示剂才能证明是否反应的是(
)
A.氢氧化铜和稀盐酸
B.石灰石和稀盐酸
C.氢氧化钙与碳酸钠反应
D.烧碱和稀硫酸
D
7.酸与碱作用生成盐和水的反应,叫做中和反应。
它在工农业生产和日常生活中有广泛的用途。下列应用一定与中和反应原理无关的是(
)
A.施用熟石灰改良酸性土壤
B.服用含Al(OH)3的药物治疗胃酸过多
C.用大理石和盐酸制取CO2
D.用NaOH溶液洗涤石油产品中的残余硫酸
C
